羊血浆蛋白对鲢鱼鱼糜凝胶特性的影响
李景敏,于楠楠,李芮洋,周成伟,刘照
(徐州工程学院,江苏 徐州,221000)
我国是水产品生产大国,拥有丰富的淡水鱼资源。2017年淡水产品产量3 123.59万t,淡水养殖鱼类2 540.98万t[1]。近年来,淡水鱼鱼糜制品的开发生产深受中国消费者喜爱,消费者对鱼糜制品的需求量日益增长[2]。然而淡水鱼肌原纤维蛋白含量较低,凝胶形成能力差[3]、采肉率低[4],因此如何改善鲢鱼糜的凝胶品质、提高鲢鱼的经济效益,成为行业内关注的焦点。
羊血是畜禽屠宰行业主要副产物之一,蛋白质含量丰富,除含有免疫球蛋白、超氧化物歧化酶等多种功能性蛋白质成分外,还富含谷物类食品的第一限制性氨基酸——赖氨酸[5],且含有铁、钾、镁等多种微量元素,维生素、无机盐、糖类等,素有“液体肉”之美誉[6-7]。我国是羊肉消费大国,但羊血的利用率很低,主要用作加工血肠、血豆腐等传统食品或喷粉后生产饲料[8]。作为一种廉价易得、性能优良、营养丰富的蛋白质资源,羊血浆蛋白应该得到更好的利用。
已有研究表明利用猪血浆蛋白能够提高鲢鱼鱼糜的凝胶特性[9],且对秘鲁鱿鱼鱼糜凝胶形成具有改善作用[10]。羊血浆蛋白有利于提高肌原纤维蛋白凝胶品质[6],而对淡水鱼糜凝胶品质的影响鲜有报道。因此,本文以鲢鱼鱼糜为原料,研究了羊血浆蛋白粉对鲢鱼鱼糜的影响,以期为生产具有较好凝胶品质的淡水鱼糜制品提供理论支持和加工依据。
1 材料与方法
1.1 实验原料
鲢鱼鱼糜(置于-18 ℃冰箱下冷冻备用),湖北井力水产食品有限公司;塑料肠衣,天津市康泰塑料包装有限公司;无碘食盐,中国盐业;新鲜羊血,购于徐州市牛羊定点屠宰场。
1.2 实验试剂
氢氧化钠、乙二胺四乙酸(EDTA)、NaCL、三羟甲基氨基甲烷(Tris)、十二烷基硫酸钠(SDS),国药集团化学试剂有限公司;甘氨酸、福林酚,Biotopped;巯基乙醇、尿素、三氯乙酸(TCA),上海罗恩试剂公司;醋酸甲醇,天津福晨化学试剂;柠檬酸钠,天津巴斯夫化工有限公司;HCL,上海凌峰化学试剂有限公司。
1.3 主要仪器设备
HH-4恒温水浴锅,常州国华电器有限公司;料理机,九阳股份有限公司;精密色差仪,深圳市威福光电科技有限公司;可见分光光度计、TU-1810紫外可见分光光度计,北京普析通用仪器有限公司;高速冷冻离心机、普通高速离心机,上海安亭科学仪器厂;冷冻干燥机,德国Christ;流变仪,奥地利安东帕;食品物性测定仪(质构仪),美国FTC公司。
1.4 实验方法
1.4.1 羊血浆蛋白粉的制备
在徐州当地屠宰场取得新鲜的羊血,在新鲜的羊血中按1/10体积添加质量浓度为38 g/L的柠檬酸钠溶液,防止羊血凝固。使用2层纱布过滤,去除羊毛等杂质,4 ℃下3 000×g离心20 min,取上清液,再离心1次,得到血浆蛋白[11]。过夜冷冻干燥(-18 ℃)后得到羊血浆蛋白冻干粉。
1.4.2 鱼糜制品的准备
冷冻鲢鱼鱼糜4 ℃下解冻10 h,分成7组50 g鱼糜,先空擂2 min,加入25%的纯水,再添加质量浓度25 g/L食盐,继续斩拌2 min,最后分别加入质量分数为0.5%、1%、1.5%、2%、2.5%、3%的羊血浆蛋白粉(实验中添加羊血浆蛋白粉的质量分数均以冷冻鱼糜的质量为基准),未添加羊血浆蛋白粉的为空白组。加入羊血浆蛋白粉后再斩拌2 min,将斩拌好的鱼糜手动灌入直径为25 mm的塑料肠衣中,采用40 ℃/30 min,90 ℃/20 min两段式加热法进行加热,加热结束后立即将鱼肠放入冰水中,冷却至室温后放入4 ℃冰箱冷藏过夜,待测鱼糜的各项指标。
1.4.3 全质构(texture profile analysis, TPA)的测定
参考陆海霞等[12]的方法,待测样品取出恢复至室温,去除肠衣,切成长25 mm,直径25 mm的圆柱体,用质构仪测定样品的硬度、弹性、内聚性、胶黏性、咀嚼性等指标。测试条件为:TPA模式,P35圆柱形探头,测试前、中、后速均为60 mm/min,形变量40%,触发力为0.1 N,探头回升到样品表面上的高度:30 mm。每组实验重复2次,实验结果取其平均值。
1.4.4 持水性的测定
参照黄玉平等[13]方法,采用离心法测定鱼糜凝胶的持水性。将制备好的鱼糜凝胶切成块状放入离心管称重,在4 ℃下1 000×g离心10 min,去除水分,记录每次称重数据。如公式(1)所示。
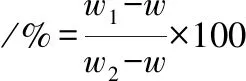
(1)
式中,w1,离心管+除去水分后凝胶的质量,g;w2,离心管+离心前的凝胶的总质量,g;w,离心管的质量,g。
1.4.5 白度的测定
根据XIONG等[14]方法,把鱼肠切成厚5 mm的薄片,在室温下用色彩色差仪测定样品的L*、a*、b*值,按照公式(2)计算样品的白度。
W=100×[(100L*)2+a*2+b*2]1/2
(2)
式中:L*值表示样品的亮度;a*值表示样品的红绿值;b*表示样品的黄蓝值。每组实验重复5次,取平均值。
1.4.6 流变特性的测定
根据WANG的方法[15]稍作修改:温度扫描:采用流变仪对鱼糜的储能模量(G′)和损耗模量(G″)进行测定。将样品置于底部平台,采用直径为20 mm平行板,狭缝1 mm,应变1%,频率1 Hz。进行动态温度扫描,升温速率2 ℃/min,升温范围25~90 ℃;应变扫描确定应变为1%,频率为1 Hz位于线性黏弹区间。为防止水分蒸发,在测试时采用硅油封住样品,如公式(3)所示。

(3)
1.4.7 鲢鱼鱼糜溶解率的测定
参照雷雨等[9]方法,稍作修改,取1 g鱼糜凝胶样品,加入20 mL 20 mmol/L Tris-HCl缓冲液(含10 g/L SDS,8 mol/L尿素和20 g/L巯基乙醇,pH 8.0)并均质,混合物于100 ℃加热2 min后,于室温搅拌4 h,然后5 000×g离心60 min。取上清液10 mL,添加500 g/L TCA至终质量浓度为100 g/L,混合液于4 ℃放置18 h后5 000×g离心60 min,沉淀物用质量浓度100 g/L TCA冲洗并溶解于0.5 mol/L NaOH中。总蛋白含量为凝胶直接溶解于0.5 mol/L NaOH中测得的蛋白质含量。蛋白质含量用Lowry法测定。溶解率为溶解于溶剂中的蛋白质与总蛋白质含量比值的百分数。
1.4.8 数据统计分析
所有数据采用SPSS 19.0分析,采用Origin 8.0、Excel 2010作图。
2 结果与分析
2.1 羊血浆蛋白添加量对鲢鱼鱼糜质构的影响
由表1可知,添加羊血浆蛋白的鲢鱼鱼糜凝胶的硬度、咀嚼性、胶黏性比空白组大,羊血浆蛋白添加量从0.5%增加到2%,鱼糜凝胶的硬度显著增大(P<0.05),继续增大添加量,鱼糜凝胶的硬度变化不显著;咀嚼性和胶黏性呈增大趋势,在添加量为3%时,鱼糜凝胶的咀嚼性和胶黏性与空白组相比,咀嚼性增加了29.54 mJ,胶黏性增加了3.2 N,说明添加羊血浆蛋白粉可显著改善鱼糜凝胶制品的口感。当羊血浆蛋白添加量我3%时,鱼糜凝胶的弹性和内聚性与空白组相比变化不显著(P>0.05),说明羊血浆蛋白的添加对鱼糜凝胶的弹性和内聚性的影响不大,因此添加一定浓度的羊血浆蛋白可以有效改善鱼糜制品的质构特性,增强口感。
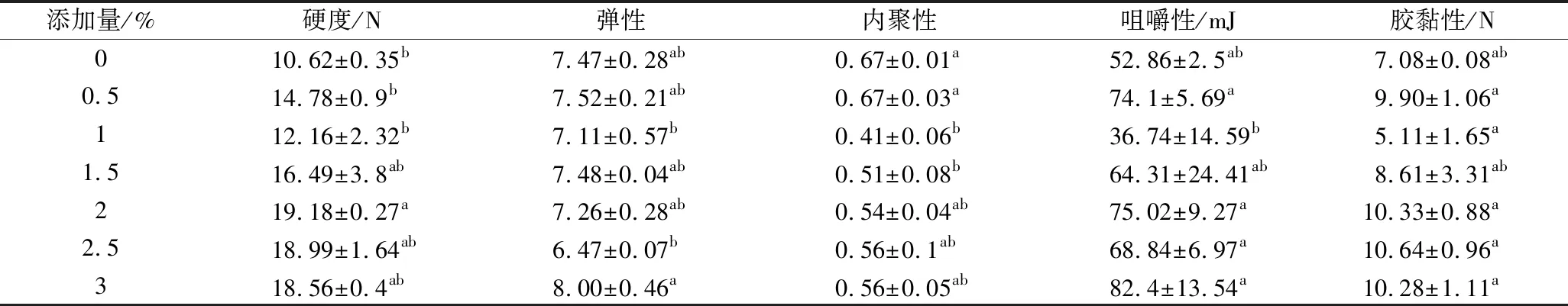
表1 羊血浆蛋白对鲢鱼鱼糜凝胶质构的影响Table 1 Effects of sheep plasma protein on the gel structure of silver carp surimi
注:不同小写字母表示差异显著(P<0.05),相同小写字母表示差异不显著(P>0.05)。下同。
2.2 羊血浆蛋白对鲢鱼鱼糜凝胶持水能力的影响
持水性能是鱼糜凝胶特性的一个重要物理参数,在一定程度上反映了凝胶中的水分子与蛋白质分子的结合状况及凝胶强弱[16]。高温诱导鱼糜凝胶形成具有持水作用三维网络结构[17]。如图1所示,与空白组相比,添加羊血浆蛋白鱼糜凝胶持水性增大,随着羊血浆蛋白添加量从0.5%逐渐增加到3%,鲢鱼鱼糜凝胶的持水性基本呈增大趋势,添加量为2%的凝胶持水性比空白组鱼糜凝胶增加了2.16%;说明羊血浆蛋白的加入有利于提高鱼糜凝胶的持水率。且在一定范围内,羊血浆蛋白添加浓度越高,鱼糜凝胶的持水能力越强,这可能是因为羊血浆蛋白可以使鱼糜凝胶形成的三维网状结构更加致密,可以包埋更多水分子,提高凝胶持水性。倪娜等[18]的研究也说明血浆蛋白的添加有利于提高肌原纤维蛋白凝胶的持水性。
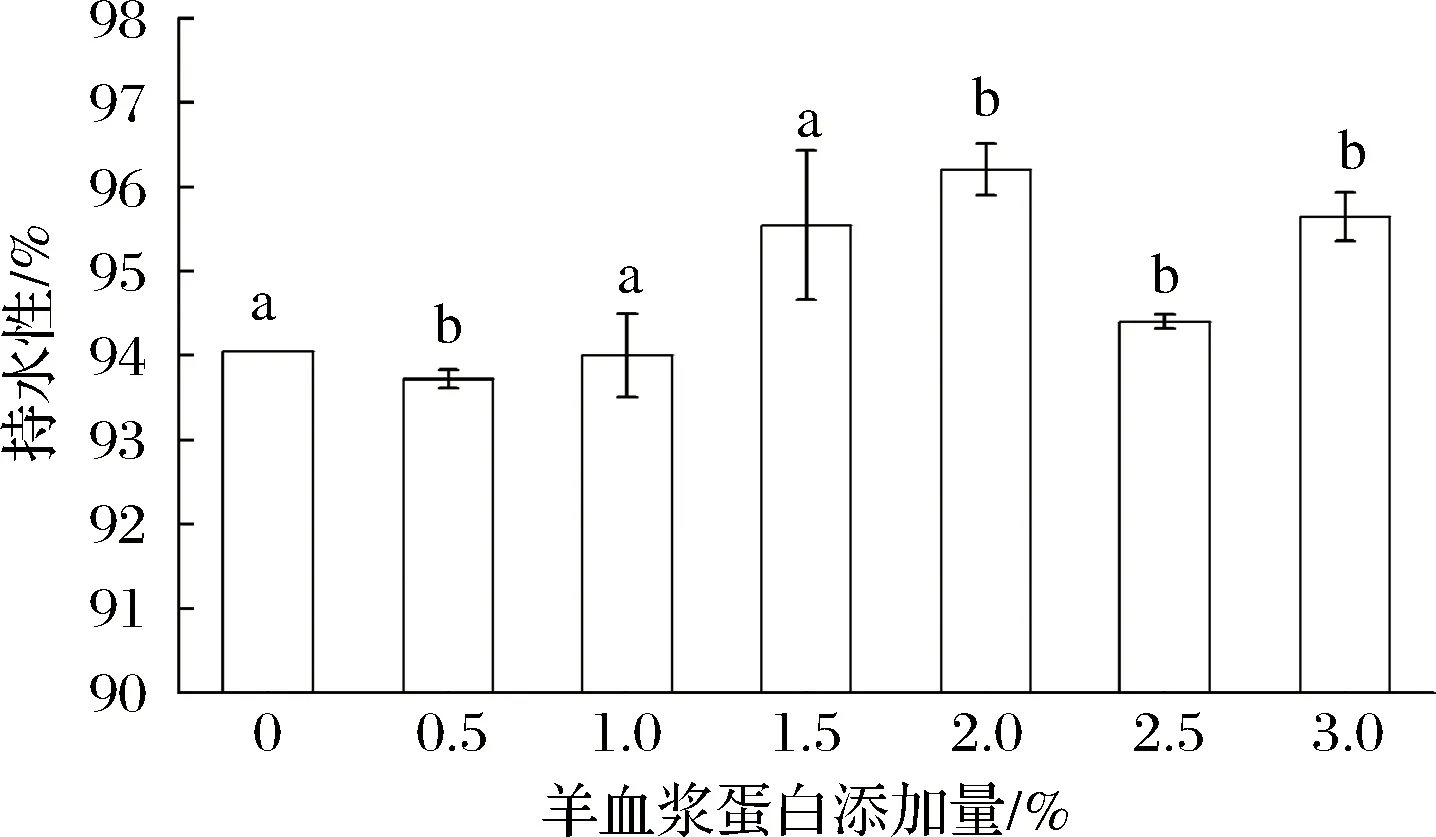
图1 羊血浆蛋白对鲢鱼鱼糜凝胶持水性的影响Fig.1 Effect of sheep plasma protein on water retention of silver carp surimi gel
2.3 羊血浆蛋白添加量对鲢鱼鱼糜凝胶白度的影响
由表2可以看出,L*值随着羊血浆蛋白添加量的增加显著减小(P<0.05),a*值和b*值显著增加(P<0.05)。

表2 羊血浆蛋白对鲢鱼鱼糜凝胶白度的影响Table 2 Effect of sheep plasma protein on the whiteness of silver carp surimi gel
羊血浆蛋白添加量越大,鲢鱼鱼糜凝胶的白度显著降低(P<0.05),说明羊血浆蛋白粉会因为自身的颜色给鱼糜凝胶的白度带来不利的影响。白度是衡量鲢鱼鱼糜的重要指标之一,鱼糜的白度越高,说明鱼糜的品质越好[19]。添加羊血浆蛋白粉会降低鱼糜的白度,当羊血浆蛋白粉添加量高达3%时,白度可被人们接受。
2.4 羊血浆蛋白对鱼糜凝胶动态流变的影响
储能模量(G′)也称弹性模量,反映蛋白凝胶网络结构的形成情况,是样品的弹性特征[20]。如图2所示,鲢鱼鱼糜在升温过程中的变化可分为3个阶段,35~40 ℃,添加羊血浆蛋白使G′小幅度增加,不同羊血浆蛋白添加量的鲢鱼鱼糜在40 ℃附近均出现小峰,这可能是肌球蛋白头部之间发生交联,使鱼糜G′增加[21]。40~56 ℃,随着温度的升高鲢鱼鱼糜G′迅速下降,在56 ℃附近降到最低点,这可能是肌动球蛋白解离及肌球蛋白尾部变性展开,也可能是温度升高使得低温凝胶化网络结构被破坏;鱼糜中内源性组织蛋白酶水解肌球蛋白,导致凝胶结构的破坏[22]。60~90 ℃,鲢鱼鱼糜G′随着温度的升高大幅度增大,说明蛋白进一步变性聚集,形成了最终稳定的凝胶[23];与空白组对比,添加羊血浆蛋白粉,鲢鱼鱼糜的G′显著增加,说明羊血浆蛋白有利于鱼糜凝胶网络的形成,增加鱼糜凝胶的弹性。
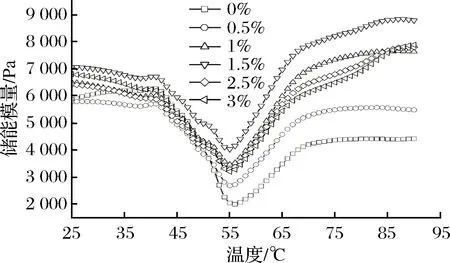
图2 羊血浆蛋白对鲢鱼鱼糜在升温过程中的储能模量影响Fig.2 Effect of sheep plasma protein on energy storage modulus of silver carp surimi during heating
损耗模量(G″)也称黏性模量,是样品的黏性特征。如图3所示,损耗模量G″在升温过程中也经历3个过程,在35~45 ℃,鲢鱼鱼糜G″变化呈小幅度上升,这可能是由于蛋白质受热后变性展开,与水分子相互作用增强[24]。在45~60 ℃,G″随着温度的升高急剧下降,在60~90 ℃,G″随着温度的升高小幅度增大,趋向于平衡,但始终比初始G″小,说明高温使鲢鱼鱼糜形成热不可逆的三维网状结构,降低黏性。与空白组对比,添加羊血浆蛋白可以使鱼糜G″增大,进而改善鱼糜凝胶的黏性。
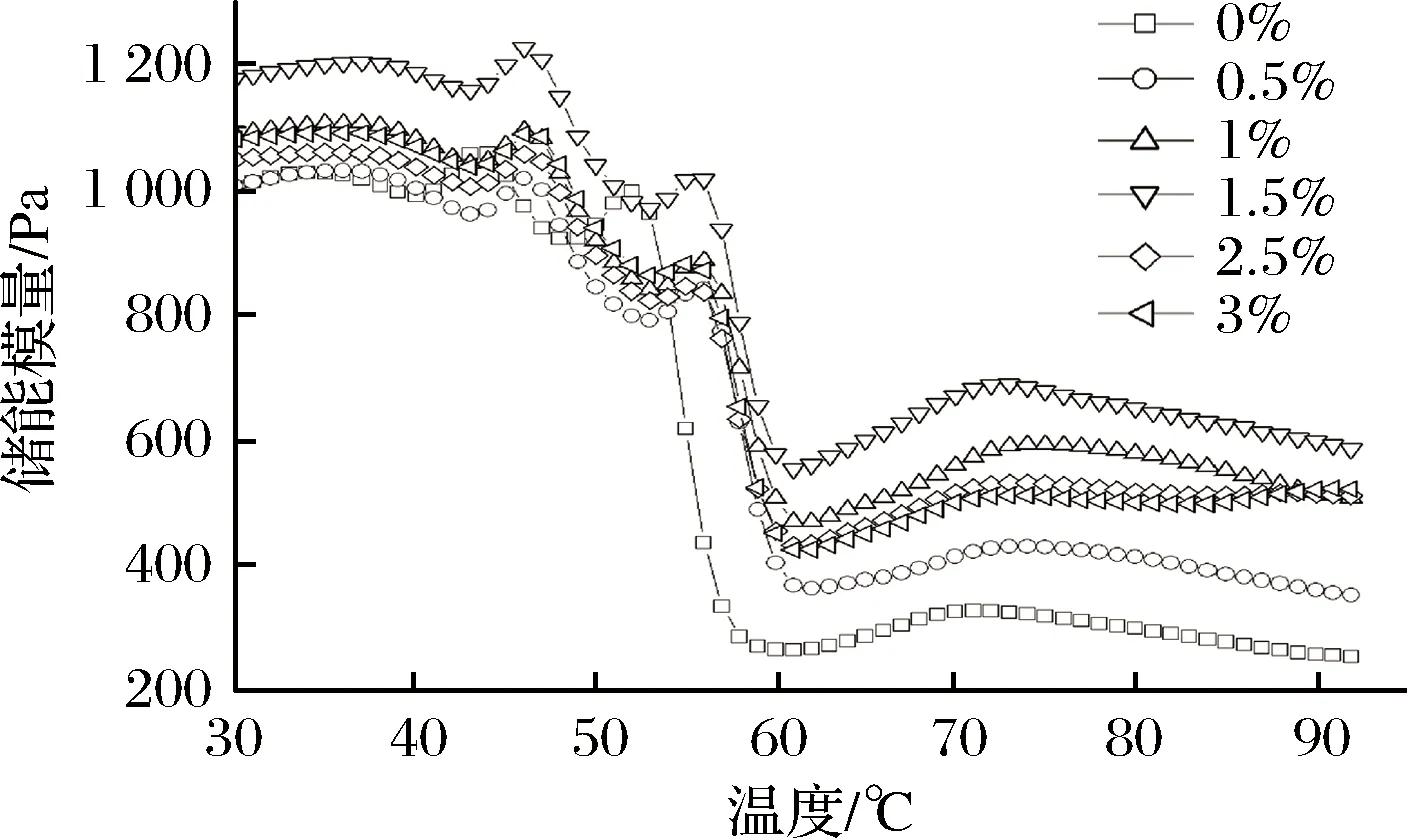
图3 羊血浆蛋白对鲢鱼鱼糜在升温过程中损耗模量的影响Fig.3 Effect of sheep plasma protein on loss modulus of silver carp surimi during heating
损耗系数(tanδ)=损耗模量/储能模量,用来表示热凝胶过程中弹性和黏性的变化。升温过程中鱼糜的弹性模量G′均大于耗能模量G″,即tanδ小于1,说明鱼糜凝胶弹性固体性质突出,具有较好的胶黏性[23]。如图4所示,鲢鱼鱼糜在温度升高到45 ℃左右时,损耗系数开始逐渐增大,温度继续升高,损耗系数随着温度的增大而减小。这表明从25 ℃刚升温时鱼糜黏性逐渐增强,温度高于45 ℃时,鱼糜的弹性逐渐增强,这可能是因为刚开始时鱼糜蛋白质的结构展开、解离使得蛋白质的流动性增大,随着温度的继续增加,蛋白质变性聚合开始形成紧密的三维网络结构。温度升高到50 ℃左右,损耗系数均达到最大,而添加羊血浆蛋白的鲢鱼鱼糜与空白组对比,损耗系数最高点比空白组的低,损耗系数随着温度进一步升高,逐渐降低,当温度升高至90 ℃时,损耗系数最小,说明鱼糜在高温条件下进行凝胶化。随着羊血浆蛋白添加量的逐渐增加,损耗系数逐渐减小,说明羊血浆蛋白的加入有利于提高鱼糜凝胶化程度,与质构特性测定结果一致。

图4 羊血浆蛋白对鲢鱼鱼糜在升温过程中损耗系数的影响Fig.4 Effect of sheep plasma protein on loss coefficient of silver carp surimi during heating
2.5 羊血浆蛋白对鱼糜凝胶溶解率的影响
含SDS、尿素和β-巯基乙醇的混合溶剂能够断裂鱼糜凝胶中除了非二硫共价键外的所有化学键[25]。所以鱼糜凝胶溶解率的测定可用于判断非二硫共价键的含量。
由图5可以看出,羊血浆蛋白添加量从0%增加到3%,鱼糜凝胶的溶解率基本呈现逐渐降低的趋势,说明鱼糜凝胶网状结构形成的非二硫共价键增多,这可能是因为羊血浆蛋白的加入促进鱼糜中的内源性谷氨酰胺转化酶发生酶的交联[26],诱导非二硫共价键的形成,尤其是ε-(γ-Glu)-Lys的形成。刘海梅等[27]的研究结果也表明,ε-(γ-Glu)-Lys共价键能够降低溶解率,非二硫共价键在鱼糜凝胶中含量越高,凝胶特性越好。添加2%羊血浆蛋白时溶解率最低,说明非二硫共价键含量最高,形成致密的鱼糜凝胶网络结构。
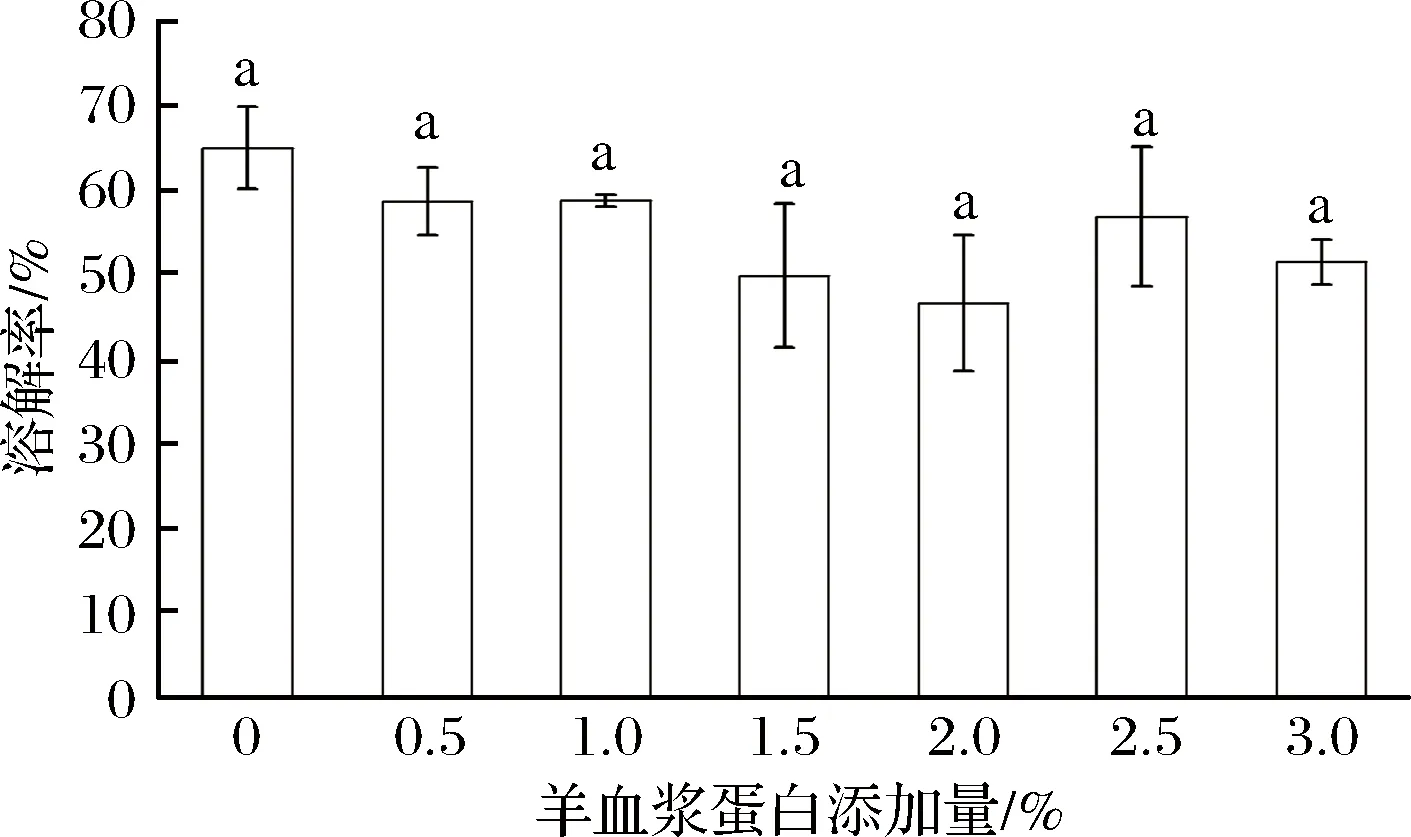
图5 羊血浆蛋白对鲢鱼鱼糜凝胶溶解率的影响Fig.5 Effect of sheep plasma protein on the dissolution rate of silver carp surimi gel
3 结论
羊血浆蛋白作为营养丰富又价格低廉的蛋白质资源,将其添加到白鲢鱼糜制品中,可显著改善鱼糜制品凝胶质构特性,随着羊血浆蛋白添加量的增加,硬度、咀嚼性、胶黏性等逐渐增大,持水能力逐渐增强。添加羊血浆蛋白可显著增强鱼糜的流变特性,与空白组对比,鲢鱼鱼糜的G′和G″不断提高。溶解率测定结果表明,羊血浆蛋白可以通过非二硫共价键来促进鱼糜形成更紧密的三维网络结构。羊血浆蛋白在鱼糜制品中的应用,既可以充分利用丰富的羊血资源,又可以提高鱼糜制品的蛋白质含量,改善鱼糜凝胶特性。

