全麻联合硬膜外阻滞对比格犬脑脊液中NSE、Aβ及脑电波的影响
卫晓娜,程晶晶,王向辉,陈永学
(邯郸市中心医院麻醉科,河北 邯郸 056002)
麻醉的过程是主动干预并不断调控内环境稳态的动态过程。麻醉会产生伤害性刺激,机体会对伤害性刺激做出一系列反应,如表现为疼痛、呼吸及心率增快、血压升高及出汗等。暂时的应激反应为良性作用,可增强心血管系统功能,保证重要脏器的血流灌注和支持应急后的能量供应。而长久的应激反应则为病理状态,会产生一系列非特异性全身反应[1-3],如胃肠道功能紊乱、肝功能障碍、心律失常、分解代谢增加、体温升高、代谢性酸中毒和血液凝固性增加等。但合理的麻醉措施可有效控制应激反应。本文旨在探讨全麻联合硬膜外阻滞对比格犬脑脊液中NSE、Aβ及脑电波形的影响。
1 材料与方法
1.1 实验动物与分组
选用上海基尔顿生物公司提供的健康一级比格犬40只,体重8~9 kg,雌雄不限。数表法随机分为全麻组和全麻联合硬膜外阻滞组,每组20只。
1.2 全麻联合硬膜外阻滞模型的建立
所有比格犬实验前一晚禁食,自由饮水。麻醉前常规监测血压、心率、心电图、体温和开放静脉通路。犬的实验操作均在基础麻醉下进行,即应用安定10 mg肌注,待犬进入深度睡眠后行硬膜外穿刺。经下腔静脉注入50 mL平衡液后全麻组选择L1-L2椎间隙行硬膜外穿刺置管,先注入2%盐酸利多卡因10 mL,5 min后实施全麻诱导[4]。全麻组和全麻联合硬膜外阻滞-硬膜外镇痛组全麻用药相同,全麻诱导选用咪达唑仑0.25 mg/kg、芬太尼0.01 mg/kg、异丙酚5 mg/kg、氯化琥珀胆碱5 mg/kg。麻醉维持静脉泵注异丙酚25 mg·kg-1·h-1,并吸入5%异氟醚。全麻联合硬膜外阻滞组硬膜外注射0.375%布比卡因25 mL,5 min后注入2%盐酸利多卡因25 mg。两组均在手术结束前10 min停止全麻用药。实验犬全麻后均行气管内插管,连接小动物呼吸机,吸入40%氧气,呼吸参数:潮气量10 mL/kg,呼吸频率20次/min。待比格犬麻醉后分离左侧颈总动脉和右侧颈外静脉。用20 G动脉穿刺针行动脉插管,监测实时平均动脉压。并行右侧外静脉穿刺插管,用于液体输注。实验犬在麻醉状态下行小肠部分切除端端吻合术。
1.3 脑脊液和血清的制备
待模型完成后,对两组比格犬在L1-L2椎间隙进行脊椎穿刺术,留取脑脊液5 mL于无热源和内毒素的试管中,混匀后采用低温3 000 r/min的转速离心10 min,取上清液于-70 ℃冰箱保存备用。使用一次性真空采血管采取静脉血5 mL,静置20 min,血液完全凝固后使用离心机3 500 r/min离心15 min,取上清液2 mL于EP管中,放置-80 ℃冰箱保存。
1.4 检测指标
1.4.1 神经元特异性烯醇化酶(neuron-specific enolase,NSE)的测定 采用酶联免疫吸附法(ELISA)测定比格犬脑脊液和血清中NSE的含量,用纯化后的抗体包被96孔板,制成固相载体,往包被抗NSE抗体的微孔中按照顺序添加标准品和标记过的NSE抗体,经彻底洗涤后用底物3,5,3′,5′-四甲基联苯胺(TMB)显色。TMB在过氧化物酶的催化下转化成蓝色。颜色的深浅与与样品中NSE的浓度呈正相关。用酶标仪在450 nm波长下测定吸光度,计算NSE的浓度。该操作严格按照NSE检测试剂盒说明书进行。各试剂使用前在室温中平衡1 h左右。样品应从-70 ℃冰箱取出并室温放置1 h以保证样品温度与室温相同。样品和试剂使用时需混匀,尽量避免气泡。(1)设置空白孔、标准孔和样品孔,分别对应添加100 μL于酶标板底部,加板37 ℃孵育2 h。(2)丢弃液体并甩干,每孔加生物素标记抗体工作液100 μL,加板37 ℃孵育1 h。(3)使用缓冲液反复清洗3次,每次浸泡2 min,并甩干。(4)每孔加辣根过氧化物酶标记工作液100 μL,37 ℃孵育1 h。(5)使用缓冲液反复清洗3次,每次浸泡2 min,并甩干。(6)加入显色剂TMB,37 ℃避光孵育30 min。(7)依序向反应孔加入50 μL终止液,终止反应。使用酶标仪在450 nm处测定每孔的光密度(OD值)。
1.4.2 Aβ的测定 采用ELISA法测定脑脊液和血浆中淀粉样蛋白(amyloid protein,Αβ)含量。样品2 mL置于聚丙烯EDTA抗凝管中,低温3 000 r/min离心10 min。将试剂盒及待测样品置于室温1 h,加入蛋白酶抑制剂-苯磺酸防止一系列蛋白酶降解Αβ。配制标准品Αβ浓度为:5、10、15、30、62.5、125、250和500 ng/mL,制作标曲线,通过标曲计算样品中Αβ浓度。说明书具体操作如下:(1)取出已经包被的96孔板,设置空白孔、标准孔和样品孔,分别对应添加100 μL于酶标板底部,半透膜封存,室温孵育2 h。(2)丢弃液体并甩干,每孔加一抗工作液100μL,半透膜封存,室温孵育2 h。(3)酶标板上每孔加入二抗100 μL,半透膜封存,室温孵育2 h,(4)使用缓冲液反复清洗3次,每次浸泡2 min,并甩干。(5)每孔加辣根过氧化物酶标记工作液100 μL,37 ℃孵育1 h。(6)使用缓冲液反复清洗3次,每次浸泡2 min,并甩干。(7)加入显色剂TMB,室温避光孵育30 min。(8)依序向反应孔加入50 μL终止液,终止反应。使用酶标仪在450 nm处测定每孔的光密度(OD值)。
1.4.3 脑电图的测定 两组比格犬麻醉后,立即连接电极并进行脑电图测定。采用八道脑电图仪。测定时将电极的鳄鱼夹与注射器正头连接后刺入皮下,采用7个电极,分别连接与鼻窦上方及左右额、顶、枕部。
1.5 统计学分析
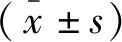
2 结果
2.1 基本情况对比
在本研究中,全麻组中雌性比格犬8只,雄性比格犬12只,平均体重为(8.46±0.27)kg;全麻联合硬膜外阻滞-硬膜外镇痛组中雌性比格犬10只,雄性比格犬10只,平均体重为(8.73±0.35)kg。两组比格犬基本情况比较,差异无统计学意义(P>0.05)。
2.2 NSE测定结果
全麻组脑脊液中NSE的含量为(69.33±11.51)μg/mL,全麻联合硬膜外阻滞组其含量为(48.64±8.47)μg/mL,差异有统计学意义(P<0.05)。全麻组血液中NSE为(73.48±10.23)μg/mL,全麻联合硬膜外阻滞组其含量为(47.69±11.07)μg/mL,差异有统计学意义(P<0.05)。
2.3 Αβ的测定结果
全麻组脑脊液中Αβ为(110.34±14.37)μg/mL,全麻联合硬膜外阻滞组的含量为(80.37±8.06)μg/mL,差异有统计学意义(P<0.05)。全麻组血液中Αβ为(120.75±15.14)μg/mL,全麻联合硬膜外阻滞组的含量为(91.63±7.48)μg/mL,二者差异有统计学意义(P<0.05)。
2.4 两组脑电波变化
全麻组脑电波周期和振幅分别为(3.88±0.23)c/s和(4.32±0.41)μV(图1),全麻联合硬膜外阻滞组的周期和振幅分别为(3.41±0.17)c/s和(3.52±0.62)μV(图2),较全麻组均有所下降,差异有统计学意义(P<0.05)。
3 讨论
全麻可抑制大脑皮层的兴奋,但不能有效阻断手术区域伤害性刺激向交感神经低级中枢传导,从而导致肾上腺髓质系统兴奋,所以阻滞手术创伤上行性传导是控制应激反应的相对较好的选择[5-6]。此外,动物模型还表明,电针可以通过保持免疫反应能力减轻手术期间的应激反应,从而获得更好的长期疗效[7-9]。全麻-硬膜外联合麻醉常应用于大型胸腹外科。大脑是人体耗氧量最多的器官,由于中枢神经系统神经元内拮抗氧化应激的物质(如过氧化氢酶、谷胱甘肽及维生素E等)较少,使得神经元易于受到自由基的攻击[10-12]。神经元特异性烯醇化酶又名磷酸烯醇转化酶,是糖酵解的关键酶。NSE是中枢神经里面的一种重要蛋白质,定位于脑灰质神经细胞和末梢神经元。当脑神经元损伤时,神经细胞受损、变性和瓦解,血脑屏障通透性就会增强,NSE被释放至脑脊液和血液中。由于脑胶质细胞和其他神经组织中不含NSE,推测NSE可能是检测脑内神经元损伤的客观指标。

在本实验中,通过建立全麻和全麻联合硬膜外阻滞模型,通过测定两组比格犬脑脊液和血浆中的NSE和Αβ的含量和脑电波形变化,发现全麻联合硬膜外阻滞组脑脊液和血浆中的NSE和Αβ的含量较全麻组降低。全身麻醉状态下脑血流明显降低,既干扰了脑组织代谢,又增加了血脑屏障的通透性,造成了神经元和脑胶质细胞的损伤,最终导致术后认知功能障碍(postoperative cognitive dysfunction,POCD)的发生。而全麻联合硬膜外阻滞可阻滞交感神经和副交感神经,直接降低伤害性刺激所导致的神经冲动的传导,将应激反应调控在一个较低的水平。硬膜外麻醉可减少不良反应的发生和免疫抑制因素的发生,并能更好地缓解术后疼痛。全麻后脑脊液中的NSE发生变化可能是神经元受到损伤后,NSE在细胞内的分布会有变化。在缺血状态下,神经元存货需要NSE提供大量ATP以满足核酸合成的需要,同时NSE的间接产物丙酮酸也能够保护细胞核免受过氧化物的损害,因此一部分NSE会转移至细胞间隙中从而导致体液中浓度增高。NSE不与细胞内的肌动蛋白结合,较易释放,这为脑组织损伤后检测脑脊液中NSE的变化提供了依据[13-15]。NSE不与细胞膜结合,当神经元破坏时,直接释放至脑脊液中,并通过损伤的血-脑脊液屏障漏至血浆中。已通过动物实验证明,NSE是脑组织损伤后的特异性蛋白,也是脑组织破坏后较合适的生化标记物,其在脑脊液或血液中质量浓度的高低可反映神经细胞和神经胶质细胞的损害程度,为判断中枢神经系统损害程度提供了定量信息。同样淀粉样蛋白与NSE的原理相同。脑电图也说明全麻联合硬膜外阻滞组比全麻组的波形稳定[16]。该实验结果说明全麻联合硬膜外阻滞较全麻对大脑的损伤较低,更易于对大脑的保护。
综上所述,全麻联合硬膜外阻滞与全麻比较,其可降低脑脊液和血浆中的NSE和Αβ的含量,从而起到降低大脑损伤的作用。

