Nrf2在脓毒症合并急性肾损伤大鼠肾组织中的表达及姜黄素对其的干预作用*
杨挺, 俞慧, 黄伟
(江南大学附属医院 & 无锡市第三人民医院 急诊科, 江苏 无锡 214000)
脓毒症是机体对细菌感染作出过度反应的全身炎症反应综合征(SIRS),如不及时处理则进展为严重脓毒症,出现脓毒症休克、多器官功能衰竭,若合并急性肾损伤(AKI)时,死亡率可达70%[1]。脓毒症AKI的发病机制目前仍未阐明,对AKI的研究早期主要集中于血流动力学或(和)炎症因子方面,近几年的研究证实氧化应激反应在脓毒症过程中起着重要的作用。核因子相关因子(Nrf2)是调节抗氧化应激反应的重要转录因子之一,Nrf2/ARE通路是目前发现的最为重要的内源性抗氧化应激通路[2-3]。本研究采用盲肠结扎穿孔术(CLP)制备大鼠脓毒症AKI模型,并应用姜黄素进行干预治疗,于造模后6、12、24及48 h时,检测大鼠肾组织中Nrf2蛋白及血清尿素氮(BUN)、肌酐(Scr)水平,探讨姜黄素在脓毒症AKI中的作用及机制,为脓毒症AKI的临床治疗提供思路。
1 材料与方法
1.1动物及试剂 清洁级雄性SD大鼠96只,体质量(260±20)g,由南通大学实验动物中心提供;AU400全自动生化分析仪购自日本olympus公司,尿素氮(BUN)及肌酐(Scr)测定试剂盒购自南京建成生物工程研究所。
1.2方法
1.2.1动物模型制备 96只大鼠随机均分为对照组、模型组、治疗组。模型组和治疗组大鼠参考文献[4-5]采用CLP法制备脓毒症AKI大鼠模型,造模前大鼠禁食12 h、禁水6 h,以3%戊巴比妥钠(45 mg/kg)腹腔注射麻醉,固定大鼠于操作台,剪去腹部体毛、消毒后沿腹正中线皮肤开约2 cm切口,暴露腹腔脏器;找到盲肠游离盲端,取出盲肠,在距盲端1 cm处结扎,用18号针头在近端及末端贯通穿刺2次,施压于盲肠挤出少量肠内分泌物于腹腔内,放置1根直径约0.5 cm的硬质导管并固定,回纳盲肠,逐层缝合腹壁切口。术后即刻在股部皮下注射生理盐水进行抗休克处理,液体量为4 mL/100 g,回笼。对照组采用同样方法开、关腹,但盲肠不结扎穿孔,也不留置导管。治疗组于造模1 h后按100 mg/kg剂量给予姜黄素注射入腹腔,模型组及对照组注射同等剂量生理盐水。
1.2.2血清BUN、Scr水平及肾脏组织匀浆Nrf2蛋白水平 分别于造模后6、12、24及48 h麻醉大鼠,每组8只,麻醉后于大鼠左侧第3、4肋间心尖搏动最强处针尖刺入采血,离心分离血清,采用日本Olympus AU400全自动生化分析仪测定血清BUN及Scr水平;开腹分离肾脏组织,肾脏组织置-80 ℃冰箱冻存、采用 Western blot法检测Nrf2蛋白表达水平,用凝胶图像处理系统将结果扫描成电子图像,以条带分析软件Quantity One 4.4.0分析,计算出光密度值(OD值),用目标带与内参照β-actin的光密度比值来衡量表达情况,作为Nrf2的相对表达量。
1.2.3肾脏组织学 另取造模后12 h的肾脏组织用10%中性甲醛固定、石蜡包埋、切片、苏木精-伊红(HE)染色,于光学显微镜观察肾脏组织学变化,以炎症细胞浸润,肾小管上皮细胞空泡样变性评估AKI损伤程度。
1.3统计学方法
2 结果
2.1 血清BUN及Scr水平
造模后6、12、24及48 h时,与对照组同时点比较,模型组大鼠血清BUN及Scr水平显著升高,差异有统计学意义(P<0.01);与模型组同时点比较,治疗组大鼠血清BUN及Scr水平显著降低(P<0.01);与对照组同时点比较,治疗组大鼠血清BUN及Scr水平显著升高,差异有统计学意义(P<0.01)。提示造模1 h后给予姜黄素注射能改善脓毒症大鼠肾功能。见表1。
表1 3组大鼠造模后6、12、24及48 h时的血清BUN及Scr水平
注:(1)与对照组同时点比较,P<0.01;(2)与模型组同时点比较,P<0.01;(3)与对照组同时点比较,P<0.01。
2.2 肾脏组织匀浆中Nrf2蛋白(OD值)
造模后6、12、24及48 h时,与对照组同时点比较,模型组大鼠肾脏组织匀浆中Nrf2蛋白OD值显著降低,差异有统计学意义(P<0.01);与模型组同时点比较,治疗组大鼠肾脏组织匀浆中Nrf2蛋白OD值显著升高,差异有统计学意义(P<0.01);与对照组同时点比较,治疗组大鼠肾脏组织匀浆中Nrf2蛋白OD值显著升高,差异有统计学意义(P<0.01)。见表2。
2.3 肾脏组织学
HE染色结果可见,造模后12 h 时,对照组各时间段肾脏组织结构正常,未见明 显 病 理 变 化(图1A)。模型组大鼠部分肾小球周围间质充血,可见肾小管水肿,肾小球毛细血管扩张、充血,炎症细胞浸润(图1 B),而治疗组小鼠肾小球及肾小管充血水肿及炎症细胞浸润情况较同时点模型组减轻(图1C)。
表2 3组大鼠造模后6、12、24及48 h时的肾脏匀浆组织中Nrf2蛋白水平比较
注:(1)与对照组同时点比较,P<0.01;(2)与模型组同时点比较,P<0.01;(3)与对照组同时点比较,P<0.01。
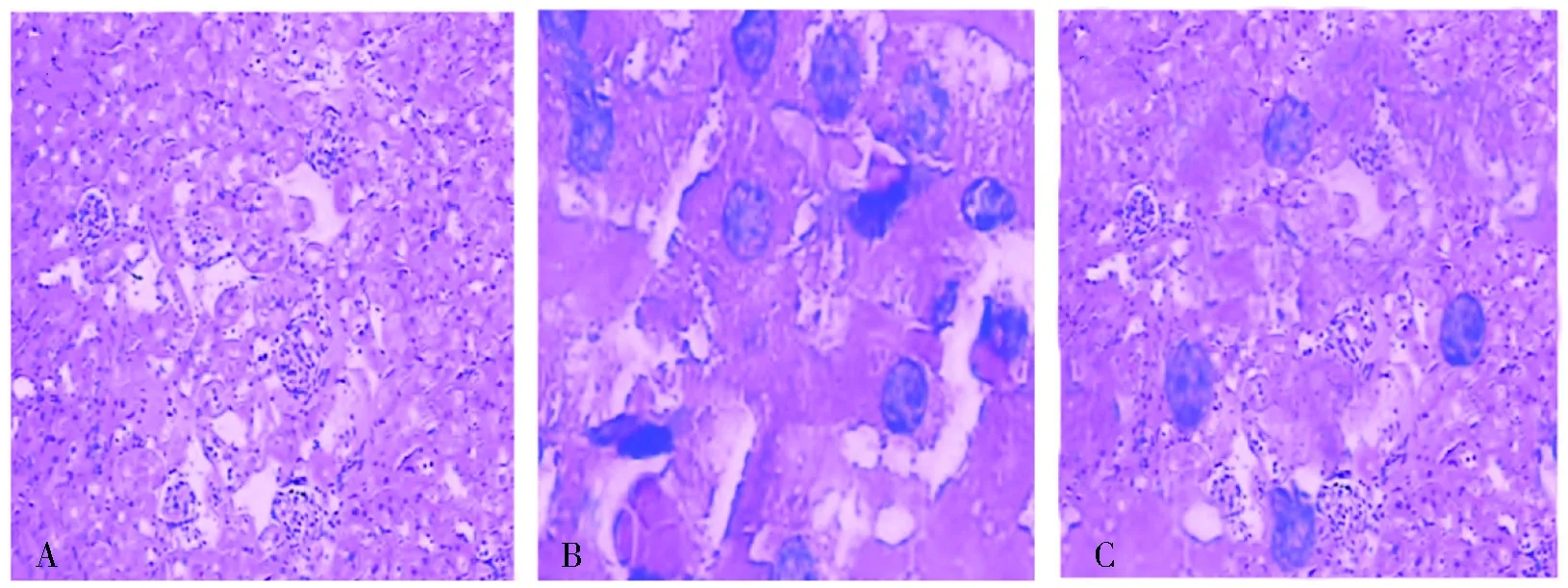
注:A为对照组,B为手术组, C为治疗组。
3 讨论
脓毒症是由感染引起的严重的SIRS,其病理生理机制复杂且易受多种因素影响,目前缺乏有效的防治方法。脓毒症在后期常发生多器官功能衰竭,肺脏、肝脏、胃肠道、肾脏以及血液系统常最先受累,据相关数据统计,在被诊断为脓毒症的患者中约有42%伴有不同程度的AKI,此类患者的死亡率高达74.5%,且有逐年上升的趋势[6]。近几年国外的很多研究均证明AKI时伴有氧化应激的发生。Nrf2是近几年来研究较多的细胞抗氧化反应的重要调节因子,它通过协调诱导对抗氧化应激蛋白和Ⅱ相解毒酶的的表达进行调节,在机体防御外来侵袭、抵御毒性损害中起关键作用[7-8]。Nrf2含有6个不同的功能区,被命名为Neh1-Neh6[9-10]。目前的研究证明Nrf2主要在代谢和解毒的组织中表达,比如肾脏、肝脏,还有一些持续与外界坏境接触的组织如皮肤、肺和消化道等[11-12]。生理状态下,Nrf2与细胞质中的果蝇肌动蛋白结合蛋白Kelch结合,抑制Nrf2的表达,使其无法进入细胞核发挥转录活性,细胞处于稳定状态[13]。当受到外界氧化应激因子刺激后或在蛋白激酶C的作用下,Nrf-2与Keap1解耦联,转入细胞核,进而与ARE启动子部位结合,启动下游靶基因的表达,进一步调节氧化应激反应。本研究中,在对照组大鼠肾脏组织中检测出Nrf2,表明正常肾脏组织中存在Nrf2,模型组Nrf2水平较对照组明显下降,其蛋白相对量先逐渐上升后期出现下降,提示脓毒症损伤后强烈的氧化应激反应损伤了机体的内源性保护系统,致使Nrf2水平的下调;同时脓毒症产生的大量毒素作用于炎症细胞,其产生的多种炎症介质在早期促使Nrf2入核反应增加,Nrf2在肾脏组织中表达上调,内源性抗损伤能力增强。随着脓毒症损伤加重,大量蓄积的ROS导致氧化-还原失衡,组织、细胞损伤加重,Nrf2出核减少,机体抗氧化能力减弱,最终出现严重的器官功能损害。由此可见,Nrf2在脓毒症抗氧化应激中发挥了重要作用,为临床治疗脓毒症提供了新的思路,但其深入的作用机制,仍待进一步研究。
姜黄素(curcumin)最初是在1870年从姜黄中分离出来的一种相对分子质量小的多酚类化合物,普遍认为它是姜黄中最有效的成分,有着较为广泛的药理作用,研究发现姜黄素在抗炎症损伤、抗氧化应激、调节血脂、抗病毒、抗肿瘤方面发挥着重要作用。姜黄素含有多个功能基团,包含2个酚羟基、2个不饱和酮双键、1个中性活性亚甲基及1个β-二酮基,酚羟基和β-二酮是抗氧化活性部分。姜黄素中含有2个α、β不饱和羰基序列可能是激活Nrf2的关键结构,有学者通过加氢还原该结构,发现可降低Nrf2的活化,同样具有αβ不饱和羰基的15d-PGJ2与Dimethoxycurcumin也能激活Nrf2。本研究结果显示,姜黄素干预后的脓毒症大鼠,Nrf2水平较手术组明显升高,肾小球及肾小管充血水肿及炎症细胞浸润显著减轻,提示姜黄素可能通过Nrf2信号传导途径发挥氧化应激作用,对肾脏起到保护的作用。研究报道,姜黄素可激活Nrf2核转位,上调Nrf2水平,增加具有抗氧化作用的代谢酶合成,减轻细胞活性氧族/活性氮族水平,发挥细胞保护功能。姜黄素还可抑制脂质过氧化,维持和/或增强各种抗氧化酶的活力,包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化酶(GPx)等。杨开艳等[14]研究发现姜黄素能提高脂多糖激活的小胶质细胞中SOD和GPx的活性,有效的清除氧自由基;有学者在对大鼠肾组织氧化应激损害的研究中发现,姜黄素不仅可以降低大鼠血浆和肾组织中丙二醛(MDA)的含量,还可以提高GSH含量和GPx的活力,改善肾组织的氧化应激损伤[15-17]。姜黄素在发挥抗氧化应激作用的同时,也表现一定程度的促氧化作用。姜黄素这一作用主要是通过过氧化物酶系统产生苯氧基团,后者协同氧化细胞内谷胱甘肽或NADH,在细胞摄入O2时产生ROS[18-20]。Sandur等[21]证实姜黄素的这种双向作用与其在体内的药物浓度有关,两者之间可以相互转化;Hatcher等[22]也证实了同样的看法,并进一步指出姜黄素是一个自由基清除剂和氢供体,具有双重活性。
综上,姜黄素具有多种药理作用,但具体机制至今尚未完全阐明,本研究从Nrf2的氧化应激作用研究了姜黄素对于脓毒症所致肾脏损伤的保护作用,对脓毒症在基因对抗氧化方向的研究提供新的思路。当然脓毒症作为一个涉及多因素的复杂病理、生理过程,仍需全面、系统、多层次的研究,才能攻克这一难题。

