吉西他滨联合厄洛替尼通过抑制突变型p53蛋白表达促进胰腺癌细胞凋亡*
黄欣昊, 柳千帆, 宋春灼, 朱海涛
(1.贵州医科大学 临床医学院, 贵州 贵阳 550025; 2.贵州医科大学附院 临床研究中心,贵州 贵阳 550004; 3.贵州医科大学附院 肝胆外科, 贵州 贵阳 550004)
胰腺癌是一种化学治疗效果差、对绝大多数化疗药物都不敏感的难治性恶性肿瘤[1-3]。与近年来大多数肿瘤生存率稳定增长趋势相反,胰腺癌患者的死亡率逐年增加,且晚期胰腺癌患者5年生存率仅达3%[4-5]。1996年,吉西他滨(gemcitabine,GEM)被美国食品药品监督管理局批准用于胰腺癌治疗[6],至今依然是胰腺癌治疗的一线化学治疗药,但对患者的生存期及总生存率并没有明显的提高[7-8];厄洛替尼(erlotinb,ERL)是目前临床上唯一与GEM联用后对患者有生存优势的分子靶向药物[9-11]。本课题前期研究结果表明,GEM联合ERL可以改善患人胰腺癌肿瘤裸鼠的生存状态,并延长其中位生存期[12]。为进一步探究GEM与ERL合用治疗胰腺癌的分子机制,本研究通过双染流式细胞技术观察不同药物处理后人胰腺癌细胞PANC-1细胞的凋亡情况,运用实时荧光定量PCR法观察p53基因的表达,同时通过Western Blot法观察p53及其信号通路下游重要生物分子BAX蛋白表达水平,以探究GEM联合ERL治疗胰腺癌可能的生物分子机制,为临床用药及新药研发提供科学依据。
1 材料与方法
1.1 材料
1.1.1细胞株、主要药品和试剂 人胰腺癌细胞PANC-1由中国科学院干细胞库提供,GEM、ERL购自美国Selleck Chemicals公司,DMEM高糖培养基、含0.02%EDTA的0.25%胰酶溶液购自美国GIBCO公司,胎牛血清购自以色列Biological Industries公司,SDS、TEMED、Tris-Base、甘油、甘氨酸、Tween-20、RIPA、PMSF蛋白酶抑制剂均购自北京索莱宝公司,兔抗人抗体p53蛋白、BAX抗体购自武汉三鹰公司,二抗(羊抗兔)购自艾菲公司,一抗稀释液购自碧云天公司,ECL发光液购自美国Millipore公司,Marker购自美国Therom公司,PVDF蛋白杂交膜购自美国Millipore公司,Annexin-V APC/7AAD流式凋亡试剂盒购自中国联科公司,TRIzol购自美国BD公司,氯仿、异丙醇、无水乙醇购自上海生工生物工程有限公司,逆转录试剂盒及实时荧光PCR试剂盒购自日本TaKaRa公司。p53、GAPDH引物购自南京金斯瑞生物技术公司(p53:上游引物:CAGCACATGACGGAGGTTGT,下游引物:TCATCCAAATA CTCCACACGC;GAPDH上游引物:ACAACTTTGGTATCGTGGAAGG,下游引物:GCCATCACGCCACAGTTTC)。
1.1.2主要仪器 Optima XPN-80超高速离心机购自美国BECKMAN公司,371型细胞培养箱购自美国Thermo公司,AB2-4S1型生物安全柜购自新加坡艺思高科技公司,Mini-Pharma型垂直电泳仪购自美国Bio-Rad公司,3300型成像系统的影像分析器购自中国勤翔公司,CFX96型实时荧光定量PCR仪购自美国Bio-Rad公司,NanoDrop 2000核酸定量仪购自美国Thermo公司,Navios三激光10色流式细胞分析仪购自美国BECKMAN公司。
1.2 方法
1.2.1细胞培养及药物干预分组 PANC-1细胞培养条件是在25 cm2斜颈滤膜透气培养瓶中加入4~5 mL含10%灭活胎牛血清的DMEM高糖完全培养基,5%的 37 ℃ CO2培养箱中培养;细胞呈单层贴壁生长,细胞生长至80%~90%时用0.25%含EDTA胰酶消化传代;取生长良好的对数生长期PANC-1细胞分别在无任何药物完全培养基(对照组)、含12 nmol/L ERL完全培养基(ERL组)、含80 nmol/L GEM完全培养基(GEM组)及含20 nmol/L ERL和4 nmol/L GEM完全培养基(ERL联合GEM组)中培养24 h。
1.2.2流式细胞仪检测细胞凋亡 将1.3.1项下各组培养24 h后的PANC-1细胞用预冷PBS洗涤、胰酶消化后,收集1 × 105个细胞至离心管中。用Annexin V-APC/7AAD细胞凋亡法处理收集到的细胞,取500 μL染色缓冲液(Binding Buffer )重悬细胞,每管加入Annexin V-APC 5 μL和7-AAD 10 μL,室温避光孵育细胞5 min,将染好的细胞放入Navios三激光10色流式细胞分析仪中检测凋亡细胞数,比较各组细胞凋亡率。
1.2.3实时荧光定量PCR法检测p53基因表达 将1.2.1项下各组培养24 h后的PANC-1细胞用PBS溶液清洗3次,采用Trizol法提取样品中总RNA,并使用NanoDrop 2000核酸定量仪检测并鉴定总RNA浓度及纯度。通过逆转录试剂盒将提取的RNA进行逆转录反应,使用实时荧光定量PCR试剂盒检测p53,反应体系按照解链(95 ℃、30 s),退火延伸(95 ℃、5 s,60 ℃、30 s),共40个循环。根据仪器检测得到的循环阈值(Cycle threshold,CT值),通过相对定量2-ΔΔCt法计算得到基因的相对表达量。
1.2.4Western blot蛋白印迹法检测p53、BAX蛋白表达 将“1.2.1”中各组培养24 h后的PANC-1细胞收集至1.5 mL离心管中,PBS溶液清洗,以2 000 r/min离心10 min后去除废液,重复3次。冰上加入含PMSF的RIPA蛋白裂解液200 mL混悬细胞,冰上裂解30 min后,以4 ℃、12 000 r/min离心10 min,收集上清液并加入5×聚丙烯酰氨凝胶电泳上样缓冲液(SDS-PAGE Loading Buffer),金属浴100 ℃加热5~10 min,立即放置于冰中保存于-80 ℃冰箱。Western blot 蛋白印迹系样品在10% 的SDS聚丙烯酰胺凝胶中,80 V恒压电泳30 min后电压上调至120 V,恒压电泳约60 min;用0.45 μm PVDF膜、250 mA恒流湿转90 min,5%脱脂牛奶室温封闭30 min后,将PVDF膜放入稀释好的p53一抗孵育液、BAX一抗孵育液及GAPDH一抗孵育液中,4 ℃恒温孵育过夜;室温中孵育二抗60 min后用TBST室温振荡洗膜,滴加ECL化学发光液后于化学发光仪中曝光并观察结果,通过Image J软件进行图像分析蛋白表达量。
1.3 统计学方法
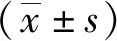
2 结果
2.1 PANC-1细胞凋亡
联合组PANC-1细胞的凋亡率分别高于对照组、GEM组和ERL组细胞(P<0.05或P<0.01),但其余各组比较差异无统计学意义(P>0.05)。见图1。
注:A为对照组,B为ERL组,C为GEM组 ,D为联合组,E为各组细胞凋亡率;与联合组比较,(1)P<0.05,(2)P<0.01,(3)P<0.001。
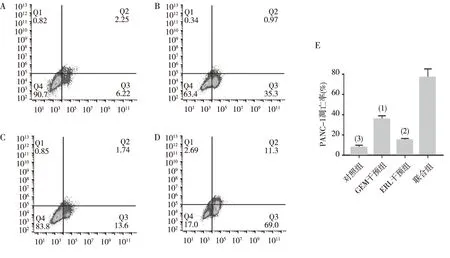
2.2 PANC-1细胞中p53基因表达
与对照组比较,GEM组、ERL组和联合组PANC-1细胞中p53基因的表达量均明显下降(P<0.001)。见图2。
注:与对照组比较,(1)P<0.001,(2)P<0.0001。
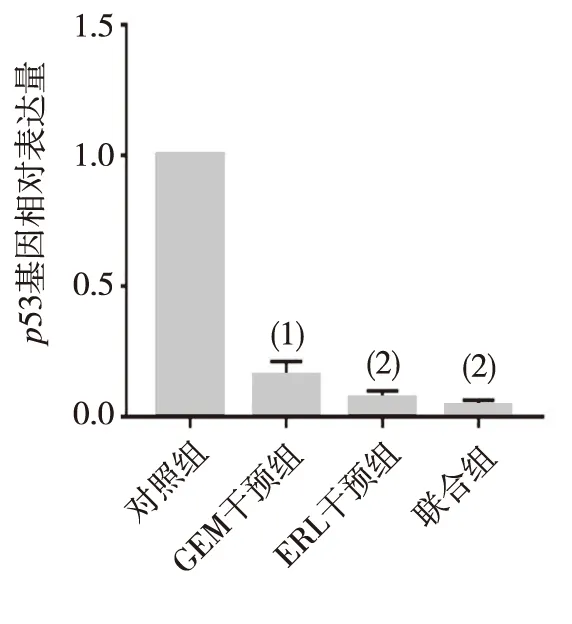
2.3 PANC-1细胞中p53蛋白和BAX蛋白表达
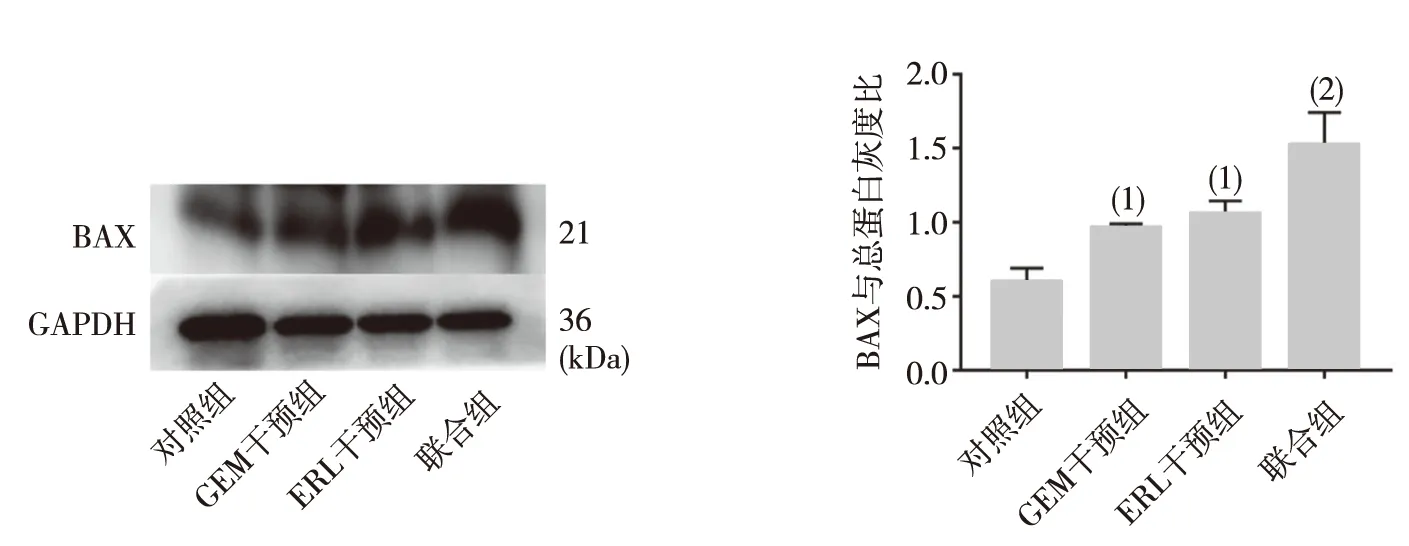
联合组PANC-1细胞中p53蛋白表达量分别低于对照组、GEM组和ERL组(P<0.05或P<0.01),其余各组比较差异均无统计学意义(P>0.05);联合组PANC-1细胞中BAX蛋白表达量分别高于对照组、GEM组和ERL组(P<0.05或P<0.01),其余各组比较差异均无统计学意义(P>0.05)。见图3、图4。
3 讨论
胰腺癌患者死亡率高,生存期短,中位生存期介于4~6月[13],且大多数对胃肠道癌症起效的化疗方案对胰腺癌并没有很好的应答[3,14]。目前在胰腺癌的治疗中,GEM作为胰腺癌治疗的一线用药广泛应用于临床中[6]。由于肿瘤的异质性,单独使用GEM易导致胰腺癌患者产生耐药性[6,15]。与此同时,多数GEM的联合化疗方案虽然在II期研究中发现很有前景,但在随后的临床人群随机实验中并未对患者总体生存期有明确的改善,例如GEM-氟尿嘧啶、GEM-伊立替康、GEM-顺铂和GEM-奥沙利铂等,即联合用药似乎与单独使用GEM的存活时间相同或优势不明显[15]。因此对于那些已经接受了以GEM为基础的一线治疗,但治疗后效果不佳或仅取得部分进展,同时愿意且能进行进一步化疗的胰腺癌患者,目前没有更优的治疗选择[3,7,14]。
注:与联合组比较,(1)P<0.05,(2)P<0.01。
注:与对照组比较, (1)P<0.05,(2)P<0.01。
ERL是首个与GEM联用后患者生存期出现优势的分子靶向药物[9-11]。ERL是一种小分子酪氨酸激酶抑制剂,靶向抑制表皮生长因子受体(epithelial growth factor receptor,EGFR )。研究表明,大部分的胰腺癌患者中EGFR表达都有明显上调,并且与预后不良和疾病进展相关[16-17];阻断EGFR酪氨酸激酶信号传导会降低人胰腺肿瘤异种移植物的生长和转移,并改善GEM的抗癌作用[18-19];ERL的抗肿瘤性与抑制EGFR的表达有着密切联系[9]。但大部分研究的检测结果发现,突变型EGFR在胰腺癌中很罕见[11];有无突变EGFR患者之间的存活时间没有显著差异[11]。由于大多数胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)患者携带有EGFR下游的鼠类肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene,KRAS)突变[2, 11]。研究表明KRAS的突变会降低ERL对肿瘤的治疗效果[11]。因此很难解释为什么上游EGFR抑制对PDAC患者有益[15]。研究显示,KRAS突变与p53突变常共存于胰腺癌中,且两者之间可能存在着一定的联系[20]。p53基因是一种抑癌基因,突变后使p53蛋白分子的空间构象发生改变形成突变型p53蛋白,突变型p53蛋白分子失去了对细胞生长、凋亡和DNA 修复的调控作用,丧失抗增殖特性,反而产生“功能增益”致癌特性,因此p53基因由抑癌基因转变为癌基因,从而有助于肿瘤细胞增殖、存活和转移[21-22]。肿瘤中的突变p53基因是在多种肿瘤谱系中广泛存在的癌基因,与肿瘤的增殖和生存有着密切的联系[23-24]。研究发现,约75%的胰腺癌中发现有p53基因突变,p53基因的突变与胰腺癌的分化有着密切关系[2,8];突变型p53蛋白的持续表达是维持小鼠胰腺癌转移表型的需要[25]。在p53信号通路中下游分子BAX是介导p53信号通路的凋亡作用关键分子,通过BAX的释放以及BAX寡聚化并插入线粒体外膜不可逆地诱导线粒体外膜透化,从而诱导细胞凋亡[26-28]。
本实验选用KRAS、p53均突变的人胰腺癌细胞系PANC-1细胞进行研究,通过流式细胞凋亡实验结果显示GEM组、ERL组及联合组均能在体外有效地促进胰腺癌细胞PANC-1的凋亡,尤其以联合组的凋亡程度最为明显。这似乎表明GEM与ERL合用可以增加对胰腺癌细胞的抑制,促进细胞凋亡。与此同时,实时荧光PCR实验和蛋白印迹实验结果显示,p53基因表达在ERL组、GEM组和联合组中均呈明显下调,GEM组、ERL组以及联合组均可以使p53蛋白的表达水平降低以及BAX蛋白的表达水平升高,尤其是在联合组中差异有统计学意义(P<0.05)。这些结果提示GEM联合ERL可能通过抑制了胰腺癌细胞中的突变型p53的表达,同时诱导了p53信号通路中下游重要分子BAX的表达升高,从而起到抑制肿瘤细胞生长和促进肿瘤细胞凋亡的作用。此外,本研究结果还显示,两种药物的联合使用对人胰腺癌细胞系PANC-1细胞凋亡、p53和BAX的表达影响均明显优于两种药物的单独使用。GEM和ERL的合用在这些方面的表现优于两种药物单独使用,提示两种药物在合用中可以增加彼此对胰腺癌细胞的抑制作用。
综上所述,本实验通过体外实验结果表明,GEM联合ERL可能通过影响p53信号通路,下调突变型p53,诱导并上调BAX的表达,从而发挥促进肿瘤的凋亡作用。然而,有关两种药物联合与p53信号通路之间更准确的作用机制尚有待进一步确定,还需在其他胰腺癌细胞系中进行验证,从而为改善胰腺癌药物治疗作用及胰腺癌患者的愈后提供理论依据。

