二氢杨梅素对肺癌A549细胞增殖和凋亡的影响*
刘金河, 葛章文, 张望明, 晏文涛, 刘志, 吴昌学
(1. 贵州医科大学 细胞工程生物医药技术国家地方联合工程实验室 组织工程与干细胞实验中心 贵州省再生医学重点实验室, 贵州 贵阳 550004; 2.中国医学科学院 成体干细胞转化研究重点实验室, 贵州 贵阳 550004; 3.贵州省人民医院 检验科, 贵州 贵阳 550002; 4.贵州中医药大学第一附属医院 检验科, 贵州 贵阳 550001; 5.贵州医科大学 分子生物学重点实验室, 贵州 贵阳 550004)
肺癌在我国癌症的发病率和死亡率中均居首位,近年来发病呈升高趋势[1]。非小细胞肺癌(non-small celllung cancer,NSCLC)是肺癌的主要类型,约占肺癌的80%,该类型的肺癌早期特征不明显,确诊时往往已是中晚期,且术后的转移率较高,5年生存率仅为20%[2-3]。目前,肺癌的化疗主要采用铂类药物,如顺铂或卡铂,但多次使用后会出现耐药性,并且患者化疗后生活质量较差。因此,寻找其他行之有效的药物及治疗途径对肺癌治疗就有着至关重要的意义[4]。二氢杨梅素(dihydromyricetin, DMY)是一种黄酮类化合物,主要存在于杨梅科、柳科、葡萄科及藤黄科等植物中,在藤茶属植物中含量最高[5-6]。最近的研究表明,DMY具有广泛的药理活性,能够通过促进细胞凋亡、多环节阻滞及延缓肿瘤的发生发展来抑制肿瘤的扩散[7-8];DMY还通过下调semaphorin 4D蛋白表达来抑制结直肠癌的发展[9],通过激活PI3K/Akt/ FoxO3a信号通路来阻止人脐静脉血管内皮细胞(human umbilical vein endothelial cells, HUVECs)的氧化损伤[10];临床上,DMY也能缓解地塞米松造成的肌肉萎缩[11]。但DMY对肺癌A549细胞作用的研究相对较少,本研究采用不同浓度的DMY处理肺癌A549细胞,观察处理后A549细胞的增殖及凋亡情况,报告如下。
1 材料与方法
1.1 主要材料和仪器
1.1.1细胞、药物和试剂 人肺癌A549 细胞株购自上海中国科学院细胞研究所,0.25%胰酶、青霉素、链霉素、EDTA、PBS、二甲基亚砜(DMSO)、DMEM高糖培养基、胎牛血清购自HyClone公司,动物细胞凋亡DNA Ladder抽提试剂盒购自碧云天生物有限公司,DMY购自上海源叶生物公司,MTT、Hoechst 33342/PI双染试剂盒购自北京鼎国生物有限公司。
1.1.2主要仪器 Mode l550酶标仪购自美国BIO-RAD公司,CO2培养箱购自美国Cellstar公司,低温高速离心机购自德国HeraeusSepateeh公司,BHZ-RFL-T3荧光倒置显微镜购自日本Olympus公司。
1.2 方法
1.2.1细胞培养 取肺癌A549细胞培养于含10%胎牛血清的DMEM培养基当中,置于5% CO2、37 ℃恒温细胞培养箱中传代培养;细胞生长融合度为80%时,用0.25% 胰蛋白酶消化,隔天换液、传代,取对数生长期的A549 细胞进行后续研究。
1.2.2DMY对肺癌A549细胞增殖的影响 取对数生长期的肺癌A549细胞分为1、5、10、15、20 mg/L DMY组(分别加入相应量DMY处理细胞)及对照组(加入等量DMSO处理细胞),37 ℃、5% CO2培养箱中培养72 h,加入5 g/L MTT ,置于培养箱继续培养4 h,吸取上清液后,每孔加入二甲基亚砜150 μL,避光孵育10 min 后放在酶标仪上测定各孔在490 nm 处的吸光度值,计算细胞抑制率[4],同时计算DMY 对A549细胞的半数致死量(IC50值);选取IC50值附近浓度的 DMY 处理细胞, 分别在24、48及72 h时,采用MTT进行细胞存活率检测[8],实验重复3次。
1.2.3DMY诱导肺癌A549细胞的凋亡 取对数生长期的A549细胞以5×104个/孔接种于6孔板内,置 37 ℃、5% CO2培养箱中培养过夜。将细胞分为DMY组及对照组,DMY组加入终浓度大约为IC50值的DMY,对照组加入等量DMSO,37 ℃、5% CO2培养箱中继续培养48 h、胰酶消化,预冷的 PBS 洗涤 2 次,Hoechst33342和PI各 5 μL,混匀后4 ℃下避光孵育 25 min,PBS清洗后于荧光显微镜下观察。
1.2.4DMY对A549细胞中DNA的影响 参照Li等[11]的实验方法,采用DNA ladder凝胶电泳观察A549细胞中DNA变化,取对数生长期的A549细胞分为DMY组及对照组,DMY组加入终浓度大约为IC50值的DMY,对照组加入等量DMSO,37 ℃、5% CO2条件下培养48 h,胰酶消化,PBS清洗后,离心去上清,收集细胞,提取细胞内的DNA,2%的琼脂糖凝胶跑胶后凝胶成像系统进行拍照分析。
1.3 统计学方法
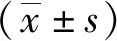
2 结果
2.1 DMY抑制肺癌A549细胞增殖
MTT结果显示,DMY 作用 A549 细胞72 h时,对 A549 细胞具有显著的杀伤作用,细胞抑制率随着 DMY 浓度的增加逐渐增高,组间比较差异有统计学意义(P<0.01), 当浓度达到20 mg/L时,DMY 对 A549 细胞增殖的抑制率高达86%(图1A),进一步计算可知IC50值为(13.16±0.098)mg/L。选取接近IC50值的 DMY 浓度(15 mg/L DMY)处理A549细胞,分别在24、48及72 h时进行细胞存活率检测,结果显示在处理72 h内,细胞存活率随着时间的延长逐渐降低,组间比较差异有统计学意义(P<0.01),见图1B。

注:A为不同浓度DMY处理肺癌A549细胞72 h,与对照组比较, (1)P<0.05,(2)P<0.01;B为15 mg/L DMY与肺癌A549细胞作用不同时间,与对照组比较, (1)P<0.05,(2)P<0.01。
2.2 DMY促进肺癌A549细胞凋亡
用 Hoechst 33342/PI 染色观察 DMY 诱导 A549 细胞的凋亡,对照组 A549 细胞用染色剂染色后,荧光显微镜下可见细胞核呈现弥散均匀的淡蓝色荧光;采用15 mg/L DMY 处理A549细胞 48 h 时,荧光显微镜下可见细胞核呈现致密的强蓝色荧光,并且染色质凝集,提示这些细胞处于凋亡状态。见图2。

图2 对照组和15 mg/L DMY 处理组肺癌 A549 细胞凋亡情况(Hoechst 33342/PI,×400)
2.3 DMY诱导肺癌A549细胞DNA断裂
用DNA ladder试剂盒检测DMY对A549细胞DNA的影响,对照组细胞DNA电泳成一条条带,未出现Ladder现象;15 mg/L DMY处理48 h时,A549细胞中凋亡 DNA 小片段增加,出现Ladder现象。见图3。

注:对照组DNA未见梯状条带,1号泳道代表DMY(15 mg/L)。
3 讨论
肺癌在所有癌症的发病率中居于首位,并且具有临床表现不明显,治疗效果差的特征。我国人口众多,肺癌发病率居高不下,新发病例和死亡人数均超过全球的1/3,且发病率还在逐年增加[12]。目前的研究显示,肺癌的发病机制尚未阐明,成为提高治疗效果和改善预后的主要障碍。
近年有研究显示, DMY 不仅在体外对人乳腺癌、鼻咽癌、肝癌等多种肿瘤细胞有抑制作用[13-16], 活体条件下 DMY 也可以显著抑制人肝癌 Bel-7402 裸鼠移植瘤的生长[17]。在皮肤鳞状细胞癌及神经胶质瘤细胞中,DMY 能诱导相关信号通路启动细胞自噬死亡程序[18-19]。DMY 作为一种黄酮类化合物,不仅具有广泛的抗肿瘤活性还具有其他药理学活性,其在抗菌[20]、抗神经炎症[21]、抗肝细胞[22]及心肌损伤[23]等方面具有显著的效果,最近的研究还发现其对睡眠的改善也有一定的作用[24]。DMY在藤茶属植物中含量最高,并且在国内分布广泛、取材容易、价格合理,若能开发为抗肿瘤药物,成药后价格便宜,具有先天的优势。
综上所述,本研究中采用DMY干预肺癌 A549 细胞,发现DMY能抑制细胞增殖,并且很小剂量时就具有极显著的效果,且具有浓度及时间依赖性(P<0.01)。15 mg/L的DMY干预 肺癌A549 细胞 48 h后,细胞进入凋亡状态,DNA ladder显示细胞中的基因组 DNA 不同程度被打断,说明DMY能够通过引起 A549 细胞内DNA的程序性断裂而促进细胞凋亡。由此可见,DMY 对肺癌 A549细胞增殖有良好抑制效果,在治疗肺癌方面具有较大的临床研究价值。

