超声双重造影在判断直肠癌术前T分期中的应用价值
周平安,宋圆圆,石秀英,刁杰,张小斌,闫娟
直肠癌起病隐匿,就诊时多进入中晚期,复发与转移风险大。据报道,国内直肠癌患者的5年生存率不足60%[1],如何实现直肠癌的早期诊断成为当前热点。以往,超声检查直肠癌主要采取灰阶模式,但经腹超声受肠道蠕动、肠内容物等因素影响,诊断价值受限[2]。研究显示,直肠癌肿瘤浸润深度是决定直肠癌术前分期的主要因素,如肿瘤突破固有肌层,通常为T3分期以上,建议先予新辅助放化疗后再行根治性手术[3]。故直肠癌T2及T3分期的鉴别是当前重点与难点,判断直肠癌术前分期意义重大,将直接影响治疗方案的选择。超声双重造影技术借助微泡造影剂对病灶进行显像,以往多用于胃部肿瘤诊断[3],在直肠癌肿瘤浸润深度及术前分期中的应用研究仍较为缺乏。本研究对87例直肠癌患者进行超声检查,探讨超声双重造影对判断直肠癌术前T分期中的临床价值,现报道如下。
1 资料与方法
1.1 一般资料
收集延安大学附属医院2015年1月至2019年3月87例直肠癌患者的临床资料,其中男46例、女41例;年龄32~79岁,平均(61.95±6.79)岁。研究获医院伦理委员会批准。
1.2 纳入排除标准
(1)纳入标准:①经手术病理确诊;②术前1周左右行超声双重造影检查;③签署知情同意书。
(2)排除标准:①结肠高度扩张或伴梗阻、腹膜炎及可疑肠穿孔者;②入组前6个月内有炎症性肠病史或肠道手术史者;③有增生性肠病史者;④伴肝、肾、肺功能障碍者;⑤心功能Ⅲ~Ⅳ级者;⑥对造影剂过敏者;⑦图像质量无法满足诊断要求者;⑧检查前有过放化疗等治疗史者。
1.3 方法
所有患者均行常规经腹超声检查与经直肠双重超声造影。所用设备为彩色多普勒超声诊断仪(日立Vision Preirus),探头频率7.5 MHz。
1.3.1 常规经腹超声检查 检查前约2 h清洁灌肠,嘱患者憋尿。检查时取仰卧位,对直肠进行扫查,观察并记录病灶位置、血流信号强度、边界等情况,按半定量法对病灶血流分级,常规探查腹盆腔远处转移情况。
1.3.2 超声双重造影 检查时取左侧屈膝位,行直肠灌注造影:经肛管向直肠腔内缓慢灌注助显剂(湖州东亚公司,加入450 mL沸水搅拌为糊状,冷却至室温备用),肿瘤位于中下段者灌注50~120 mL,肿瘤位于上段者灌注120~150 mL。于探头表面涂少许耦合剂并套无菌橡胶套,缓慢推进肛门内,对肠腔充盈、狭窄、肿瘤位置情况进行观察,探头顶端处在肿瘤下缘,于肛缘处在探头上做标志,记录肿瘤距肛缘距离。多角度观察病灶,测量范围、肠壁厚度等信息,记录形态、回声、血流信号、肠壁浸润深度、肠周肿大淋巴结及与周围组织关系。明确最佳显示切面后切换造影模式,进行双幅显示。经肘静脉团注SonoVue造影剂(意大利Bracco公司,注入0.9%生理盐水5 mL混匀待用)2.5~3.0 mL,动态观察感兴趣区域3 min,存储动态图像。结合二维图像与造影剂微循环灌注分析病灶范围、浸润深度、与周围组织关系,判断T分期。
1.4 判定标准
1.4.1 病理结果判定 以手术病理结果为金标准,参照国际抗癌联盟TNM分期标准[4],根据肿瘤侵犯程度划分分期。①T1期:侵及黏膜下层;②T2期:侵及固有肌层;③T3期:穿透固有肌层侵及浆膜层;④T4期:侵及其他脏器。
1.4.2 直肠癌浸润深度的超声分期 参照Beynon等[5]的分期标准:①T1期:肿瘤局限于黏膜、黏膜下层内,第2层高回声带完整,造影时病灶高增强、固有肌层低或无增强;②T2期:肿瘤浸润固有肌层,病灶局部第2层高回声带破坏、肌层低回声增厚,第3层高回声带完整,造影时病灶及固有肌层局部或全部早期高增强,晚期低增强;③T3期:肿瘤累及全层并浸润肠周围纤维脂肪组织,病灶局部第3层高回声带破坏,可见低回声不规则锯齿状突起,造影时病灶及直肠壁全层早期高增强,晚期低或无增强,累及肠周组织;④T4期:肿瘤侵蚀邻近器官或组织,周围脏器边缘高回声带消失,与肿瘤低回声带无分界,造影时病灶高增强且延续至周边脏器。
1.4.3 血流分级 参考Adler血流半定量分级法[6]:0级,肿瘤内部及周边未见血流信号;Ⅰ级,周边有点或线状血流信号或结节内可见2个点状血流信号;Ⅱ级,肿瘤内有3~4个点状血流信号或1~2条穿支血管;Ⅲ级,肿瘤内超过3条血管或血管互交织成网状。0~Ⅰ级为血流信号不丰富,作为良性病变的判断依据,Ⅱ~Ⅲ级为血流信号丰富,可作为恶性病变判断依据。
1.5 统计学方法
2 结果
2.1 手术病理结果
共纳入87例患者,累及肠壁病灶上下径2.2~5.7 cm,平均(3.80±1.02)cm;厚度 0.7~2.2 cm,平均(1.41±0.42)cm。均为腺癌,分化程度:高分化16例、中分化45例、低分化腺癌26;T分期:T1期13例、T2期20例、T3期37例、T4期17例。
2.2 超声表现
2.2.1 常规经腹超声 87例患者中,70例表现为直肠区向腔内突起的“假肾征”,位置固定,边界模糊,其余17例表现为肠壁局限性增厚。其中25例可见局部肠壁层次紊乱,51例可见肠腔狭窄变形,3例表现为低回声结节,3例表现为靶环征,5例发现肝脏转移灶。
2.2.2 超声双重造影 所有患者均可见肠壁不规则低回声增厚突起,部分伴肠腔狭窄,肠壁僵硬。43例增厚的肠壁可见凹状溃疡(见图1),48例直肠周围可见低回声或不均质的圆形或椭圆形淋巴结影(见图2)。肿瘤与周围组织粘连、分界模糊。受侵肠壁层次紊乱,受侵肠周脂肪层可见毛刺样或锯齿样突起。85例的病灶增强时间早于周围正常肠壁,2例与周边同步增强。增强初期可见树枝状粗大血管影,动脉相病灶为不均匀高增强,静脉相迅速消退为低或无增强。
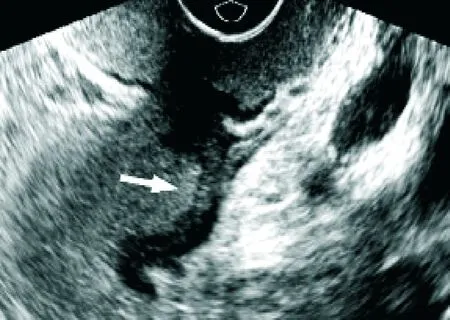
图1 超声灌注造影下溃疡性直肠癌表现
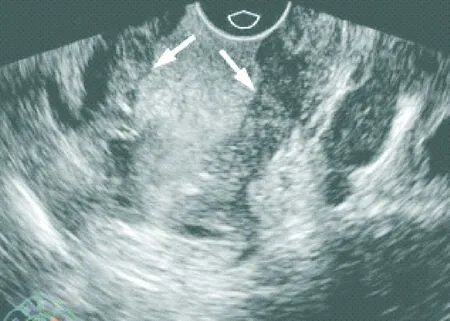
图2 超声灌注造影下浸润性直肠癌表现
2.3 直肠癌血流诊断情况比较
常规经腹超声与超声双重造影直肠癌血流丰富情况,经McNemar检验,两种检查方法比较,差异有统计学意义(P=0.000),见表1。

表1 直肠癌血流诊断情况比较
2.4 不同方法的直肠癌T分期结果
经一致性检验,常规经腹超声与病理结果一致性一般(kappa=0.647,P=0.000),超声双重造影与病理结果一致性满意(kappa=0.899,P=0.000),见表2。常规经腹超声诊断直肠癌T分期的准确率75.86%,超声双重造影诊断直肠癌T分期的准确率93.10%,经McNemar检验比较,差异有统计学意义(P=0.003),见表3。
3 讨论
目前认为,早期直肠癌通常可采取根治切除术或内镜下切除,术式选择取决于肿瘤定位;T3、T4的进展期直肠癌则需通过术前新辅助放化疗实现肿瘤分期的下降,从而降低局部复发风险[7],故术前明确直肠癌分期对于治疗方案的制订极为重要。

表2 两种方法诊断准确性比较 [n(%)]

表3 两种检查方法准确率比较
直肠腔内超声用于直肠癌T分期的临床研究已有较多报道,以往曾采用水灌肠,可减轻肠道气体与残渣对超声波的干扰,但会对肿瘤造成一定压迫,干扰病灶观察,且水排空速度相对较快,不利于病灶局部观察,同时后方增强效应明显,不利于后壁及深部肿瘤的评估[8]。胃窗超声造影剂是回声型造影剂,显示均匀的中等水平回声,与胃肠道低回声病变形成相对较明显的反差,且伪像少,排空慢,应用价值受到临床认可[9]。
本研究对87例直肠癌患者进行超声检查,结果显示,常规经腹超声的影像学表现以向腔内突起的“假肾征”、肠壁局限性增厚等为主[10];超声双重造影中的肠壁不规则低回声增厚突起表现的特异性则较高,检查与病理结果一致性满意,所有患者均可见上述征象,且多数患者伴凹状溃疡、不均质淋巴结影等,病灶增强时间多早于周围正常肠壁。结果显示,常规经腹超声诊断直肠癌T分期的准确率75.86%(66/87),出现8例诊断过度与11例诊断不足,超声双重造影诊断直肠癌T分期的准确率93.10%(81/87),显著高于常规经腹超声,仅出现2例诊断过度与4例诊断不足,诊断价值明显更高。笔者认为,超声双重造影诊断直肠癌T分期可获得相对更高的准确率与以下几点有关:①回声型助显剂有利于克服肠道内粪渣、气体的影响,形成良好声窗,将观察范围扩大至距肛缘约15 cm,可提高周围邻近器官声像清晰度。②腔内超声探头可深入肠腔内直接接触肿瘤,有利于准确评估肠壁浸润深度。③直肠癌属富血供肿瘤,肿瘤内新生血管生成是其增殖、浸润的关键。而直接肠腔内观察与造影剂应用有利于客观评价肿瘤血供及微循环情况。研究发现,正常直肠壁在超声双重造影下可见3层结构,其中肿瘤与正常组织微循环灌注模式的差异是该其进行准确T分期的基础[11]。本研究结合研究体会也认为,肿瘤造影增强模式、增强时相、微血管分布等为侵袭范围的判定提供了更多信息,与常规经腹超声相比更具优势,这是超声双重造影诊断T分期准确率更高的原因之一。有专家认为,难以准确判断腹膜返折这一解剖结构是造成T3与T4分期诊断错误的主要原因[12]。另外,也有研究认为,部分新生血管存在炎症反应导致病灶范围扩大、肠壁增厚与肠壁结构紊乱,使声像图与肿瘤浸润难以区分是造成超声双重造影过度分期的主要原因[13-16]。而分期不足则多由超声医师经验不足造成。值得注意的是,超声双重造影检查结果具有一定的主观性,对超声医师解剖学知识、阅片经验有较高要求,应引起重视。另外,超声双重造影的腔内探头扫查范围盲区较多,尤其无法观察远处转移,而将其与经腹超声联合,可获得更全面的诊断信息,从而提供更准确的术前诊断信息,其对治疗等相关措施的指导作用更好[17-19]。黄伟钦[20]的研究表明,超声双重造影用于直肠癌术前分期的价值高于常规经腹超声,与本研究结论一致。
综上,超声双重造影判断直肠癌术前T分期的有效诊断方法,不受胃肠道气体干扰,可重复性高,可为直肠癌患者的临床治疗提供有用信息。

