硅钼蓝法测定硅烷化玻璃酸复合物中的有机硅含量
张治云,姜鹰雁,刘荣磊,刘亚方,陈建英
(1.山东省药学科学院,山东 济南 250101;2.山东福瑞达医药集团有限公司 山东省黏膜与皮肤给药技术重点实验室,山东 济南 250101)
玻璃酸及其盐(hyaluronan,HA)是生物体内广泛存在的一种酸性黏多糖,在人体中主要分布于软骨、关节滑液、眼玻璃体和皮肤中,通常使用其钠盐,即玻璃酸钠(sodium hyaluronate,SH)[1]。SH由(1→4)-D-葡糖醛酸-β-(l→3)-D-N-乙酰葡糖胺的双糖单位重复连接构成[2],广泛应用于眼科、骨科、保健食品、化妆品等领域[3]。SH对皮肤具有显著的保湿、抗衰老、营养、修复等作用,且使用安全,在化妆品中的应用日趋广泛[4-6]。硅烷化玻璃酸复合物(silanol hyaluronate compound,SHAC)是HA的二甲基硅烷醇衍生物,实验研究证明其无皮肤刺激性、无细胞毒性,相比SH具有更好的保湿性能和促进角质细胞增殖作用[7]。SHAC中有机硅含量可反映SHAC的硅烷化程度,本文采用硅钼蓝比色法测定硅烷化玻璃酸复合物中有机硅含量,为其质量控制提供参考。
1 仪器与材料
1.1 仪器
UV-2550紫外-可见分光光度计(日本岛津);Agilent 8454紫外-可见分光光度计(美国安捷伦);XS205电子分析天平(瑞士 Mettler);马弗炉(鲁龙 SX2-4-10,山东鲁龙)。
1.2 材料
钼酸铵(天津市大茂化学试剂厂,优级纯,批号:20141123);抗坏血酸(天津市大茂化学试剂厂,分析纯,批号:20150216);硅酸钠(天津科密欧,优级纯,批号:20141107);草酸(天津科密欧,分析纯,批号:20150321);浓硫酸(天津科密欧,分析纯,批号:20140619);无水乙醇(天津康科德,色谱纯,批号170804);盐酸(国药集团,分析纯,批号20180223);硅烷化玻璃酸复合物(山东福瑞达生物工程公司,批号20170920,20171123,20180323)。
2 方法与结果
2.1 溶液配制
2.1.1 钼酸铵溶液 称取钼酸铵四水合物5.0 g,置入100 ml聚乙烯量瓶,加水适量超声使溶解,加水稀释至刻度,摇匀。
2.1.2 混合酸溶液 称取草酸5.0 g,置入100 ml聚乙烯量瓶,加3 mol/L的硫酸溶解并稀释至刻度,摇匀。
2.1.3 抗坏血酸溶液 称取抗坏血酸2.0 g,置入100 ml聚乙烯量瓶,加水溶解并稀释至刻度,摇匀。
2.1.4 硅标准溶液 称取硅酸钠(Na2SiO3·9H2O)1.000 g,置入100 ml聚乙烯量瓶,加水适量使溶解并稀释至刻度,摇匀,作为硅储备液;精密量取硅储备液1.0 ml,置入100 ml聚乙烯量瓶,加水稀释至刻度,摇匀,作为硅标准溶液(含Si 9.88 μg/ml),备用。
2.1.5 样品溶液 称取硅烷化玻璃酸复合物溶液约10.0 g,精密称定,置镍坩埚中,置电炉上蒸干,残渣缓慢炽灼至完全炭化,置马弗炉中于700 ℃灼烧4 h,使其充分灰化;取出,冷却至室温,加入氢氧化钠4 g,盖上坩埚盖,置于马弗炉中,逐渐升温至550 ℃熔融30 min,取出冷却至室温,置于250 ml聚乙烯烧杯内,加沸水适量,超声使溶解,将浸提液转移至500 ml聚乙烯量瓶,用沸水分数次洗涤坩埚和坩埚盖,洗液并入量瓶中,加盐酸调pH至6~7,用水稀释至刻度,摇匀。
2.2 样品测定方法
精密量取样品溶液5.0 ml,置入100 ml聚乙烯量瓶,加水稀释至20 ml,加0.5 mol/L硫酸溶液5 ml,无水乙醇5 ml,摇匀,加钼酸铵溶液5 ml,室温放置10 min,加入混合酸溶液10 ml,抗坏血酸溶液5 ml,立即混匀,加水稀释至刻度,摇匀,室温放置10 min;另量取水5.0 ml,置入100 ml聚乙烯量瓶,同法操作得空白溶液。以空白溶液调整零点,在810 nm处测定吸光度,通过标准曲线计算样品溶液中硅浓度。
2.3 检测波长选择
精密量取硅标准溶液5.0 ml,置入100 ml聚乙烯量瓶,加水稀释至20 ml,加0.5 mol/L硫酸溶液5 ml,无水乙醇5 ml,摇匀,加钼酸铵溶液5 ml,室温放置10 min,加入混合酸溶液10 ml,抗坏血酸溶液5 ml,立即混匀,加水稀释至刻度,摇匀,室温放置10 min,得对照品溶液;另量取水5.0 ml,置入100 ml聚乙烯量瓶,同法操作得空白溶液。以空白溶液调整基线,于400~900 nm对对照品溶液进行扫描,结果见图1。
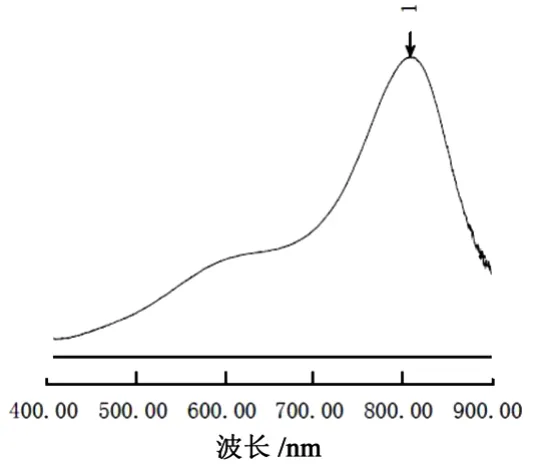
图1 硅对照品溶液吸收图谱
由图1可见,硅对照品溶液在810 nm处有最大吸收,因此将检测波长定为810 nm。
2.4 显色溶液稳定性
精密量取硅标准溶液5.0 ml,置入100 ml聚乙烯量瓶,加水稀释至20 ml,加0.5 mol/L硫酸溶液5 ml,无水乙醇5 ml,摇匀,加钼酸铵溶液5 ml,室温放置10 min,加入混合酸溶液10 ml,抗坏血酸溶液5 ml,加水稀释至刻度,摇匀,分别于显色后不同时间于810 nm处测定溶液吸光度,结果见表1。

表1 不同显色时间硅对照品溶液吸光度
由表1可见,加入抗坏血酸后,溶液吸光度逐渐增大,10 min后吸光度达到稳定值,在10~60 min内溶液吸光度稳定性良好。
2.5 线性试验
精密量取硅标准溶液1.0,2.0,3.0,4.0,5.0 ml,分别置入100 ml聚乙烯量瓶,加水稀释至20 ml,加0.5 mol/L硫酸溶液5 ml,无水乙醇5 ml,摇匀,加钼酸铵溶液5 ml,室温放置10 min,加入混合酸溶液10 ml,抗坏血酸溶液5 ml,立即混匀,加水稀释至刻度,摇匀,室温放置10 min,得不同浓度硅对照品溶液;另量取水5.0 ml,置入100 ml聚乙烯量瓶,同法操作得空白溶液。以空白溶液调整零点,在810 nm处分别测定对照品溶液吸光度。以对照品溶液中Si浓度(C,μg/ml)为横坐标,吸光度(A)为纵坐标,绘制标准曲线,得回归方程A=1.2156C+0.0023,r=0.9999。结果表明,硅浓度在0.0988~0.484 μg/ml范围内线性关系良好。
2.6 重复性试验
取硅烷化玻璃酸复合物溶液(批号20180323)6份,每份10.0 g,精密称定,分别按2.1.5项下方法制备样品溶液,按2.2项下方法测定吸光度,通过标准曲线法计算硅浓度及样品中硅含量。结果6份样品中硅含量平均值为0.027 %(RSD=1.12 %),表明方法测定样品的重复性良好。
2.7 精密度试验
取线性试验项下硅标准溶液5 ml显色所得对照品溶液,于810 nm连续测定6次,结果吸光度平均值为0.601,RSD为0.13 %,表明仪器精密度良好。
由实验室内另一实验人员采用不同紫外-可见分光光度计,按2.6项下方法测定硅烷化玻璃酸复合物溶液(批号20180323)硅含量,平行测定6份硅含量平均值为0.026 %(RSD=1.54 %)。结果表明,不同实验人员采用不同仪器测定同一批次样品样品,所得硅含量无明显差别,说明方法中间精密度良好。
2.8 回收率试验
取9只50 ml镍坩埚,分别精密加入硅烷化玻璃酸复合物溶液(批号: 20180323)5.0 g,平均分为3组,第一组分别加入2.1.4项下硅储备液1.2 ml,第二组分别加入2.1.4项下硅储备液1.5 ml,第三组分别加入2.1.4项下硅储备液1.8 ml,分别按2.1.5项下方法制备样品溶液并按2.2项下方法测定吸光度,通过标准曲线计算硅浓度及硅的回收率,结果见表2。平均回收率为98.52 %(RSD=1.74 %),表明方法准确度良好。
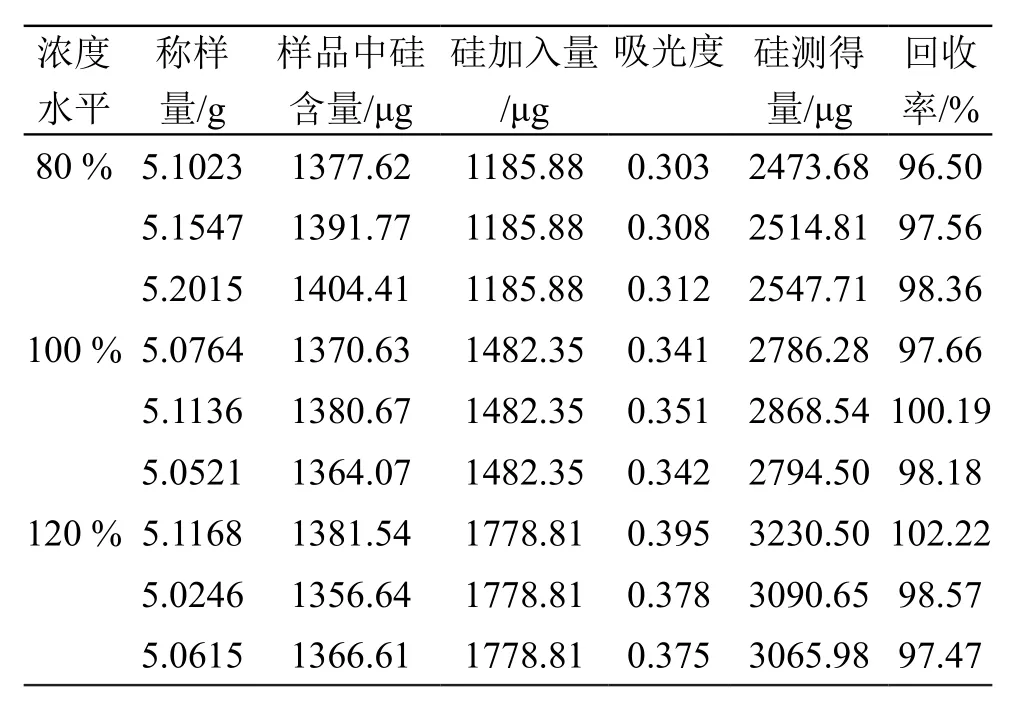
表2 硅回收率试验结果
2.9 样品测定
分别按2.1.5项下方法制备样品溶液,按2.2项下方法测定,通过标准曲线法计算硅浓度及样品中硅含量,结果见表3。

表3 硅烷化玻璃酸复合物硅含量测定结果
3 讨论
硅标准溶液配制可采用高纯二氧化硅、分析纯的单晶硅或多晶硅和分析纯的硅酸钠。采用二氧化硅配制标准溶液,需将二氧化硅在高温条件下熔融,操作繁琐,耗时长,石海强等[8]采用单晶硅和硅酸钠分别配制标准溶液,测定不同浓度硅标准溶液吸光度并绘制标准曲线。结果两种物质所得硅标准溶液浓度与吸光度值线性关系良好,其相关系数分别为0.989和0.981,本研究采用硅酸钠配制标准溶液,操作简单。
硅钼蓝分光光度法测定原理是在弱酸性条件下单硅酸与钼酸铵生成黄色的硅钼酸络合物,提高溶液酸度后用还原剂(抗坏血酸、硫酸亚铁铵、硫酸亚铁等)还原成硅钼蓝络合物,其颜色深度与被测溶液中硅的浓度成正比[9]。本研究将硅烷化玻璃酸复合物在高温条件下灰化,残渣经氢氧化钠熔融处理将样品中有机态的硅转化成可溶的无机态的硅酸盐,再与钼酸铵反应生成硅钼酸,经抗坏血酸还原生成硅钼蓝,从而建立了硅含量测定方法。方法学研究表明本方法准确、可靠、操作简便,具有很高的实用价值。

