重组人骨形成蛋白-2基因工程菌株的构建及蛋白复性纯化
张秀华,刘 飞, ,刘英梅,陈 勉,刘 霞,刘金明,凌沛学, ,王凤山
(1.山东省药学科学院 山东省生物药物重点实验室 山东省多糖类药物工程实验室 多糖类药物发酵与精制国家地方联合工程实验室 博士后科研工作站,山东 济南 250101;2.山东大学 药学院,山东 济南 250101;3.浙江赛灵特医药科技有限公司,浙江 杭州 311100)
骨形成蛋白(bone morphogenetic protein,BMP)是一种多功能生长因子,属于转化生长因子β(transforming growth factor-β,TGF-β)超家族成员,能诱导血管周围游动的未分化间充质细胞向骨系细胞方向转化,在骨骼(原位)或骨骼以外组织中(异位)产生新骨[1]。
目前己知的骨形成蛋白有30多种,许多BMP亚型已显示骨诱导活性,但其中研究最为充分的为BMP-2和BMP-7,且只有这两种骨形成蛋白被开发应用于临床,是与新骨生成关系密切、最有效的诱导骨再生的骨形态发生蛋白[2]。BMP在结构上类似,是由2 条多肽链通过二硫键结合的二聚体分子[3],其特征是:由7个保守的半胱氨酸将整个分子折叠成一种独特的三维结构,称为胱氨酸结(cystine-knot),包含3对链内二硫键和一对链间二硫键。BMP 属于多功能细胞因子,研究证实BMP不仅与骨骼的形成有关,还与细胞的增殖、分化、凋亡、迁移有关,此外 BMP 还与组织器官的形成和发育如胚层的形成、肢体形成和心血管、呼吸、胃肠、泌尿及生殖、神经系统发生等基本的发育过程密切相关,在发育期和成年后的各个时期都有不同影响[4-6],研究还证实 BMP与糖物质代谢有关[7],可通过调控糖代谢过程中关键酶的表达、促进胰岛素合成及分泌、增加胰岛素敏感性等方式调节体内葡萄糖平衡。
BMP-2为疏水性酸性糖蛋白,由10余种氨基酸组成,水溶性差,酸性条件下稳定,二聚体形式为其活性形式。1996 年德国科学家Ruppert等用大肠杆菌系统成功获得有良好活性的rhBMP-2m,并就此在欧洲申请了专利,2002年7月美国食品和药物管理局(FDA)批准将rhBMP应用于脊柱融合[8-9]。美敦力公司产品Infuse®骨移植物随后上市。我国用大肠杆菌系统表达生产的rhBMP-2m也于 2004 年通过临床试验,以医疗器械的形式被批准生产投放市场,用于骨缺损的治疗。
由于提取困难且成本较高,目前BMP-2蛋白的生产多以基因工程方法在大肠杆菌中生产。但由于其疏水性较强,rhBMP-2在大肠杆菌中多以不溶性的包涵体形式表达,因此获得一株表达量高且复性方法简单、收率高的重组工程菌是近十几年研究的热点。本项目通过大肠杆菌密码子偏好性对密码子进行优化,构建了一株高效表达的产hBMP-2重组菌株。该菌株经高密度发酵后包涵体得量高,通过稀释复性法对包涵体进行复性,肝素柱亲和纯化方法对目的蛋白进行纯化,最终可得电泳纯蛋白。本项目中建立的方法简单易行,放大简单,适合工业化生产。
1 材料
1.1 试剂
限制性内切酶(NdeI,XhoI)(NEB);T4 DNA连接酶(NEB);蛋白质分子量标记(Fermentas);PfuDNA 聚合酶(Fermentas);PCR引物,DNA分子量标记,质粒抽提试剂盒(上海生工);PCR产物纯化试剂盒(上海生工);DNA胶回收试剂盒(上海生工);肝素亲和层析柱(GE公司);超滤膜(Millipore);超滤管(Millipore);碱性磷酸酶测定试剂盒(北京索莱宝);骨优导(杭州九源);其他试剂均为市售分析纯。
1.2 质粒与菌株
pET-28a(+)质粒,E.coliTop10,E.coliBL21(DE3)菌株及C2C12细胞均为本实验室保藏。
1.3 培养基
液体LB培养基(g/L):蛋白胨10,酵母粉5,氯化钠10;固体LB培养基含1.5 %~2 %琼脂粉;发酵培养基(g/L):葡萄糖5,酵母提取物5,(NH4)2HPO44, KH2PO413.3,柠檬酸1.7,MgSO4·7H2O 1.2,微量元素:FeSO4·7H2O 1,CaCl20.2,ZnSO4·7H2O 2.25 g/L,MnSO4·4H2O 0.5,(NH4)6Mo7O240.1, Na2B4O7·10H2O 0.23 g/L,CuSO4·5H2O 0.1;补料培养基(g/L):葡萄糖600,MgSO4·7H2O 20,酵母提取物100。
2 方法
2.1 基因的获得
查阅NCBI 数据库获得人BMP-2(Genebank P12643.1)成熟肽序列,碱基序列345 bp,编码115个氨基酸。根据大肠杆菌密码子偏好性对BMP-2成熟肽编码序列进行密码子优化,并分别在上下游两端添加NdeI、XhoI酶切位点,采用全基因合成方法获得优化后BMP-2基因。
2.2 BL21-pET28-rhBMP-2重组菌株的构建
PCR扩增得到BMP-2基因片段,纯化后与pET-28a(+)质粒分别用NdeI、XhoI进行双酶切,切胶回收后用T4 DNA连接酶连接,获得重组质粒pET28-rhBMP-2,CaCl2法转化E.coliTOP 10感受态细胞。阳性转化子经单酶切、PCR、测序验证正确后,提取pET28-rhBMP-2重组质粒,并转化E.coliBL21感受态细胞,得BL21-pET28-rhBMP-2工程菌株。
2.3 rhBMP-2重组蛋白的表达
工程菌株 LB液体培养基37 ℃振荡过夜培养后,以4 %接种量接种至含50 ml LB培养基的250 ml摇瓶中, 37 ℃培养4 h,加入终浓度为1 mmol/L的异丙基-β-D-硫代半乳糖苷(IPTG)进行诱导,并降温至28 ℃继续培养5 h。8000 r/min离心5 min收集菌体,用磷酸盐缓冲液(PBS)重悬后进行超声破碎,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测目的蛋白表达情况。
按相同接种量,利用发酵培养基进行1 L发酵罐小试,控制发酵温度37 ℃,pH 7.0,溶氧25 %,当溶氧快速上升且转速快速下降时开始补料,添加IPTG进行诱导,诱导后降低温度至28 ℃。继续培养,发酵期间每隔12 h取样,SDS-PAGE电泳检测蛋白表达情况,确定最佳发酵时间。
2.4 rhBMP-2包涵体的复性
收集发酵菌体,超声破碎后12 000 r/min离心20 min得到包涵体,利用包涵体洗涤液(pH 8.0 20 mmol/L Tris-HCl ,0.5 mmol/L EDTA,2 % Triton X-100)反复洗涤包涵体3次。然后用包涵体裂解液[6 mol/L盐酸胍,pH 8.0 20 mmol/L Tris-HCl ,20 mmol/L二硫苏糖醇(DTT),1 mmol/L EDTA]将包涵体裂解为终浓度35 mg/ml。采用稀释复性法进行复性,复性液[1 mmol/L 氧化型谷胱甘肽(GSSG),2 mmol/L 还原型谷胱甘肽(GSH),pH 8.0 50 mmol/L Tris-HCl ,5 mmol/L EDTA,0.5 mol/LN-环己基-2-氨基乙磺酸(CHES)]中蛋白终浓度为500 mg/L,常温复性4 d,SDS-PAGE检测蛋白复性情况。
2.5 rhBMP-2蛋白的纯化
由于BMP-2前端序列中含肝素结合位点,可用肝素亲和层析柱对其进行纯化。亲和层析所用缓冲液为4 mol/L尿素、pH 8.0 20 mmol/L Tris,洗脱单聚体所用缓冲液为4 mol/L 尿素、 pH 8.0 20 mmol/L Tris、400 mmol/L NaCl,洗脱二聚体所用缓冲液为4 mol/L 尿素、pH 8.0 20 mmol/L Tris、800 mmol/L NaCl。收集有活性的二聚体部分,用pH 4.0醋酸盐缓冲液透析除盐,透析后样品真空冷冻干燥。
2.6 rhBMP-2细胞活性测定
生长良好的C2C12细胞按1×105个/孔接种于24孔板,37 ℃、5 % CO2预培养24 h,更换新鲜DMEM培养基并分别加入不同浓度rhBMP-2(500 ng/ml、1000 ng/ml),继续培养4 d,依照碱性磷酸酶(ALP)检测试剂盒说明检测ALP活性。以骨优导为阳性对照。
3 结果
3.1 基因的获得
采用PCR扩增BMP-2基因切胶回收片段进行1.0 %琼脂糖凝胶电泳检测,结果见图1。由图1可见扩增得到的目的基因片段长度约350 bp,与理论值一致。

图1 hBMP-2基因片段琼脂糖凝胶电泳检测结果
3.2 BL21-pET28-rhBMP-2重组菌株的构建
提取Top10-pET28-rhBMP-2质粒,XhoI单酶切、PCR验证的1.0 %琼脂糖凝胶电泳结果见图2。由图2可见,单酶切后的重组质粒大小约5.7 kb,与空质粒的差值与目的基因理论值一致。以重组子为模板,利用PCR扩增得到的目的基因,也与BMP-2基因大小相一致。测序结果也显示插入的序列与设计的序列完全一致。

图2 重组质粒pET28-rhB MP-2单酶切及PCR验证结果
3.3 rhBMP-2重组蛋白的表达
在摇瓶中对rhBMP-2蛋白进行表达,并进行超声破碎,SDS-PAGE检测,结果见图3。结果显示,超声破碎上清中空载体对照与重组菌分子量无明显区别;超声破碎沉淀中,与空载体对照相比重组菌在分子量约13 kD处有明显表达条带。说明rhBMP-2蛋白在重组菌中以包涵体形式表达。

图3 rhBMP-2表达情况SDS-PAGE分析
在1 L发酵罐中进行rhBMP-2蛋白的表达,分别在发酵4,17,29,41,53,65,77 h取样,将样品稀释至相同的菌体浓度,进行全菌SDS-PAGE分析,结果见图4。发酵4 h开始补料并诱导,蛋白质开始表达,发酵约29 h时目的蛋白表达量达最大,目的蛋白占胞内总蛋白比例最高。随着发酵时间延长,目的蛋白占胞内总蛋白比例下降,但菌体密度增加,因此综合考虑蛋白含量与菌体量及成本等因素,进行大规模发酵时可控制蛋白表达时间在40 h左右。发酵结束后菌体经破碎、洗涤后称重,1 L发酵罐中rhBMP-2包涵体湿重可达20 g/L。

图4 rhBMP-2 1 L发酵罐中表达蛋白SDS-PAGE分析
3.4 rhBMP-2包涵体的复性检测
非还原SDS-PAGE电泳检测包涵体复性情况见图5,通过灰度扫描确定复性率。结果显示方法2.4项下复性液可有效复性包涵体,蛋白复性率达40 %以上。
3.5 rhBMP-2蛋白的纯化
利用肝素亲和层析柱对复性液纯化,层析图谱见图6,峰1为穿透峰,峰2为400 mmol/L NaCl洗脱峰,峰3为800 mmol/L NaCl洗脱峰。分别收集穿透峰和洗脱峰,进行非还原SDS-PAGE电泳,检测二聚体纯化情况,结果见图7。

图5 rhBMP-2复性蛋白电泳图
峰1为穿透峰,几乎无蛋白质流出,说明肝素柱能有效地与蛋白质结合;峰2为单聚体,洗脱液中绝大部分蛋白质为分子量小的单聚体;峰3为二聚体,洗脱液中二聚体蛋白纯度达95 %以上,说明该条件下单聚体与二聚体可有效分离。为确认蛋白二聚体形式,将收集的峰3样品分别加入含DTT和不含DTT的蛋白上样缓冲液进行电泳,分别对应泳道4、5。由图7可见加入还原剂DTT后二聚体被还原成了单聚体,间接说明了该蛋白的二聚体形式。

图6 rhBMP-2肝素亲和层析图谱

图7 rhBMP-2纯化结果SDS-PAGE分析
3.6 rhBMP-2细胞活性测定
C2C12细胞是成肌干细胞,在BMP-2作用下可向成骨细胞分化,分化后的成骨细胞可表达C2C12细胞内没有的碱性磷酸酶(alkaline phosphatase,ALP),因此ALP是成骨细胞的标志性酶,该检测方法已成为BMP活性检测的基本方法。
纯化后的rhBMP-2活性结果见图8。结果显示制备的rhBMP-2具有与市售产品骨优导相同的生物活性,能有效诱导C2C12细胞向成骨细胞分化,产生特异性ALP。
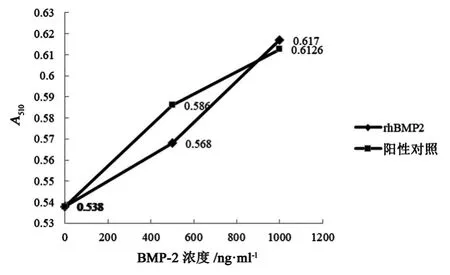
图8 rhBMP-2与对照样品骨优导生物活性比较
4 讨论
本项目中构建的hBMP-2重组工程菌表达量高,1 L发酵液可得高纯度包涵体20 g。王馥丽等[10]认为包涵体的纯度会影响复性效果,需先对包涵体进行纯化再裂解、复性,但本研究发现无需额外纯化,经简单洗涤后即可对包涵体进行裂解复性,且复性效率大于40 %,优于上述文献报道的31 %。本研究为了得到高纯度的二聚体进行后续实验研究,采用亲和层析对BMP-2进行纯化,实验也证实经亲和层析一步纯化后,可将未复性的单体和复性成功的二聚体分离,且分离得到的二聚体纯度在95 %以上,大大降低了工业生产成本。
本项目纯化得到的二聚体溶液利用透析除盐,超滤浓缩后再经冷冻干燥,每升发酵液最终可得有活性的二聚体蛋白大于100 mg。冻干后的样品经活性检测具有与市售产品骨优导相同的生物活性,可与药用明胶、大豆磷脂、羟基磷灰石等载体复合,进行新产品的开发,最终以医疗器械的形式生产投放市场,用于骨缺损的治疗。

