山羊痘病毒与小反刍兽疫病毒双重PCR 检测方法的建立
王璐瑶,宫英阑,郝雪飘,王建昌,张若曦,袁万哲,4
(1.河北农业大学动物医学院,河北保定 071001;2.河北出入境检验检疫局检验检疫技术中心,河北石家庄 050051;3.河北省动物疫病预防控制中心,河北石家庄 050035;4.河北省兽医生物技术工程技术研究中心,河北保定 071001)
羊痘又名“羊天花”,是由羊痘病毒属病毒引起的一种热性、急性、接触性羊传染病,被我国列为一类动物疫病,被世界动物卫生组织(OIE)列为须通报动物疫病。山羊痘病毒(goat pox virus,GTPV)是羊痘病毒属中的一种。羊痘的典型症状为发热、呼吸急促、鼻腔流黏液性鼻涕、在无毛或少毛部位皮肤发生丘疹和疱疹。易感羊群的羊痘病死率在10%~100%之间,羔羊病死率可高达100%,怀孕母羊会极易发生流产情况,同时也会导致羊群生产力和羊毛品质大幅降低。因此,羊痘给养羊业带来巨大的经济损失,对国际贸易和养羊业的发展也有严重影响[1]。
小反刍兽疫又名“伪牛瘟”,是由小反刍兽疫病毒(peste des petits ruminants virus,PPRV)引起的一种急性(亚急性)、热性、传染性小反刍动物疾病。其典型症状为发热、眼睛和鼻腔分泌物增多、腹泻、呼吸异常、口腔内出现坏死性病灶等,发病率在80%~90%之间,死亡率在50%~80%之间,有时可高达100%[2]。小反刍兽疫病程急,主要感染绵羊和山羊,严重阻碍养羊业发展。因此,我国将小反刍兽疫也列为一类动物疫病,OIE 同样将其列为须通报动物疫病[2]。
当羊群感染羊痘或小反刍兽疫时,均有发热、眼鼻分泌物增多、皮肤发生疤疹和溃疡等相似特征性症状,单从临床症状上难以将其区分与确诊。这两种疫病一旦发生,无论哪一种都会对养羊业造成严重影响。因此,建立一种快速、准确、方便的检测方法,对羊痘和小反刍兽疫的诊断与防控非常重要。目前,常规PCR 方法无法对这两种病原在同一体系内同时进行检测。本研究通过对PCR 反应体系和反应条件进行优化,建立了山羊痘和小反刍兽疫双重PCR 检测方法,为山羊痘和小反刍兽疫的临床诊断、疫情监测、流行病学研究提供了技术支持。
1 材料与方法
1.1 材料
1.1.1 毒株 GTPV:从山羊痘活疫苗(痘必应)中获得,购自哈药集团生物疫苗有限公司;PPRV:从小反刍兽疫活疫苗中获得,购自天康生物股份有限公司;羊口疮病毒(ORFV)、牛病毒性腹泻病毒(BVDV):由河北农业大学动物医学院实验室保存并提供。
1.1.2 仪器设备与主要试剂 TGL-16 台式高速冷冻离心机:购自湖南塞特湘仪离心机仪器有限公司;PCR 仪:购自北京鼎昊源科技有限公司;DYY-6C型电泳仪:购自北京六一仪器厂;凝胶成像系统GB0X-F3:购自美国基因有限公司;DNA/RNA 柱提法提取试剂盒:购自哈尔滨国生生物科技股份有限公司;EasyScript® RT、Ribonuclease Inhibitor:由全式金生物技术有限公司生产提供。其他试剂还包括,10×Buffer、rTaq酶、DL 2 000 bp DNA Maker。
1.2 方法
1.2.1 引物设计与合成 根据GenBank 上登录的PPRV、GTPV 两种病毒的基因序列,由上海生工生物工程有限公司扩增PPRV 和GTPV 的PCR 引物,所有序列见表1。

表1 引物序列及扩增目的基因长度
1.2.2 病毒核酸提取 根据DNA/RNA 柱提法提取试剂盒(哈尔滨国生生物科技股份有限公司)说明书,提取羊痘疫苗总DNA 与小反刍兽疫疫苗株的总RNA,置于-20 ℃备用。
1.2.3 病毒RNA 反转录 对小反刍兽疫疫苗株总RNA 进行反转录。20 μL 体系如下:RNA 10.5 μL、下游引物 2.0 μL、5×ES Buffer 4.0 μL、dNTPs 2.0 μL、ESRT 1.0 μL、RRI 0.5 μL。按 以上顺序,用移液枪将其加入1.5 mL 离心管内,然后放入42 ℃水浴锅内反转录1 h,得到的产物为PPRV 的cDNA。
1.2.4 常规PCR 检测 对提取的GTPV DNA和PPRV cDNA 分别进行PCR 扩增。PCR 体系(20 μL)为:上下游引物各0.5 μL,dNTPs 1.6 μL、10×Buffer 2 μL、rTaq酶0.1 μL、模 板2 μL,ddH2O 13.3 μL。PCR 扩增程序为:94 ℃预变性3 min;94℃变性30 s,56℃退火30 s,共35 个循环;72 ℃延伸10 min。两个基因所用PCR 程序相同,PCR 扩增产物经1%琼脂糖凝胶电泳检测。
1.2.5 双重PCR 条件优化 使用超微量分光光度计,对GTPV DNA 与PPRV cDNA 浓度分别进行检测,发现GTPV DNA 浓度为28.3 ng/μL,PPRV cDNA 浓度为645.9 ng/μL。由于核酸浓度差距较大,将模板与引物比例进行了优化,具体见表2。将提取出的GTPV DNA 和PPRV cDNA 进行双重PCR,在20 μL 体系中,按表2 中的引物比例,加入4 条引物以及dNTPs 1.6 μL、10×Buffer 2 μL、rTaq酶0.1 μL;模 板GTPV DNA 与PPRV cDNA按照表2 中比例加入,用ddH2O 补齐至20 μL。按上述PCR 程序进行PCR 扩增,用1%琼脂糖凝胶电泳检测扩增结果。
1.2.6 特异性检测 通过对GTPV 的DNA、PPRV 的cDNA、ORFV 的DNA、BVDV 的cDNA,按照上述方法进行双重PCR,检测该方法的特异性。
1.2.7 敏感性检测 将提取的GTPV DNA 和PPRV cDNA 混合后进行10 倍系列稀释,通过上述双重PCR 优化好的体系与程序进行PCR 扩增,用1%琼脂糖凝胶电泳。
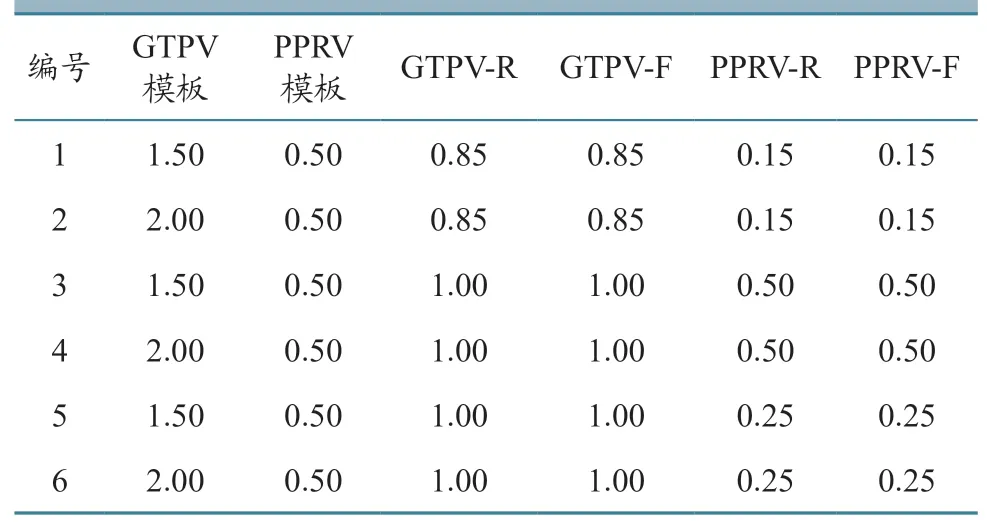
表2 体系中模版与引物的用量 单位:μL
2 结果与分析
2.1 常规PCR 鉴定
使用常规PCR 方法,对PPRV 和GTPV 进行扩增,经1%琼脂糖凝胶电泳检测,发现PPRV 阳性样本扩增条带大小为385 bp,GTPV 阳性样本扩增条带为969 bp,均与预期条带大小相符(图1)。
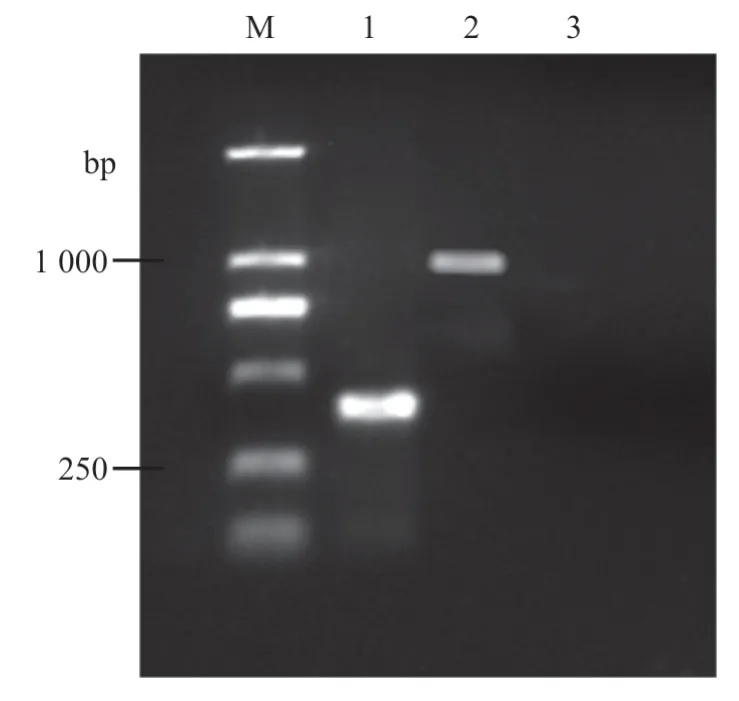
图1 常规PCR 检测结果
2.2 双重PCR 模板与引物比例优化
将模板与引物,按照不同比例进行PCR 反应,并在1%琼脂糖凝胶进行电泳。由图2 可知,模板GTPV 与PPRV 之间最适比例为4:1,引物最适比例为17:3。
2.3 双重PCR 特异性检测
按照双重PCR 优化条件,将含有GTPV 和PPRV 核酸样品的混合物以及GTPV、PPRV、ORFV、BVDV 进行特异性检测,经1%琼脂糖凝胶电泳扩增出与预期目标相符的969 bp 和385 bp目的片段,而其他病原未出现条带(图3)。
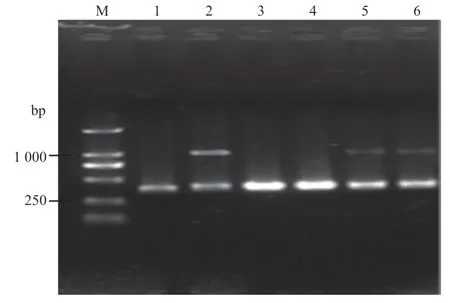
图2 模板与引物条件优化结果
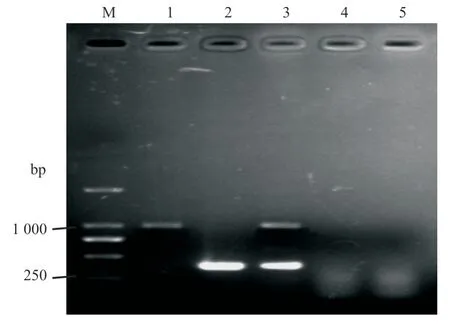
图3 特异性检测结果
2.4 双重PCR 敏感性检测
用超微量分光光度计测得的GTPV DNA 浓度为28.3 ng/μL,PPRV cDNA 浓度为645.9 ng/μL。条件优化后,对GTPV DNA 与PPRV 反转录产物混合后,作10 倍系列稀释,结果发现,GTPV 的最低检出量为0.283 ng/μL,PPRV 的最低检出量为6.459 ng/μL(图4)。
3 讨论
羊痘初期可能只是个别发病,但其流行非常快,后期会很快诱发全群感染[3]。我国山羊痘和绵羊痘疫情主要发生于新疆、甘肃、宁夏、青海、陕西、福建、贵州等地,对我国养羊业的健康发展影响严重。伴随着国际贸易日益频繁,该病在近年来流行范围有逐步扩大的趋势[4]。为降低羊痘带来的巨大经济损失和公共卫生安全问题,建立一种快速、高效、准确、操作方便、成本低的检测方法具有重要意义。
近年来,小反刍兽疫发生也呈上升趋势,在多个国家和地区不断蔓延。2007 年小反刍兽疫首次传入我国西藏地区。此后,国内其他地方陆续报道发现该病。因此,掌握 PPRV 快速准确的检测技术,对了解该病的国内流行状态和对该病的防治工作有重大意义[5]。
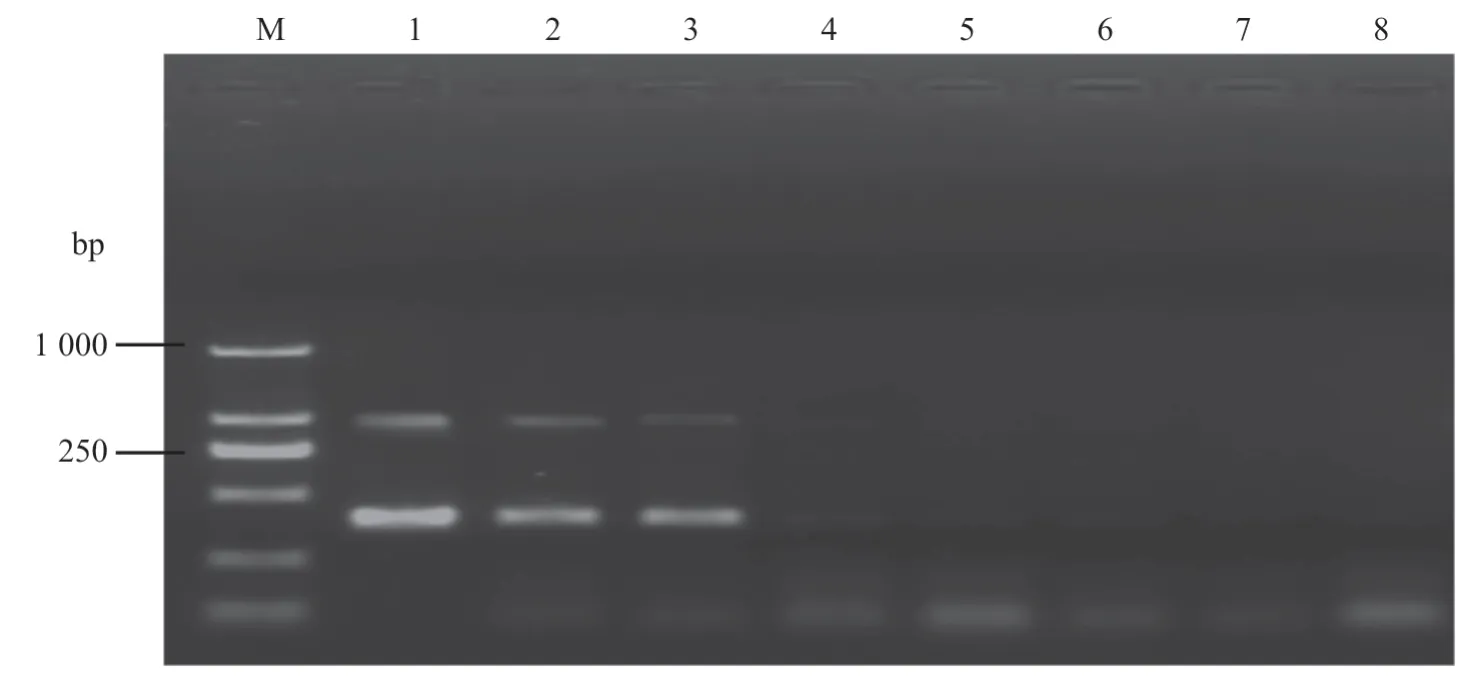
图4 敏感性检测结果
目前,对于临床症状相似的病毒性疾病,如羊痘和小反刍兽疫,仅通过简单的临床检查很难作出准确判断,有可能导致误诊,从而影响最佳防治时间。因此,在这种情况下,通过PCR 技术可以准确确诊疫情。多重PCR 技术是在传统PCR技术基础上进行优化改进的一种新技术,比传统PCR 技术具有更高效、更经济方便等优点。在一个多重PCR 反应体系中,影响检测结果的主要因素是不同基因的引物浓度、退火温度、底物浓度是否达到平衡。在建立多重PCR 反应体系时,需要不断优化多重PCR 不同基因的引物浓度,因为不同基因引物的浓度搭配会影响相应基因的扩增量。调整体系中各种引物比例,可增加难扩增基因的引物量,减少易扩增基因的引物量[6]。本研究中就遇到了类似问题,需要对引物浓度和核酸模板浓度比例进行优化。因此,在研究中合理设计引物、优化最佳多重PCR 体系及反应条件,可增加其灵敏度和特异性,减少出现非特异性扩增、假阴性、假阳性概率[7]。研究人员可以在每次试验中设立严格的阴阳性对照,防止非特异性扩增,减少假阴性、假阳性对结果的影响。
在以后的试验中,将进一步开展所建立方法对临床样品检测应用研究,提高该方法的实用性。
4 结论
本研究在GTPV 和PPRV 常规PCR 的基础上,建立了双重PCR 的方法。通过敏感性和特异性试验,证实该方法可同时完成PPRV、GTPV 两种病原的检测,可用于疫病的临床鉴别与诊断。本研究建立的双重PCR 方法对于这两种疫病的临床检测与防控提供了有力技术支撑。

