环剥对灰枣果实中糖积累及蔗糖代谢相关酶活性的影响
杨 磊,樊丁宇,靳 娟,徐叶挺,周晓明,冯贝贝,郝 庆
(新疆农业科学院园艺作物研究所/农业部新疆地区果树科学观测实验站,乌鲁木齐 830091)
0 引 言
【研究意义】环剥即环状剥皮,是指将枝干的韧皮部剥去一圈。环剥会暂时阻断叶片合成的有机物向下运输,导致碳水化合物在环剥口以上积累[1],有助于提高坐果率[2],增加产量[3],改善果实品质[4]等。加之,环剥具有投资小、见效快、操作简单等优点,作为果树栽培管理中一项技术措施,在枣、苹果、梨、葡萄、柑橘等多种果树上已经得到了广泛应用[1]。随着新疆特色林果业发展步伐的加快,枣树以其耐干旱、耐贫瘠、耐盐碱,抗逆性强,适应性广,经济效益高,生态效益明显[5],近年在新疆迅速发展,截止2017年,新疆红枣种植面积为47.6×104hm2,产量达347.0×104吨,面积和产量均居全疆林果之首[6]。红枣已成为新疆林果业的支柱产业。灰枣作为南疆地区红枣主栽品种之一,在增加农民收入、改善生态环境等方面发挥了重要作用。在南疆灰枣栽培管理中,环剥是提高坐果率、增加产量的一项重要技术措施。【前人研究进展】环剥有利于增大冬枣的果形指数[7],提高冬枣坐果率、产量及果实的VC、总酸[8],提高可溶性固形物含量和总糖含量[7-9],也可提高枣果纵横径及单果质量,促使果实膨大[8]。【本研究切入点】灰枣作为干鲜兼用良种,环剥是否会提高其果实的含糖量,以及环剥如何影响灰枣果实中蔗糖的积累,目前还没有开展相关的研究。研究环剥后枣果实发育过程中糖分含量的变化与蔗糖代谢相关酶活性之间的关系。【拟解决的关键问题】研究对环剥灰枣果实发育过程中糖分组成、含量和影响果实发育过程中蔗糖代谢关键酶的活性进行研究,分析环剥与灰枣果实发育过程中蔗糖积累之间的关系,为改善灰枣果实品质提供理论依据。
1 材料与方法
1.1 材 料
2015年5月中旬,以叶城县农业部新疆地区果树科学观测试验站红枣栽培试验园内5a生灰枣为材料,选择生长发育良好、长势、花期一致的20株为试验树,挂牌标记。
1.2 方 法
1.2.1 环剥处理
于6月12日灰枣盛花期进行环剥处理。主干环剥高度距离地面30 cm,环剥宽度为主干直径的1/10。环剥后立即用5%辛硫磷500倍液对剥口及周围进行涂抹,涂药后用透明宽胶带进行包裹,以预防灰暗斑螟的发生。10株主干环剥,10株不环剥作对照。
1.2.2 样品采集
环剥后10 d开始采样,每隔15 d采样一次,至果实全红后结束取样。每次取样分别从试验树的东、南、西、北四个方向选取大小一致的果实不少于30颗,蒸馏水清洗果面,所采的同一处理的样品混合装袋、标记,液氮保存。采样结束后将液氮罐带回乌鲁木齐,样品保存于-80℃超低温冰箱备用。
1.2.3 糖提取和测定
取保存于超低温冰箱内的果实样品,去除果皮和果核,称取20个果的混合样,液氮中研磨3~5 min,加提取液(乙醇∶氯仿∶水=12∶5∶3)再匀浆3~5 min,5 000 g离心15 min,取上清液,重复3次。合并提取液,转入分液漏斗,加水使之分层,5 000 g离心10 min去除氯仿层,用0.1 mol/L NaOH调pH值至7.0,在40℃真空中干燥,蒸馏水定容,用高效液相色谱测定糖的含量。色谱条件为:流动相(乙腈/重蒸水=70/30,v/v)流速1mL/min,碳水化合物柱,柱温25℃,156示差检测器,System Gold Software控制及数据处理系统。
1.2.4 酶提取
酶的提取在0~4℃条件下进行。称取样品,液氮中研磨5~10 min,加提取缓冲液(200 mmo/L磷酸钾缓冲液,5 mmol/LMgCl2,0.1%β-巯基乙醇,0.05% Triton-X 100,0.05% BSA,2%PVPP,pH7.5)再匀浆3~5 min,20 000 g离心30 min,取上清液逐渐加(NH4)2SO4至80%饱和度,放置30 min,20 000 g离心20 min,去除上清液,加脱盐缓冲液(20 mmol/L磷酸钾缓冲液,0.25 mmol/L MgCl2,0.01%β-巯基乙醇,0.05% BSA,pH 7.5)重新溶解沉淀,按照Helmerhorst等的方法用Sephadex G-25柱离心脱盐,脱盐后的酶提取液用于酶活性分析。
SPS和SS的提取与转化酶相似,只是提取缓冲液为200 mmol/L Hepes-NaOH (含5 mmol/LMgCl2,0.1%β-巯基乙醇,0.05% Triton-X 100,0.05% BSA,2% PVPP,1 mmol/L EDTA,1 mmol/L EGTA,10 mmol/L 抗坏血酸钠,10 mmol/L半胱氨酸-盐酸和2%甘油,pH 7.5);脱盐缓冲液为20 mmol/L Hepes-NaOH (含0.25 mmol/L MgCl2,1 mmol/L EDTA,1 mmol/L EGTA,0.01%B-巯基乙醇,0.05% BSA,0.2%甘油,pH 7.5)。
1.2.5 酶活性测定
AI活性测定。在反应体系中含80 mmol/L醋酸-磷酸钾(pH 4.5),100 mmol/L蔗糖,酶提取液;37℃反应30 min,加入490 μL DNS试剂终止反应,沸水浴5 min,冷却后测定A540。用杀死的酶液作对照。NI活性测定方法与AI类似,只是醋酸-磷酸钾缓冲液的pH为7.5。
SPS活性测定。在70 μL反应体系中含50 mmol/L Hepes-NaOH缓冲液(pH7.5),15 mmol/L MgCl2,1 mmol/L EDTA,5 mmol/L NaF,16 mmol/L UDP-Glucose,4 mmol/L Fru 6-P,20 mmol/L Glc 6-P,酶提取液;30℃反应30 min,加入70 μL 5mol/L NaOH终止反应,沸水浴10 min,冷却后加入1 mL 0.14%的蒽酮(溶解在13.8 mol/L的H2SO4中),40℃反应20 min,测定A620。对照反应体系中不含Fru 6-P和Glc 6-P。
SS合成方向的活性测定。在70 μL反应体系中含80 mmol/L Hepes-NaOH缓冲液(pH8.5),5 mmol/L KCN,5 mmol/L NaF,100 mmol/L果糖,15 mmol/L UDP-Glucose,酶提取液;30℃反应30 min,加入70 μL 5 mol/L NaOH终止反应,沸水浴10 min,冷却后加入1 mL 0.14%的蒽酮(溶解在13.8 mol/L的H2SO4中), 40℃反应20 min,冷却后测定A620。对照反应体系中不含果糖。
SS分解方向的活性测定。在490 μL反应体系中含80 mmol/L Mes缓冲液(pH 5.5),5 mmol/L NaF,100 mmol/L蔗糖,5mmol/L UDP,酶提取液;30℃反应30 min,加入490 μL DNS试剂终止反应,沸水浴5 min,冷却后测定A540。对照反应体系中不含UDP。

图1 环剥下果实发育过程中果糖、葡萄糖、蔗糖含量变化
Fig.1 Effects of Girdling on the Contents of Fructose, Glucose and Sucrose during Fruit Development
2 结果与分析
2.1 环剥对果实发育过程中蔗糖代谢相关糖分含量的影响
环剥处理和对照的灰枣果实在整个发育过程中,果糖、葡萄糖和蔗糖3种可溶性糖的含量变化基本一致,3种可溶性糖的积累随着果实的发育总体呈上升趋势。其中,果糖和葡萄糖含量在9月15日(果实全红期)前呈逐渐升高的趋势,进入果实全红期后缓慢下降;蔗糖在7月30日(幼果膨大期)前未检测到,7月30日至8月15日(果实白熟期)蔗糖缓慢积累,8月30日(果实转红期)后蔗糖快速积累,果实进入全红期后蔗糖积累又趋于缓慢,至10月15日果实成熟,环剥和对照果实中蔗糖含量均超过163 mg/g,远高于果糖和葡萄糖的含量,蔗糖和还原糖的比值为1.2∶1,灰枣果实以积累蔗糖为主。实验过程中随着果实的发育,环剥处理果实3种糖的含量总体高于同期对照果实的含量,说明环剥有利于灰枣果实果糖、葡萄糖和蔗糖的积累。图1
2.2 环剥对果实发育过程中蔗糖代谢相关酶活性的影响
环剥和对照的果实在整个发育过程中酸性转化酶(AI)、中性转化酶(NI)、蔗糖磷酸合成酶(SPS)和蔗糖合成酶(SS)活性变化趋势相似。其中,AI先快速上升,后缓慢降低;NI从幼果膨大期至果实成熟总体呈缓慢上升趋势;SPS先缓慢上升,后快速下降;SS从幼果膨大期至8月30日(果实转红期)基本保持不变,9月15日(果实全红期)迅速升高,之后快速下降。
果实中性转化酶(NI)活性在8月15日(果实白熟期)之前对照略高于环剥处理,之后环剥果实NI活性开始逐渐上升并高于对照,至9月15日(果实全红期)一直高于对照,之后环剥处理和对照均略有下降,并保持一致且平稳水平。图2
果实酸性转化酶(AI)活性在8月15日(果实白熟期)之前环剥处理和对照均快速上升,但环剥处理的AI活性明显高于对照;之后二者又逐渐下降,其中环剥处理降幅大于对照,至9月15日(果实全红期)对照的AI活性略有升高后继续降低,至10月15日果实成熟二者达到相同水平。
环剥处理的灰枣果实SPS活性在7月15日(幼果膨大期)之前缓慢上升,7月30日明显下降,之后至9月15日(果实全红期)处于快速上升阶段,9月15日之后又快速下降;对照果实SPS活性在8月15日(果实白熟期)之前均缓慢上升,之后至9月25日处于快速上升阶段,9月25日之后快速下降;环剥处理和对照果实SPS活性在9月25日至10月15日果实全红阶段处于同等下降水平。
环剥和对照的果实在整个生长过程中SS合成方向(SSs)和SS分解方向(SSd)的活性变化基本一致。其中SSd活性一直处于缓慢下降的趋势,但环剥SSd活性在7月30日(果实膨大期)之前高于对照,之后二者处于接近水平。SSs活性在8月30日(果实转红期)之前一直处于平稳水平,之后快速上升,并在9月15日(果实全红期)达到最大值后又快速下降,至9月25日下降趋势开始明显减缓,至10月15日果实成熟呈缓慢降低趋势,但在9月15日(果实全红期)至10月15日果实成熟,环剥处理果实的SSs活性显著高于对照,这是环剥处理果实蔗糖含量高与对照的主要原因。图2
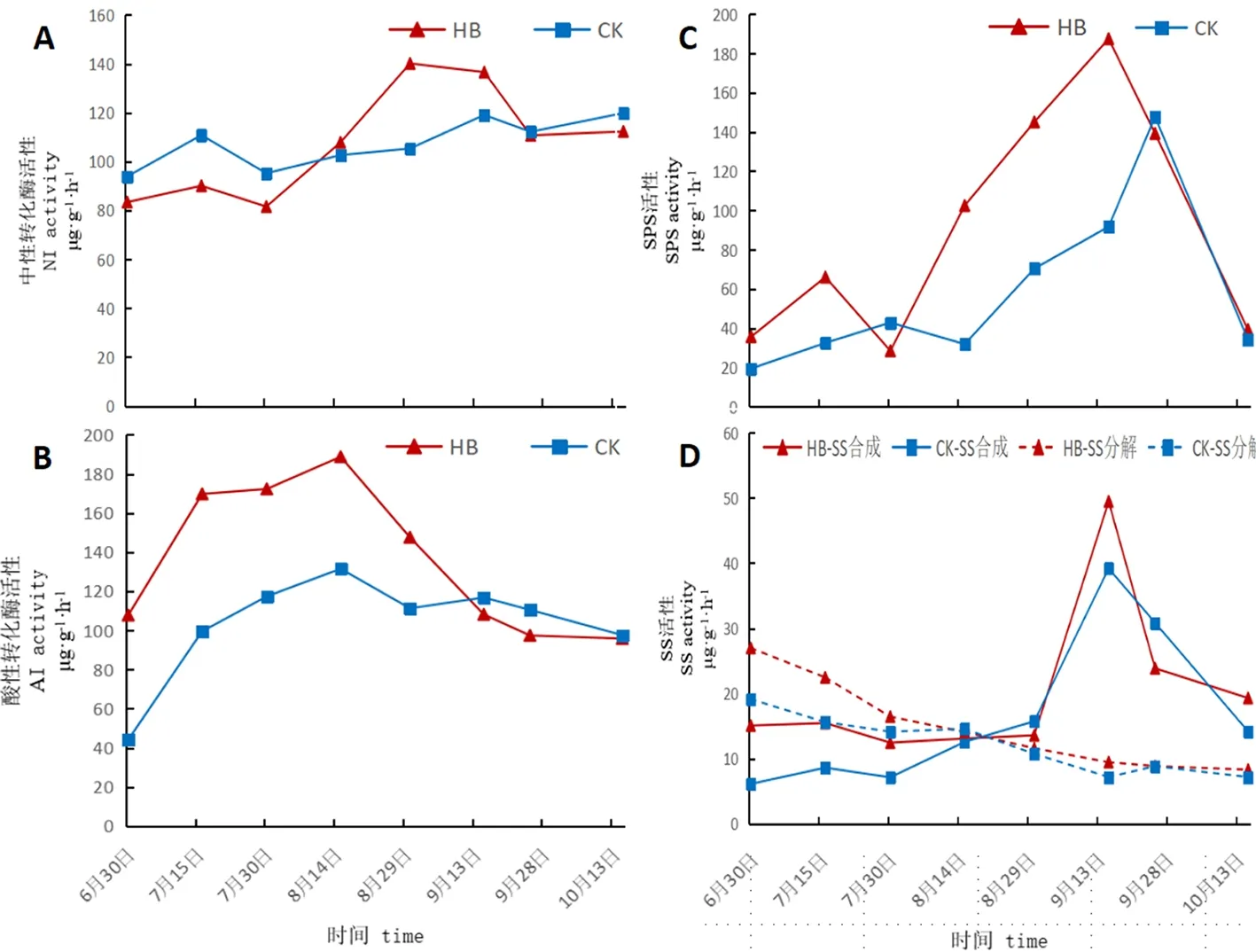
图2 环剥下果实发育期中性转化酶、酸性转化酶、蔗糖磷酸合成酶和蔗糖合成酶活性变化
Fig.2 Effects of Girdling on activities of Al, NI, SPS, SS(SSs,SSd) during Fruit Development
2.3 环剥处理枣果实糖积累与蔗糖代谢相关酶活性的相关性
在环剥口愈之前,环剥处理果实的果糖与AI活性呈显著正相关(0.998*),总糖与SS合成方向活性呈显著负相关(-0.997*);对照的总糖与AI活性呈显著负相关(-0.999*)。表1
8月15日果实白熟期,环剥处理的果糖与NI活性呈极显著正相关(1.000**),对照的总糖与NI活性呈显著正相关(0.998*)。9月15日果实全红期,环剥处理的果糖与NI活性呈显著正相关(0.998*),对照的蔗糖与SPS活性呈显著负相关(-0.998*)。10月15日果实成熟期,环剥处理的总糖与SS合成方向活性呈显著正相关(0.998*),对照的葡萄糖与SPS和SS合成方向活性呈显著正相关(0.999*),蔗糖和总糖与SS合成方向活性呈显著正相关(0.999*)。环剥处理影响了灰枣果实发育过程中蔗糖代谢相关酶的活性,进而影响果实糖分的代谢和积累。成熟期果实葡萄糖的积累受SPS和SS-s的影响较大,蔗糖的积累与SS-s密切相关。
3 讨 论
目前的研究普遍认为,环剥主要是阻断了韧皮部的运输,阻止光合作用制造的有机物向根部运输[10]。利用14C追踪技术研究表明,环剥完全阻断了荔枝叶片合成的光合产物通过主干向根系的运输,有利于光合产物在地上部的累积[11]。环剥中断葡萄韧皮部运输途径,中断碳素营养向下运输,使光合产物集中供应环剥口上部[12]。在果实生长第二期环剥可显著地增大早熟油桃单果重,提高等级果率,增加果实内可溶性固形物的含量[13]。环剥不但可提高椪柑叶片糖和淀粉含量,而且可提高果实的可溶性固形物含量,改善果实的品质,其中一个主要的原因就是环剥阻碍光合产物等通过韧皮部向下运输,使光合产物在椪柑叶片内积累是导致叶片淀粉和糖含量增加[14]。环剥处理可显著提高荔枝果实中可溶性糖含量,果实蔗糖含量[15]。以枣为材料的环剥研究主要集中在冬枣上。在盛花期进行主干环剥及主枝环割可明显提高冬枣坐果率、产量及果实的VC、总酸、总糖和可溶性固形物含量;而在盛花后期进行环剥与环割,可提高枣果纵横径及单果质量,促使果实膨大[8]。对环剥宽度与果实品质关系的研究表明,环剥宽度1.2 cm的冬枣果实在含糖量和可溶性蛋白含量方面显著高于其它处理和对照[9]。环剥明显提高了灰枣果实果糖、葡萄糖和果实发育后期的蔗糖含量,环剥有利于果实果糖、葡萄糖和蔗糖的积累。果实成熟期蔗糖高于果糖和葡萄糖的含量,蔗糖和还原糖的比值为1.2∶1,灰枣果实以积累蔗糖为主,这与灵武长枣的研究结果一致[16]。
表1 环剥处理枣果实糖积累与蔗糖代谢酶活性的相关性
Table 1 Relation between sugar accumulation and sucrose-metabolizing enzymes in fruitsbefore Girdling healing
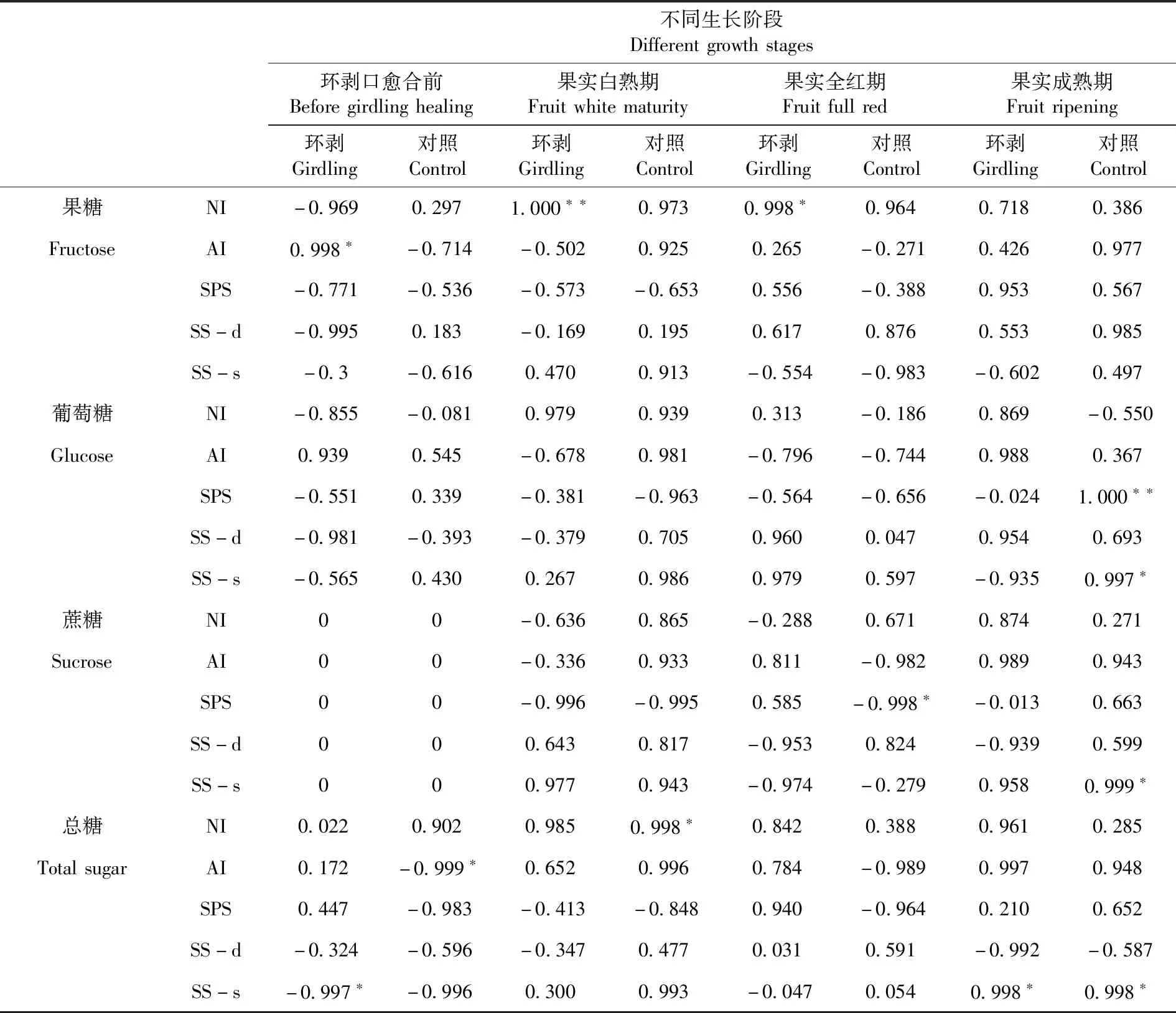
不同生长阶段Differentgrowthstages环剥口愈合前Beforegirdlinghealing果实白熟期Fruitwhitematurity果实全红期Fruitfullred果实成熟期Fruitripening环剥Girdling对照Control环剥Girdling对照Control环剥Girdling对照Control环剥Girdling对照Control果糖NI-0.9690.2971.000∗∗0.9730.998∗0.9640.7180.386FructoseAI0.998∗-0.714-0.5020.9250.265-0.2710.4260.977SPS-0.771-0.536-0.573-0.6530.556-0.3880.9530.567SS-d-0.9950.183-0.1690.1950.6170.8760.5530.985SS-s-0.3-0.6160.4700.913-0.554-0.983-0.6020.497葡萄糖NI-0.855-0.0810.9790.9390.313-0.1860.869-0.550GlucoseAI0.9390.545-0.6780.981-0.796-0.7440.9880.367SPS-0.5510.339-0.381-0.963-0.564-0.656-0.0241.000∗∗SS-d-0.981-0.393-0.3790.7050.9600.0470.9540.693SS-s-0.5650.4300.2670.9860.9790.597-0.9350.997∗蔗糖NI00-0.6360.865-0.2880.6710.8740.271SucroseAI00-0.3360.9330.811-0.9820.9890.943SPS00-0.996-0.9950.585-0.998∗-0.0130.663SS-d000.6430.817-0.9530.824-0.9390.599SS-s000.9770.943-0.974-0.2790.9580.999∗总糖NI0.0220.9020.9850.998∗0.8420.3880.9610.285TotalsugarAI0.172-0.999∗0.6520.9960.784-0.9890.9970.948SPS0.447-0.983-0.413-0.8480.940-0.9640.2100.652SS-d-0.324-0.596-0.3470.4770.0310.591-0.992-0.587SS-s-0.997∗-0.9960.3000.993-0.0470.0540.998∗0.998∗
注:**.在0.01水平(双侧)上显著相关;*.在0.05水平(双侧)上显著相关
Note:**.Correlation is significant at the level 0.01(2-tailed);*.correlation is significant at the level 0.05(2-tailed)
关于环剥与果实内相关酶的关系方面前人的研究已取得一定成果。环剥可显著抑制红富士苹果果实的发育,极显著提高淀粉酶活性,降低酸性转化酶活性;而对中性转化酶、蔗糖合酶和蔗糖磷酸合酶活性无显著影响[17]。对着生一个果实的苹果茎或短枝进行完全摘叶和环剥韧皮部(D/G)处理,结果导致处理果实的山梨醇脱氢酶(SDH)活力、山梨醇含量和淀粉含量的下降。再将经D/G处理果实的皮层组织培养在200 mmol/L的山梨醇或葡萄糖缓冲液中,重新获得了失去的SDH活力,而对照果实皮层组织培养在上述缓冲液中时,SDH活力保持不变。说明苹果果实的SDH活力受摘叶、环剥等影响碳水化合物供给的措施调节,特异的碳水化合物如山梨醇或葡萄糖可能是调节SDH活力的信号分子[18]。调控灵武长枣果实内蔗糖代谢的关键酶为蔗糖磷酸合成酶和蔗糖合成酶,尤其是蔗糖合成酶合成方向SSs 在‘灵武长枣’果实的糖代谢中起主要的调控作用[16]。研究中在全红期至成熟阶段环剥处理果实SSs活性的显著高于对照,说明SSs对提高果实蔗糖含量具有重要贡献。而果实遮光处理会增加灵武长枣果实中蔗糖合成酶分解方向的活性,而降低了其蔗糖合成酶合成方向酶的活性[19]。这从另一个方面也反证了SSs 与蔗糖积累的重要性。这可能暗示SSs 是以蔗糖积累为主的枣果实中调控蔗糖积累的主要酶。鉴于SSs 可能在以蔗糖积累为主的枣果实中蔗糖积累的重要性,在今后有必要针对SSs 与蔗糖积累的关系开展进一步的研究。
另外,有研究表明环剥会影响叶片内部相关酶的活性。环剥能降低毛叶枣叶片硝酸还原酶、谷氨酰胺合成酶、谷氨酸合成酶的活性,导致叶片总N含量降低,使叶片可溶性总糖、蔗糖和淀粉含量增加[20]。而果实内的糖有是由叶片合成的光合产物通过韧皮部运输进入果实积累而来[21]。据此推测,环剥对叶片内部相关酶活性的影响,也会间接影响果实内糖的积累。这有待于进一步研究。
4 结 论
环剥处理和对照的果实在整个发育过程中,果糖、葡萄糖和蔗糖3种可溶性糖的含量变化基本一致,其积累随着果实的发育总体呈上升趋势。环剥处理果实3种糖的含量总体高于同期对照果实的含量,说明环剥有利于灰枣果实果糖、葡萄糖和蔗糖的积累。其中,果糖和葡萄糖含量在9月15日(果实全红期)前呈逐渐升高的趋势,进入全红期后缓慢下降;果实进入转色期蔗糖开始缓慢积累,果实白熟期蔗糖快速积累,果实进入全红期后蔗糖积累又趋于缓慢,至果实成熟时环剥和对照果实中蔗糖含量均超过163 mg/g,远高于果糖和葡萄糖的含量,蔗糖和还原糖的比值为1.2∶1,灰枣果实以积累蔗糖为主。
环剥有助于提高环剥口愈合前果实内中性转化酶、蔗糖磷酸合成酶、蔗糖合成酶的活性,同时宜有助于提高白熟期至成熟期间果实内蔗糖磷酸合成酶和蔗糖合成酶合成方向的活性,而降低果实转色期之后酸性转化酶活性。由此说明,环剥影响了果实发育过程中蔗糖代谢相关酶的活性,进而影响果实糖分的代谢和积累。其中,果实全红期至实成熟,环剥处理果实的蔗糖合成酶合成方向活性显著高于对照,是环剥处理果实蔗糖含量高与对照的主要原因。

