抗菌肽Jelleine-I对采后柑橘果实绿霉病的控制作用
李心丹,王文军,邓丽莉,2,姚世响,2,曾凯芳,2,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学食品贮藏与物流研究中心,重庆 400715)
柑橘属芸香科(Rutaceae)柑橘亚科(Aurantioideac)柑橘属(Citrus)柑橘亚族(Citrinae)果树,主要集中分布在中国、美国等地区[1]。因柑橘果实柔嫩多汁,富含丰富的糖类、酸类、VC以及矿质元素和多种苷类物质,营养价值高,而深受消费者喜爱[2-3]。我国柑橘以鲜销为主,在旺季时需大量贮藏,而采摘后的柑橘果实在贮藏过程中易受病原菌侵染而发生大量腐烂现象,造成巨大的经济损失[4]。其中由指状青霉(Penicillium digitatum)引起的绿霉病是柑橘贮藏期主要病害之一[5]。在现有柑橘类果实侵染性病害防治方法中,化学杀菌剂的使用是最普遍也是最有效的,如苯并咪唑类杀菌剂的代表品种多菌灵以及咪唑类杀菌剂的代表品种咪鲜胺[6]。但化学杀菌剂的长期使用使环境及人体健康受到了潜在的威胁,且使病原微生物对其产生抗性,因而化学杀菌剂的使用逐渐受到限制[7]。研究者们开始致力于寻找对人体健康无害的方式和物质来代替或减少化学杀菌剂的大剂量使用。
抗菌肽是由基因编码、核糖体合成的能够抵御外界病原菌的多肽,广泛存在于各种生物体内,具有广谱抑菌性[8-9]。抗菌肽可通过与病原微生物的细胞膜、细胞壁或胞内靶点物质作用加速病原菌死亡[10-11]。抗菌肽作用机制的特殊性使病原菌不易对其产生抗性。近年来,抗菌肽的高效抑菌性使其在医药业、农业、食品工业及畜牧业受到越来越多的关注[12-13]。在果蔬采后病害控制方面,研究者通过直接提取、化学合成以及利用微生物表达等方式获取抗菌肽,利用抗菌肽对病原菌的抑制作用控制果蔬采后病害的发生[14-19]。其中,阳离子短链抗菌肽由于较低的合成成本及优良的抗菌性能备受研究者关注。抗菌肽Jelleine-I(PFKLSLHL-NH2)是一种从蜜蜂(Apis mellifera)的蜂王浆中分离得到的阳离子短链抗菌肽,对细菌和酵母具有独特的抑菌活性[20-22]。但有关抗菌肽Jelleine-I控制果蔬采后病害的研究报道尚少,也鲜见将抗菌肽Jelleine-I应用于柑橘果实采后病害控制的相关研究报道。本研究旨在探究抗菌肽Jelleine-I对引起柑橘果实绿霉病的病原菌P. digitatum生长的影响及可能的作用机理,并评价抗菌肽Jelleine-I对柑橘果实采后绿霉病的控制效果,从而拓宽抗菌肽Jelleine-I的应用范围,为控制柑橘果实采后病害提供新的思路和方法。
1 材料与方法
1.1 材料与试剂
使用固相合成方法于南京金斯瑞公司合成纯度大于90%的抗菌肽Jelleine-I,贮藏于-40 ℃冰箱中,使用前先用无菌水配成1 mmol/L的母液,然后稀释至所需浓度。
指状青霉(P. digitatum)分离于发病丰脐果实,并通过分子生物学方法鉴定。用马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)于25 ℃培养病原菌,7 d后收集孢子并用无菌水调至所需浓度[23]。
实验所用柑橘品种为丰脐(Citrus Sinensic (L.)Osbeck),11月下旬采摘于重庆市北碚区冯家槽果园。果实(可溶性固形物质量分数为10.1%,可滴定酸质量分数为0.96%)采收后立即运回实验室,挑选成熟度一致、大小均一、无机械伤、无病虫害的健康果实作为实验材料。
SYTOX Green(SG)荧光染色试剂 美国Invitrogen公司;Calcofluor White(CFW)荧光染色试剂美国Sigma Aldrich公司。
1.2 仪器与设备
BXM30R立式高压灭菌锅 上海博迅实业有限公司医疗设备厂;SW-CJ-1F超净工作台 苏净集团安泰有限公司;DHP-9082电热恒温培养箱 上海齐欣科学仪器有限公司;B203生物显微镜 重庆奥特光学仪器有限公司;SYNERGYH1MG全自动酶标仪 美国BioTek公司;TS100荧光显微镜 北京长恒荣创科技有限公司;AvantiTMJ-30I高速冷冻离心机 美国Beckman公司;DDS-307A电导率仪 上海仪电科学仪器股份有限公司。
1.3 方法
1.3.1 抗菌肽Jelleine-I对P. digitatum的离体抑菌作用
实验参照Jia Fengjing等[21]的方法并进行一定的修改。用无菌的96 孔微量板进行实验,将180 μL 1×104CFU/mL P. digitatum孢子悬浮液(含体积分数5%马铃薯葡萄糖液体培养基(potato dextrose broth,PDB))、20 μL抗菌肽Jelleine-I,混合后立即加入96 孔板中,抗菌肽Jelleine-I的终浓度分别为3.12、6.25、12.5、25、50、100 μmol/L。设无菌水为对照,置于25 ℃恒温培养箱中培养,48 h时用酶标仪测定其OD600nm。以48 h时依旧能完全抑制病原菌生长的最低浓度作为最低抑菌浓度(minimum inhibitory concentration,MIC)。并从未见菌丝生长的孔中吸取50 μL液体涂布在PDA培养基上,于25 ℃继续培养48 h,以无任何菌落形成的最低浓度为最低杀菌浓度(minimum fungicidal concentration,MFC)。
1.3.2 同孔损伤接种抗菌肽Jelleine-I对柑橘果实绿霉病的控制效果
实验参照Zhou Yahan等[24]的方法并进行一定的修改。柑橘果实随机分组,每组15 个果实,以体积分数2%的次氯酸钠溶液浸泡2 min后用自来水清洗以除去表面残留污物,果实表面赤道部位用体积分数75%乙醇溶液擦拭消毒后,用灭菌打孔器在果实赤道部位等距打2 个孔(深3 mm、直径4 mm)。每孔接种10 μL新鲜孢子悬浮液(1×104CFU/mL),4 h后,每孔接种10 μL抗菌肽溶液(12.5、100 μmol/L)或无菌水(对照组)。待液体完全吸收后,用聚乙烯薄膜袋(170 mm×140 mm)将果实单果包装,置于25 ℃、相对湿度90%~95%的环境中贮藏,每天统计发病率并测量病斑直径。
1.3.3 抗菌肽Jelleine-I对P. digitatum菌丝体细胞膜透性影响的测定
实验参考Puig等[25]的方法并进行一定的调整。用体积分数5% PDB配制1×104CFU/mL的病原菌孢子悬浮液,取90 μL加入到无菌的1.5 mL离心管中,25 ℃下培养24 h。然后,加入10 μL抗菌肽溶液,使抗菌肽Jelleine-I终浓度达到0、6.25、12.5、100 μmol/L,无菌水为对照,继续培养2 h。培养完成后,加入4 μmol/L的SG贮备溶液,使其终浓度达到0.2 μmol/L,样品在暗环境下培养5 min;然后加入1 g/L CFW,使其终质量浓度达到50 μg/mL,样品继续在暗环境下培养5 min。最后,用纯水洗净菌丝,重悬于体积分数20%甘油溶液,制片并在荧光显微镜下观察。SG的荧光检测(激发波长设置为450~490 nm,发射波长为515~565 nm)选择FITC滤光片。CFW的荧光检测(激发波长为395 nm,发射波长为440 nm)选择DAPI滤光片。
1.3.4 抗菌肽Jelleine-I对P. digitatum胞外电导率影响的测定
采用微型电导仪测定抗菌肽Jelleine-I对指状青霉胞外电导率的影响。实验参考Zhou Haien等[26]的方法并进行一定的修改。100 μL含有1×105CFU/mL病原菌孢子加入到20 mL PDB培养基中,25 ℃、160 r/min振荡培养48 h。4 000×g离心15 min,水洗3 次,收集菌丝体,重新悬浮于无菌水中。然后加入抗菌肽Jelleine-I溶液,使其终浓度分别为0、6.25、12.5、100 μmol/L。在处理0、0.5、1、2、3、6 h和9 h时测定胞外电导率,无菌水为对照。
1.3.5 抗菌肽Jelleine-I对P. digitatum菌丝体细胞成分释放的影响
采用全波长酶标仪测定抗菌肽Jelleine-I对指状青霉菌丝体胞内核酸物质释放的影响。实验参照Paul等[27]的方法并进行一定的修改。100 μL含有1×105CFU/mL病原菌孢子加入到20 mL PDB培养基中,25 ℃、160 r/min振荡培养48 h。然后4 000×g离心15 min,用磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.0)清洗3 次,收集菌丝体,重新悬浮于PBS(pH 7.0)中。然后加入抗菌肽Jelleine-I溶液,使其终浓度分别为0、6.25、12.5、100 μmol/L。在处理0、0.5、1、2、3、6、9 h时离心取上清液测定260 nm波长处的OD值,无菌水为对照。
1.3.6 抗菌肽Jelleine-I溶血性测试
实验参照Muñoz等[28]的方法并进行一定的修改。将从医院获得的健康成人新鲜血液放入含有肝素钠的离心管中混匀,1 000×g离心5 min,弃上清液,用0.1 mol/L PBS冲洗3 次,然后重悬于4 倍体积的PBS中即得到红细胞悬浮液。取10 μL浓度分别为12.5、25、50、100 μmol/L的抗菌肽Jelleine-I溶液与90 μL红细胞悬浮液混合后于37 ℃培养1 h,以0.1 mol/L PBS为阴性对照,体积分数0.1% Triton X-100为阳性对照,然后1 000×g离心5 min。转移上清液至无菌的96 孔微量板,用酶标仪测定OD540nm。按照下式计算溶血率。
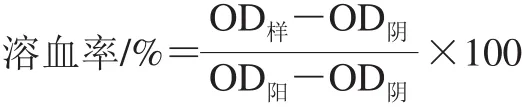
式中:OD样、OD阴、OD阳分别表示样品、阴性对照、阳性对照组的OD540nm。
1.4 数据统计与分析
所有实验重复3 次。所有数据用Excel 2013软件处理,运用Graph Pad Prism 5软件对实验数据进行分析并作图;用SPSS 21.0软件对数据进行方差分析,利用Duncan’s多重比较对差异显著性进行分析,P<0.05表示差异显著。
2 结果与分析
2.1 抗菌肽Jelleine-I对P. digitatum的离体抑菌作用
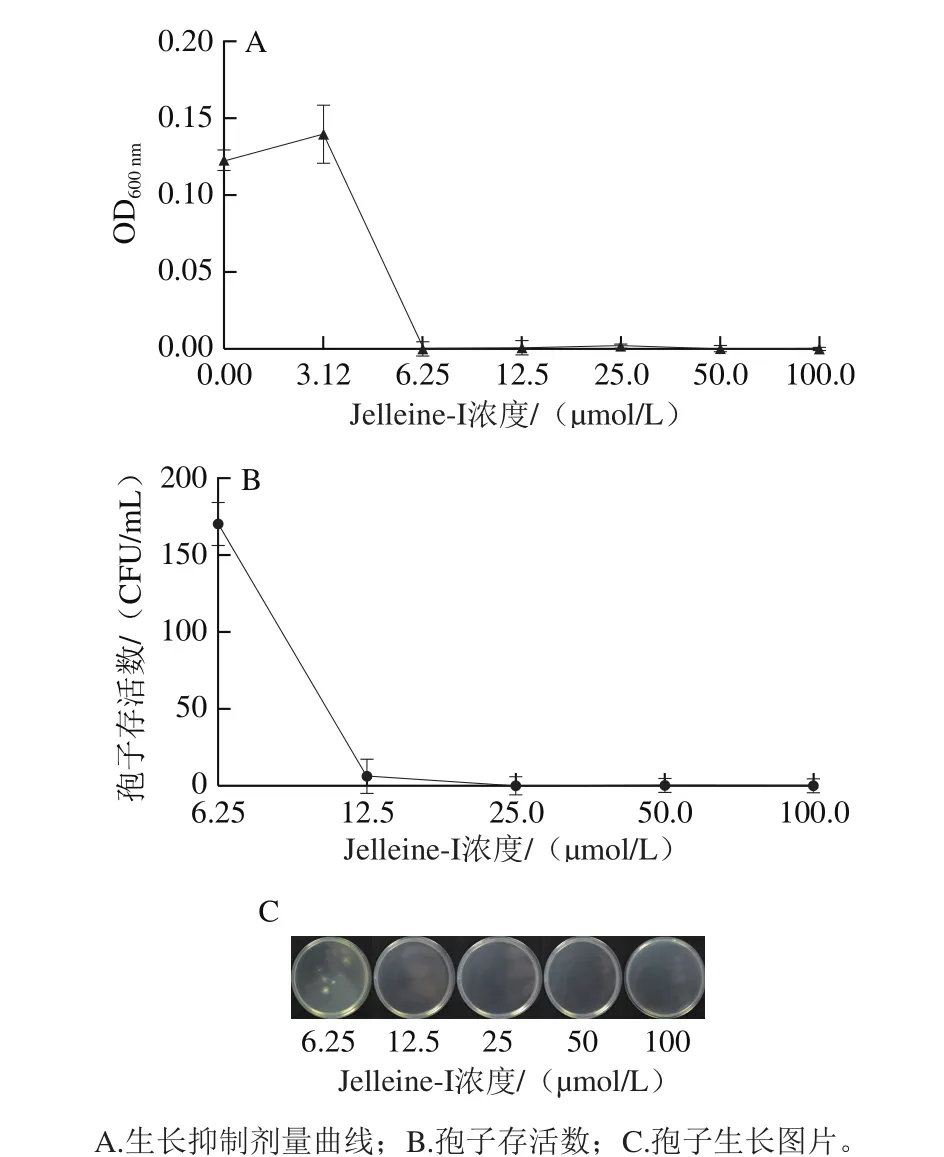
图1 抗菌肽Jelleine-I对P. digitatum的离体抑菌作用Fig. 1 Antifungal activity of peptide Jelleine-I against P. digitatum in vitro
由图1A可知,当抗菌肽Jelleine-I浓度高于3.12 μmol/L时,能抑制P. digitatum的生长,且浓度越高抑制作用越强。当抗菌肽Jelleine-I浓度为6.25 μmol/L时,P. digitatum的生长受到完全抑制,因此,抗菌肽Jelleine-I的MIC为6.25 μmol/L。由图1B、C可知,抗菌肽Jelleine-I浓度越大,对P. digitatum孢子的致死作用越显著,当抗菌肽Jelleine-I浓度达到12.5 μmol/L时,P. digitatum孢子几乎不会存活,因此,抗菌肽Jelleine-I的MFC为12.5 μmol/L。
2.2 抗菌肽Jelleine-I对柑橘果实绿霉病的控制效果
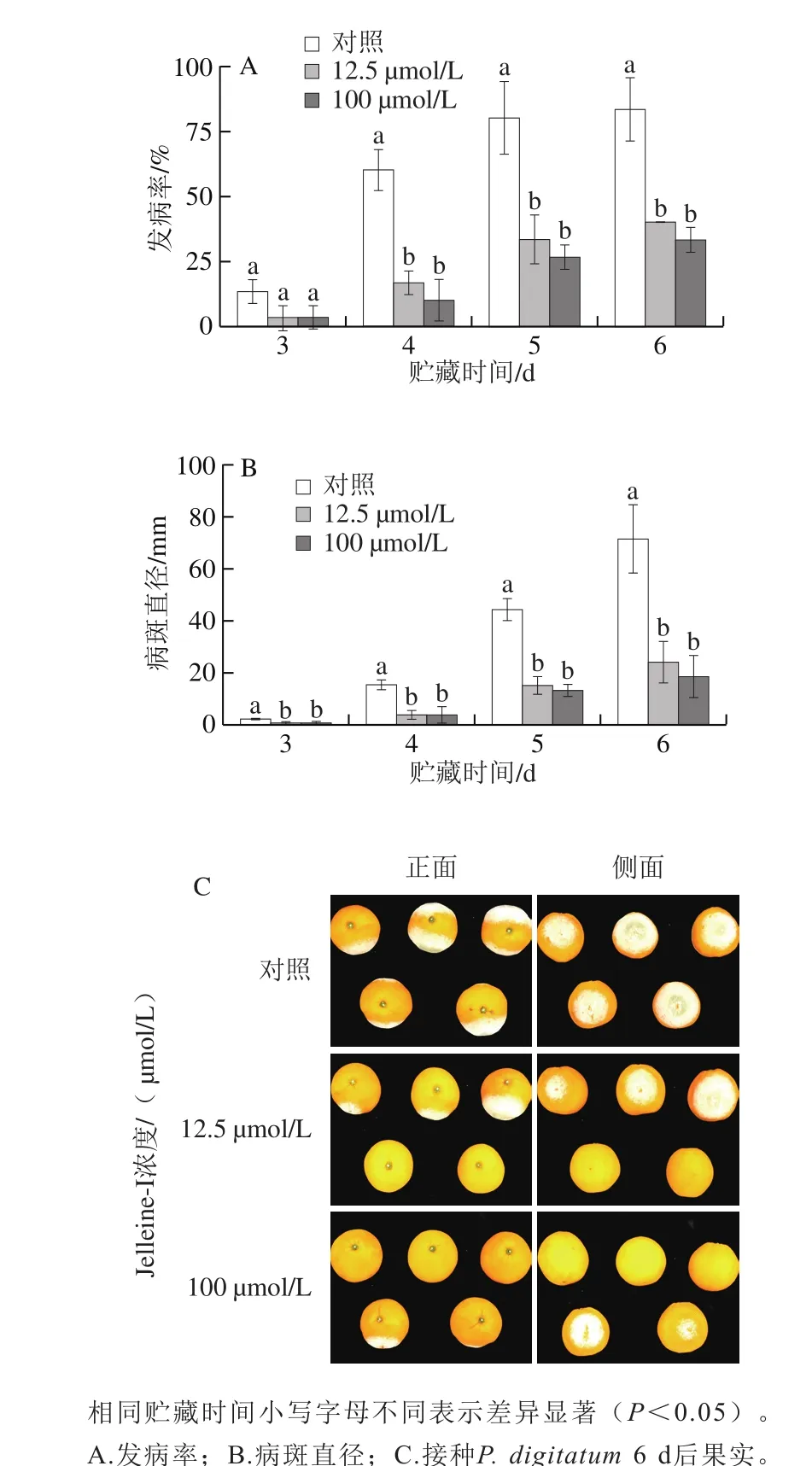
图2 抗菌肽Jelleine-I对柑橘采后绿霉病发病率和病斑直径的影响Fig. 2 Effect ofJelleine-I on green mold incidence and lesion diameter of citrus fruit
如图2所示,经同孔损伤接种P. digitatum的柑橘果实,在接种后的4~6 d内,抗菌肽Jelleine-I处理组的发病率显著低于对照组(P<0.05)。且在接种后的3~6 d内,抗菌肽Jelleine-I处理组的病斑直径也显著低于对照组(P<0.05)。两个不同浓度(100、12.5 μmol/L)的抗菌肽Jelleine-I处理组之间在接种后3~6 d内发病率和病斑直径均无显著性差异(P>0.05)。
2.3 抗菌肽Jelleine-I对P. digitatum菌丝体细胞膜的影响

图3 抗菌肽Jelleine-I对P. digitatum菌丝体细胞膜的影响Fig. 3 Effect of Jelleine-I on membrane permeability of P. digitatum
如图3所示,实验利用荧光显微镜观察抗菌肽Jelleine-I处理对P. digitatum的菌丝细胞膜通透性的影响。当细胞膜破坏后,SG荧光染色剂可以进入细胞内与核酸物质结合,并且呈现出大于未结合核酸物质时500 倍强度的绿色荧光。但当细胞膜通透性正常时,其不会进入细胞内。CFW染色剂可与真菌细胞壁成分几丁质、纤维素特异性结合,故由于细胞壁结构变化导致的几丁质异常积累可被观察到。实验结果表明,对照组P. digitatum的菌丝经SG和CFW染色后,不会出现明显的绿色SG荧光,且蓝色CFW荧光在细胞间明显较强,表明几丁质在细胞间积累正常。但是随着抗菌肽Jelleine-I处理浓度的增大,绿色SG荧光强度变得越来越强。经过6.25、12.5 μmol/L的抗菌肽Jelleine-I处理后,菌丝上出现较少量不连续的绿色SG荧光,蓝色CFW荧光贯穿整个菌丝,但在细胞间的蓝色CFW荧光减少。当抗菌肽Jelleine-I浓度为100 μmol/L时,菌丝上出现大面积连续的绿色SG荧光,以及贯穿整个菌丝的蓝色CFW荧光,但未出现细胞间的蓝色CFW荧光。
2.4 抗菌肽Jelleine-I对P. digitatum菌丝体胞外电导率的影响
如图4所示,随着处理时间的延长,对照组和3 个不同浓度抗菌肽Jelleine-I处理组的P. digitatum菌丝体胞外电导率都逐渐增大。3 个不同浓度抗菌肽Jelleine-I处理组的胞外电导率值均显著高于对照组(P<0.05)。且在处理时间内,100 μmol/L的电导率显著高于6.25 μmol/L处理组和12.5 μmol/L处理组(P<0.05),但6.25 μmol/L处理组和12.5 μmol/L处理组之间没有显著性差异(P>0.05)。在处理9 h后,各组胞外电导率达到最大,对照组和6.25、12.5、100 μmol/L 抗菌肽Jelleine-I处理组胞外电导率分别为94.8、174.25、158.3、329.67 μS/cm。
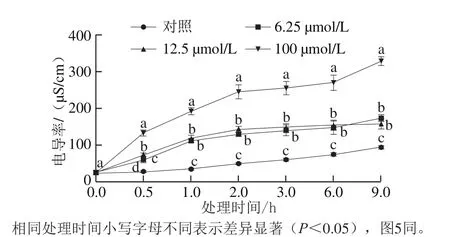
图4 抗菌肽Jelleine-I对P. digitatum菌丝体胞外电导率的影响Fig. 4 Effect of Jelleine-I treatment on extracellular conductivity of P. digitatum
2.5 抗菌肽Jelleine-I对P. digitatum菌丝体细胞成分释放的影响
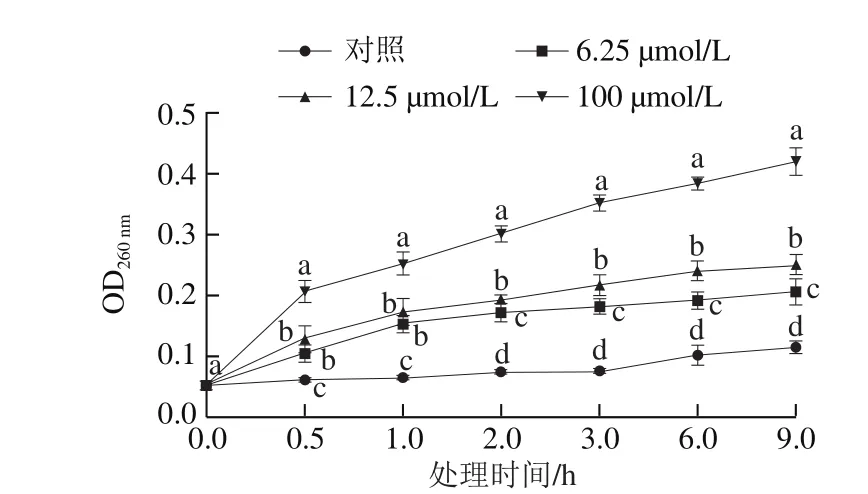
图5 抗菌肽Jelleine-I对P. digitatum菌丝体细胞成分释放的影响Fig. 5 Effect of Jelleine-I treatment on release of intracellular constituents from P. digitatum
P. digitatum菌丝体细胞外OD260nm能表征细胞内核酸物质的泄漏程度。如图5所示,随着处理时间的延长,抗菌肽Jelleine-I处理组的P. digitatum菌丝体胞外OD260nm明显增加,且显著高于相同处理时间的对照组(P<0.05)。处理0.5 h时,100 μmol/L抗菌肽 Jelleine-I处理组的OD260nm为0.21,显著高于12.5 μmol/L处理组(0.13)和6.25 μmol/L处理组(0.11)(P<0.05)。在处理前2 h内,6.25 μmol/L处理组和12.5 μmol/L处理组之间无显著性差异(P>0.05),在2~9 h内,两处理组间出现显著性差异(P<0.05)。
2.6 抗菌肽Jelleine-I溶血性检测结果
本实验中,以0.1 mol/L PBS作为阴性对照,其不会导致溶血现象;以0.1% Triton X-100作为阳性对照,其有极强的溶血性。如图6所示,各实验浓度抗菌肽Jelleine-I组的溶血率显著低于0.1% Triton X-100(P<0.05),各浓度抗菌肽Jelleine-I组之间无显著性差异(P>0.05)。当抗菌肽Jelleine-I浓度为12.5、25、50 μmol/L和100 μmol/L时,溶血率分别为0.33%、1.33%、3.34%和2.34%。
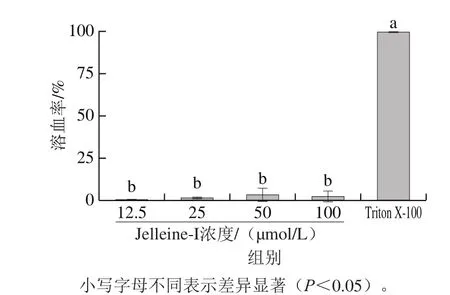
图6 抗菌肽Jelleine-I的溶血性Fig. 6 Hemolytic activity of peptide Jelleine-I
3 讨 论
前人研究认为,Jelleine-I对白色念珠菌(Candida albicans)、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)和铜绿假单胞菌(Pseudomonas aeruginosa)等微生物生长有抑菌作用[21-22]。本实验研究了在离体条件下抗菌肽Jelleine-I对P. digitatum生长的抑制情况,结果发现,抗菌肽Jelleine-I能显著抑制P. digitatum菌丝的生长,且对P. digitatum孢子有致死作用,其MIC和MFC分别为6.25、12.5 μmol/L。P. digitatum孢子易通过环境传播,侵染柑橘果实,导致其发病[29]。在体内条件下,研究了浓度为12.5、100 μmol/L的抗菌肽Jelleine-I对P. digitatum接种柑橘果实采后绿霉病发生的控制效果,结果发现Jelleine-I能有效控制柑橘果实采后绿霉病的发生,这与其在离体条件下两个浓度均能够将孢子完全杀死存在一致性。但12.5、100 μmol/L 抗菌肽Jelleine-I组之间差异不显著。
前人研究表明,抗菌肽作用于病原菌细胞时,先于细胞表面聚集,进而破坏细胞膜、壁,或者直接进入细胞内与胞内靶点物质相互作用,从而影响病原菌细胞正常生长繁殖,最终杀死病原菌[12,30-32]。本实验通过荧光显微镜观察,发现抗菌肽Jelleine-I能增加P. digitatum菌丝体细胞膜通透性,同时破坏P. digitatum细胞间隔膜,使SG进入P. digitatum细胞内,发出强烈绿色荧光,影响CFW染料在细胞间的积累,减少细胞间的蓝色CFW荧光,此结果与大多数抗菌肽作用相似,如PAF56[23]、BP21[33]、Thanatin、Ponericin W1、Mastoparan-S[34]。细胞膜在维持细胞正常生命活动方面起着重要的作用[35],当细胞膜损坏时可能会增加细胞膜通透性,引起细胞内一些离子和小分子物质泄漏[26,36-38],最终抑制微生物的生长。为评定细胞膜及细胞质的不可逆损伤,本实验测定了Jelleine-I处理后P. digitatum菌丝体的胞外电导率和胞内核酸物质泄漏量。结果发现,经过Jelleine-I处理的P. digitatum菌丝体的胞外电导率和胞内核酸物质泄漏量显著增加,且100 μmol/L Jelleine-I的影响更加显著。这也再次证明抗菌肽Jelleine-I能改变柑橘果实绿霉病病原菌P. digitatum菌丝体细胞膜的通透性,引起细胞的不可逆损伤。抗菌肽对正常哺乳动物红细胞的溶解性是阻碍抗菌肽应用的主要障碍之一,但抗菌肽Jelleine-I具有特异性细胞溶解活性,对人血红细胞几乎不存在溶解性,具有潜在的应用价值。这与Fontana等[20]的研究结果一致。
4 结 论
抗菌肽Jelleine-I能通过增加P. digitatum细胞膜通透性,引起胞内物质泄漏,从而表现出对P. digitatum生长的抑制作用和致死作用;此外,抗菌肽Jelleine-I能有效控制柑橘果实绿霉病的发生。进一步研究发现,抗菌肽Jelleine-I对人血红细胞有一定的特异性选择作用。因此认为,抗菌肽Jelleine-I在控制柑橘果实采后绿霉病病害方面具有极大的开发应用价值。

