环境因素对叶黄素纳米乳液稳定性及其抗氧化活性的影响
李季楠,胡 浩,吴雪娇,吴 艳*
(上海交通大学农业与生物学院,上海 200240)
叶黄素是一种含氧类胡萝卜素,天然存在于众多食品中,如蛋黄、菠菜、甘蓝和玉米等,具有极强的着色能力,赋予食物红色、橙色和黄色外观;同时叶黄素是一种脂溶性功能活性成分,具有抗氧化、预防心血管疾病和癌症等慢性疾病的生理功能[1],另外,叶黄素和玉米黄素能够在人眼视网膜黄斑部位沉积,作为抗氧化剂或光保护剂过滤进入眼部的蓝光,预防白内障和老龄性黄斑变性[2];但是,叶黄素分子结构中含有多个共轭双键,易受光、热、氧气、金属离子、酸性条件和其他促氧化剂的影响发生降解或异构化,导致生物活性的损失[3],且植物组织中叶黄素一般以晶体形式存在于有色体中,在消化道内难以完全释放,生物利用度较低[4]。
为克服上述缺点,本实验选择构建一种平均粒径在50~500 nm的水包油(O/W)纳米乳液载运体系,以期改善叶黄素的溶解性、稳定性和生物活性,纳米乳液一般由油相、水相、乳化剂和助乳化剂等成分组成,O/W型纳米乳液可用来包埋类胡萝卜素[5]、功能性油脂、脂溶性维生素[6]和某些香精油[7]。且常见的蛋白质(如β-乳球蛋白[8]、大豆分离蛋白[9]和豌豆蛋白[10])、多糖(如变性淀粉[11]和果胶[12])、磷脂(如卵磷脂[13]和大豆磷脂[14])和某些美拉德反应产物[15]等,均可用作乳化剂构建安全性较高的纳米乳液。研究表明,纳米乳液能够改善活性成分的稳定性、溶解性、分散性和生物利用度[16],此外,选择不同的油、水相及向其中添加不同的抗氧化剂或增稠剂等,可调控纳米乳液的理化稳定性[16]。因此,纳米乳液是一种理想的活性成分载运体系。
近年来,出现了许多利用乳液体系包埋叶黄素的报道,主要研究乳化剂类型、贮存温度和pH值等因素对乳液理化稳定性的影响,如Weigel等[17]分别利用皂苷、吐温-80、乳清蛋白和酪蛋白作乳化剂,比较发现皂苷稳定的纳米乳液具有良好的理化稳定性;Gumus等[15]的研究表明与酪蛋白稳定的纳米乳液相比,葡聚糖和酪蛋白的美拉德反应产物作为乳化剂,显著改善了乳液体系的理化稳定性;Teo等[18]以乳清分离蛋白为乳化剂,通过乳化-溶剂蒸发法构建叶黄素纳米乳液,发现该乳液体系对Caco-2细胞没有表现出明显的细胞毒性,且与传统乳液相比,纳米乳液中叶黄素的细胞摄取量更高。
因为叶黄素是一种天然抗氧化剂,且其稳定性和生理活性易受环境因素(如食品基质和加工处理条件)的影响[19-20];因此,本研究主要以自由基清除活性评价为目的,首先构建一种叶黄素纳米乳液体系,并评价其对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基的清除能力和氧自由基吸收能力(oxygen radical absorbance capacity,ORAC),进一步分析常见环境因素(pH值、热处理、离子强度和浓缩)对乳液体系的叶黄素质量浓度以及自由基清除活性的影响,以分析纳米乳液载运体系在多种条件下的叶黄素载运有效性。
1 材料与方法
1.1 材料与试剂
叶黄素(>90%) 上海源叶生物科技有限公司;酪蛋白酸钠(食品级) 麦克林生物试剂有限公司;玉米油购自上海某超市;DPPH(>97.0%)、ABTS(98%) 萨恩化学技术(上海)有限公司;水溶性VE(Trolox)(>98%) 北京伊诺凯科技有限公司;2,2’-偶氮二(2-甲基丙基咪)二盐酸盐(2,2’-azobis(2-methylpropionamidine) dihydrochloride,AAPH)(98%)、荧光素(fluorescein,FL)(>95%)、过硫酸钾(分析纯) 上海泰坦科技股份有限公司;其余所用试剂均为国产分析纯。
1.2 仪器与设备
2000高压均质机 丹麦APV公司;omni纳米粒度-Zeta电位仪 美国布鲁克海文仪器公司;Polytron®PT高速剪切均质机 瑞士Kinematica公司;U1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;R206B旋转蒸发仪 上海申生科技有限公司;Nicolet 6700傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 美国Thermo Fisher公司;ENSPIRE 2300全波长酶标仪 美国Perkin Elmer公司;TD5A-WS台式低速离心机 湖南湘仪实验室仪器开发有限公司;Milli-Q超纯水系统 美国Millipore公司;HWS24型电热恒温水浴锅 上海一恒科学仪器有限公司;BILON-2000F冷冻干燥机 上海比朗仪器制造有限公司;PL203电子天平 梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 叶黄素纳米乳液的制备
将酪蛋白酸钠粉末分散于去离子水中至质量浓度为1.0 g/100 mL,4 ℃贮存过夜使之完全溶解;玉米油中加入过量叶黄素粉末,超声10 min辅助分散,4 ℃避光贮存过夜使之溶解完全,3 000 r/min离心10 min,取上清即为叶黄素油溶液;将蛋白溶液与叶黄素油溶液按9∶1的质量比混合,10 000 r/min 高速剪切2 min得粗乳液,将粗乳液于100 MPa下高压均质,循环7 次,得叶黄素纳米乳液。所有样品均贮存在4 ℃冰箱中,以备后续实验分析。
1.3.2 叶黄素纳米乳液粒径和Zeta电位的测定
将乳液样品用去离子水稀释后,利用纳米粒度-Zeta电位仪对乳液样品的平均粒径、粒径分布(稀释1 000倍)和Zeta电位(稀释100 倍)进行测定。所有样品重复测定3 次,所有的测定在25 ℃下进行。
1.3.3 环境因素设计
1.3.3.1 pH值
取新制叶黄素纳米乳液,用1 mol/L HCl或NaOH溶液调节pH值为2.0、6.0、8.0、10.0和12.0,再将乳液转移至离心管中,4 ℃暂存,1 d内取样完成后续测定。
1.3.3.2 热处理
取新制叶黄素纳米乳液转移至离心管中,分别于60、80 ℃和100 ℃水浴30 min,冷却至室温,4 ℃暂存,1 d内取样完成后续测定。
1.3.3.3 离子强度
取新制叶黄素纳米乳液,加入NaCl溶液调节乳液的离子强度为50、100 mmol/L,将乳液转移至离心管中,4 ℃暂存,1 d内取样完成后续测定。
1.3.3.4 浓缩
取一定体积新制叶黄素纳米乳液,设置水浴温度为50 ℃,分别旋转蒸发浓缩至原乳液体积的1/5、2/5、3/5和4/5,将乳液转移至离心管中,4 ℃暂存,1 d内取样完成后续测定。
1.3.4 叶黄素纳米乳液自由基清除活性评价
1.3.4.1 DPPH自由基清除能力的测定
参照Guan Yongguang等[21]的方法,并稍作修改。准确配制0.1 mmol/L DPPH溶液,吸取100 µL乳液样品与3 mL DPPH溶液混合均匀,暗处反应20 min,再于5 000 r/min离心10 min,取上清液,于517 nm波长处测定吸光度,记为Ai;吸取100 µL乳液样品与3 mL体积分数95%的乙醇溶液混合反应后,于相同条件下测定吸光度,记为Aj;吸取100 µL体积分数95%的乙醇溶液与3 mL DPPH溶液混合反应后,于相同条件下测定吸光度,记为A0。按式(1)计算DPPH自由基清除率。
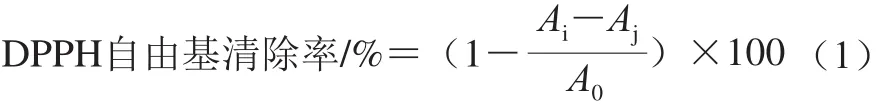
1.3.4.2 ABTS阳离子自由基清除能力的测定
参照Guan Yongguang等[21]的方法,并稍作修改。准确配制7.0 mmol/L ABTS溶液和2.45 mmol/L过硫酸钾溶液,等体积混合暗处反应12~16 h产生ABTS阳离子自由基,用体积分数95%的乙醇溶液将上述混合溶液稀释至734 nm波长处的吸光度为0.70±0.05左右。准确吸取50 µL适当稀释的叶黄素纳米乳液样品与3 mL稀释后的ABTS阳离子溶液混合避光反应6 min,于734 nm波长处测定吸光度,记为At;吸取50 µL体积分数95%的乙醇溶液与3 mL稀释后的ABTS阳离子溶液混合避光反应后,于相同条件下测定吸光度,记为A0。按式(2)计算ABTS阳离子自由基清除率。
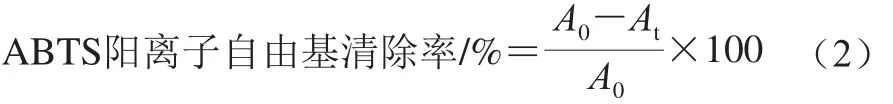
1.3.4.3 ORAC的测定
参照Qian Bingjun等[22]的方法,并稍作修改。ORAC实验在pH 7.4的75 mmol/L磷酸盐缓冲液(phosphate buffered saline,PBS)中进行,所有溶液均以该PBS配制。
75 mmol/L PBS:准确称取10.21 g KH2PO4加入去离子水溶解定容至1 000 mL(A液),准确称取13.06 g K2HPO4加入去离子水溶解定容至1 000 mL(B液),将800 mL B液与200 mL A液混合均匀,调节pH值为7.4,即为75 mmol/L PBS。
FL储存液(70 µmol/L):准确称取0.001 2 g FL,用75 mmol/L PBS溶解定容至100 mL,即为FL储存液,-20 ℃避光冷冻保存。使用时稀释至所需浓度。
AAPH溶液(120 mmol/L):准确称取0.325 4 g AAPH,用75 mmol/L PBS溶解定容至10 mL,现配现用,避光保存。
Trolox储存液(100 µmol/L):准确称取2.5 mg Trolox,用75 mmol/L PBS溶解定容至100 mL,即为100 µmol/L的Trolox溶液,-20 ℃避光冷冻保存。使用时稀释至所需浓度。
准确吸取10 µL PBS、Trolox标准液(100、50、25、12.5、6.25 µmol/L)和样品溶液(用75 mmol/L PBS稀释1 000 倍体积)加入到黑色96 孔板中,37 ℃孵育10 min,向各孔中加入120 µL 70 nmol/L的FL溶液,37 ℃孵育30 min,之后迅速加入20 µL新制的120 mmol/L AAPH溶液启动反应。设置酶标仪参数为:激发波长485 nm、发射波长530 nm、反应温度37 ℃,每隔2 min测定一次各孔荧光强度,每次测定前低速振动孔板5 s,共测定120 min。
在本次高速公路水泥混凝土路面施工中,采用三轴式摊铺机,其具体的施工工艺流程为:制作、安装模板→混凝土的拌和→混凝土的运输与摊铺→滚动、振动及整平→养生[2]。
以相对荧光强度采用近似积分法计算荧光衰退曲线下面积(area under the curve,AUC)。实验各孔不同时间点的绝对荧光强度与初始荧光强度的比值为相对荧光强度(fi)。
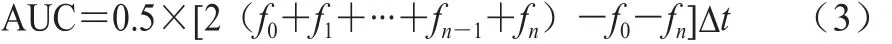
式中:fn为第n个测定点的相对荧光强度;Δt为测定时间间隔2 min,则式(3)可简化为式(4)、(5)。
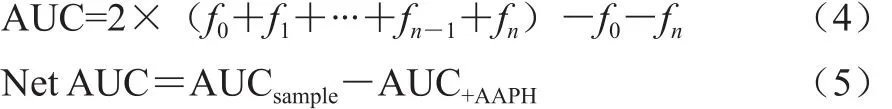
式中:Net AUC为净荧光衰退AUC;AUCsample为样品溶液AUC;AUC+AAPH为PBS与AAPH溶液混合后的AUC。
以Net AUC为纵坐标,Trolox浓度为横坐标绘制标准曲线(Y=0.806 3X+4.666 4;R2=0.998 7),根据标准曲线计算样品的ORAC值,以每毫升溶液中Trolox的物质的量表示。
1.3.5 叶黄素纳米乳液中叶黄素质量浓度的测定
准确吸取400 µL叶黄素纳米乳液样品,加入3 mL二甲基亚砜(dimethyl sulfoxide,DMSO)溶解,于460 nm波长处测定吸光度;以不含叶黄素的空白纳米乳液为对照。同时,以DMSO为溶剂配制2.0~10.0 µg/mL系列质量浓度的叶黄素标准品溶液,绘制标准曲线(y=0.114 3x-0.018 4;R2=0.999 3),将样品吸光度代入标准曲线计算叶黄素质量浓度[23]。
1.3.6 叶黄素纳米乳液的FTIR分析
冷冻干燥后的叶黄素纳米乳液与叶黄素标准品进行FTIR分析。扫描次数32 次,分辨率为4 cm-1,扫描范围4 000~500 cm-1。
1.4 数据统计与分析
2 结果与分析
2.1 叶黄素纳米乳液基本性质和抗氧化活性
高压均质过程中,均质腔内产生高速剪切、空化和撞击等破坏作用,打破油水界面[24],两亲性的酪蛋白酸钠分子可快速吸附在新形成的油水界面上,部分蛋白链和带电氨基酸产生空间位阻和静电斥力,稳定叶黄素纳米乳液[25]。由表1可知,叶黄素纳米乳液的平均粒径、多分散系数(polydispersity index,PDI)和Zeta电位分别为(223.77±2.40)nm、0.119±0.018和(-40.22±1.39)mV;叶黄素纳米乳液的平均粒径小于250 nm,PDI小于0.2,表明其粒径分布较窄;乳滴携带的净电位值大于30 mV,表明乳滴之间的静电斥力足以维持乳液体系的物理稳定[26]。
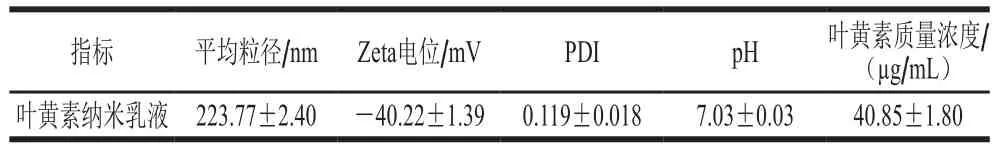
表1 叶黄素纳米乳液基本性质Table 1 Characteristics of lutein-enriched nanoemulsion
如表2所示,叶黄素纳米乳液体系的DPPH、ABTS阳离子自由基清除率和ORAC分别为(26.91±2.45)%、(48.63±2.31)%和(48.69±2.25)µmol/mL,显著大于空白纳米乳液(不含叶黄素)和叶黄素油水混合物(未经高压均质的粗乳液)以及叶黄素有机溶剂体系(溶剂为DMSO)(P<0.05),表明纳米乳液体系能够显著改善叶黄素的抗氧化活性。这可能与乳液体系的微结构有关,一方面,乳化增加了叶黄素的分散性和溶解性,有助于叶黄素与自由基接触反应;另一方面,乳液粒径较小,故界面比表面积增加,提高了叶黄素与自由基的接触机率。
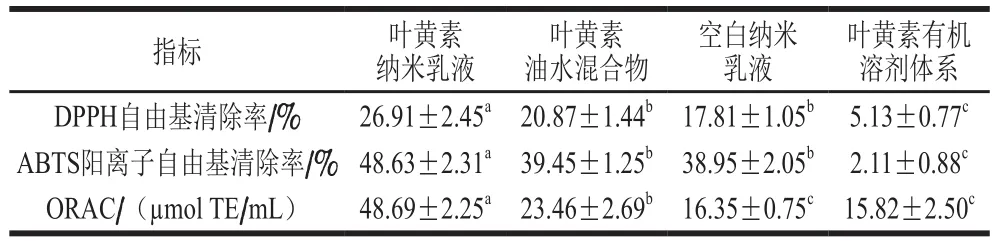
表2 叶黄素纳米乳液的抗氧化活性Table 2 Free radical scavenging activity of nanoemulsion
2.2 环境因素对叶黄素纳米乳液稳定性和抗氧化活性的影响
2.2.1 pH值对叶黄素纳米乳液稳定性和抗氧化活性的影响
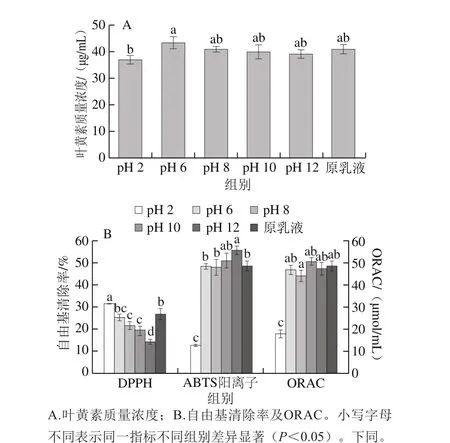
图1 pH值对叶黄素纳米乳液稳定性和抗氧化活性的影响Fig. 1 Lutein stability and radical scavenging capacity in nanoemulsion under different pHs
pH 2.0~12.0范围内叶黄素纳米乳液中叶黄素质量浓度的变化如图1A所示。因酪蛋白酸钠的等电点为pH 4.6,故调节乳液pH值为4.0左右时,静电斥力不足以维持体系的稳定,乳液很快分层失稳,因此未能对其中的叶黄素质量浓度进行测定;当调节乳液pH值为2.0后,与原乳液相比,其中的叶黄素质量浓度有所减小(下降了9.30%),其余各pH值条件下纳米乳液中的叶黄素质量浓度均无显著变化(P<0.05)。以上结果表明酸性条件下叶黄素分子容易发生降解,之前的研究也表明类胡萝卜素分子暴露在酸性条件下,容易与氢离子形成离子对,并裂解生成类胡萝卜素碳正离子,进而发生降解和异构化[3,23],故该纳米乳液产品应尽量避免在酸性食品中应用。
由图1B可知,在pH 2.0、6.0、8.0、10.0和12.0时叶黄素纳米乳液的DPPH自由基清除率分别为(31.59±0.19)%、(25.45±1.36)%、(21.71±1.72)%、(19.75±1.76)%和(14.35±1.19)%,pH 2.0时的叶黄素纳米乳液DPPH自由基清除能力显著大于原乳液,pH 6.0~10.0范围内DPPH自由基清除率差异并不显著(P>0.05),当pH值至12.0时,DPPH自由基清除能力显著小于原乳液(P<0.05),可能是乳液体系内的H+浓度对抗氧化剂清除DPPH自由基的作用机制有一定影响。许申鸿等[27]研究表明,在pH 2~10之间,随着介质pH值的增大,特丁基对苯二酚清除DPPH自由基的效果有所下降;Singh等[28]利用DPPH法评价啤酒样品的自由基清除活性,发现原样品(pH 4.4)的DPPH自由基清除能力显著大于pH 7.3的啤酒样品。但是Pękal等[29]研究表明,H+浓度降低使得DPPH自由基与黄酮的反应速率增大;Dawidowicz等[30]研究表明,与单纯的甲醇溶剂相比,H+浓度增加可减缓DPPH自由基与抗氧化剂的反应速率。不同类型抗氧化剂与DPPH自由基反应的具体机理存在一定差异[31],故体系组成不同时,pH值造成的影响可能不同,具体原因有待进一步探讨。
由图1B可知,在pH 2.0、6.0、8.0、10.0和12.0时叶黄素纳米乳液的ABTS阳离子自由基清除率分别为(12.93±0.42)%、(48.54±1.19)%、(48.23±3.59)%、(50.99±3.60)%和(55.94±1.81)%,pH 6.0~8.0范围内ABTS阳离子自由基清除率与原乳液无显著差异(P>0.05),当pH值为2.0时,叶黄素纳米乳液的ABTS阳离子自由基清除能力显著减小(P<0.05)。一方面因为此时乳液体系内叶黄素有所降解;另一方面,Dawidowicz等[32]认为ABTS阳离子反应属单电子或氢转移机制,抗氧化剂的脱氢能力影响其抗氧化活性,在酸性pH值条件,由于质子化作用,抗氧化剂如二叔丁基羟基甲苯清除ABTS阳离子自由基的能力有所减小。一般pH值增大某些抗氧化剂给电子能力增加,可能加速ABTS阳离子自由基清除反应,故本实验中当pH值增加至10.0~12.0时,乳液的ABTS阳离子自由基清除能力有所增加;Faria等[33]利用ABTS法评价肯氏蒲桃提取物的自由基清除活性时发现,随着pH值的增加ABTS阳离子自由基清除率呈增加的趋势。
在pH 2.0、6.0、8.0、10.0和12.0时叶黄素纳米乳液ORAC分别为(18.03±1.82)、(46.97±1.99)、(44.22±2.49)、(50.80±1.63)、(47.53±2.79)µmol/mL(图1B),叶黄素纳米乳液在酸性条件下的ORAC显著减小(P<0.05),其他pH值下并无显著性差异(P>0.05),可能是酸性条件下叶黄素发生部分降解所致。
综上所述,不同评价方法结果表明强酸及强碱条件对叶黄素纳米乳液的抗氧化活性有不同程度的影响,故该乳液产品应尽量在中性条件下贮存和应用。
2.2.2 热处理对叶黄素纳米乳液稳定性和抗氧化活性的影响
类胡萝卜素分子内含有多个共轭双键,对热处理较为敏感,如图2A所示,与原乳液相比,60~100 ℃下水浴30 min后,叶黄素纳米乳液中的叶黄素质量浓度并未发生显著变化(P>0.05),仅在100 ℃热处理后,乳液中的叶黄素降解量较大(8.35%),表明低温短时热处理对纳米乳液体系中叶黄素质量浓度的影响较小;这可能因为叶黄素被包埋进乳滴中,且乳液体系内的酪蛋白酸钠具有一定的抗氧化活性和热稳定性,改善了芯材对热处理的抵抗能力,但是生产加工过程中该纳米乳液体系应避免在高温条件的暴露。如图2B所示,60、80 ℃和100 ℃水浴30 min后,叶黄素纳米乳液的DPPH自由基清除能力显著减小(P<0.05),ABTS阳离子自由基清除能力与原乳液相比无显著性差异(P>0.05)。对于ORAC来说,仅在100 ℃热处理之后显著减小(P<0.05)。3 种评价方法均表明低温短时热处理对乳液自由基清除活力的影响相对较小,一方面,因为乳液体系的保护增强了叶黄素的稳定性,热处理之后叶黄素的降解并不显著;另一方面,乳液体系本身具有热稳定性,在热处理过程中乳滴粒径的显微形态未受显著影响[12]。
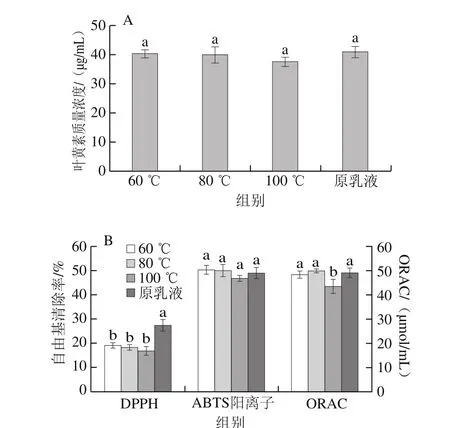
图2 热处理对叶黄素纳米乳液稳定性和抗氧化活性的影响Fig. 2 Lutein stability and free radical scavenging capacity in nanoemulsion under thermal treatment
2.2.3 离子强度对叶黄素纳米乳液稳定性和抗氧化活性的影响

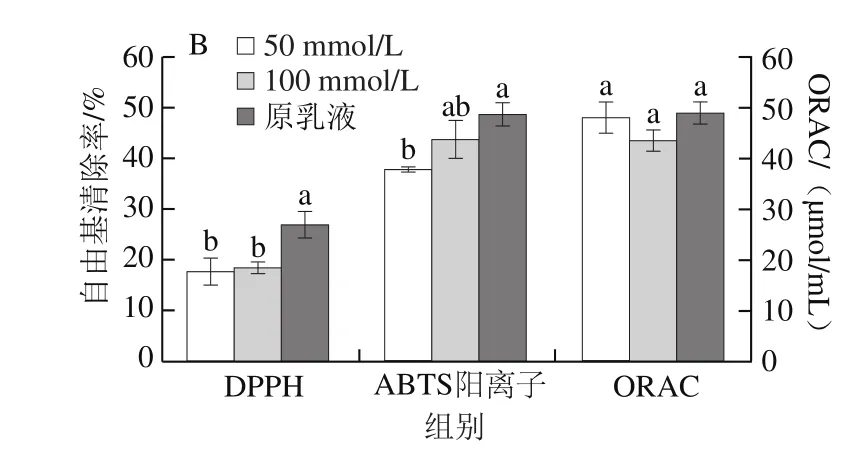
图3 离子强度对叶黄素纳米乳液稳定性和抗氧化活性的影响Fig. 3 Lutein stability and free radical scavenging capacity in nanoemulsion under different ionic strengths
因前期实验(数据未发表)表明NaCl浓度大于100 mmol/L时,乳液在贮存期间容易失稳,故选择调节离子强度为50 mmol/L和100 mmol/L。由图3A可知,纳米乳液体系内叶黄素质量浓度未发生显著变化(P>0.05),表明短时间内在该离子强度范围内Na+对纳米乳液中叶黄素质量浓度无显著影响。可能是因为本实验所用离子强度相对较小,且吸附于油水界面上的酪蛋白酸钠作为抗氧化剂的同时,也作为界面屏障阻碍水相中的离子与叶黄素分子接触,从而起到一定的保护作用[25]。
如图3B所示,加NaCl溶液调节乳液的离子强度为50 mmol/L和100 mmol/L后,除ORAC外,其DPPH自由基清除率和ABTS阳离子自由基清除率均显著小于原乳液(P<0.05),但不同离子强度之间两种自由基清除率不存在显著差异(P>0.05)。一方面,盐离子的存在可能影响自由基清除反应的速率。Dawidowicz等[32]研究表明ABTS阳离子自由基能够与某些金属离子形成复合物,抑制ABTS阳离子自由基与乳液体系内抗氧化剂的反应。Pękal等[29]研究表明,脱盐处理后茶汤的DPPH自由基清除活力显著增加。因为DPPH自由基同样能与某些金属离子形成复合物,使得自由基清除反应动力学发生变化[30]。顾敏等[34]研究表明盐离子的存在可能影响FL的电离,改变FL的氧化速率,进而使得测得的ORAC偏高。另一方面,阳离子的加入使得纳米乳滴携带的电位稍有减小,且粒径有所增大,故与自由基接触反应的界面面积减小。
2.2.4 浓缩对叶黄素纳米乳液稳定性和抗氧化活性的影响
利用旋转蒸发设备将新制叶黄素纳米乳液分别浓缩至原体积的4/5、3/5、2/5和1/5,由图4A可知,随着浓缩程度的增加,乳液体系内的水分被大量移除,故相同体积内叶黄素质量浓度显著大于未经浓缩处理的原乳液(P<0.05),而浓缩至4/5和3/5时的乳液中叶黄素质量浓度并无显著差异(P>0.05),可能是因为旋转蒸发浓缩过程中伴随搅动和热处理,导致叶黄素发生部分降解,抵消了浓缩带来的浓度增加效应。
如图4B所示,随着浓缩程度的增加,叶黄素纳米乳液的自由基清除能力均显著增大(P<0.05),因为浓缩后乳液体系内的叶黄素质量浓度及酪蛋白酸钠浓度均显著增大,且两者均具有抗氧化活性,故自由基清除能力显著增大。浓缩至原乳液体积的4/5、3/5之后,乳液体系自由基清除率相近,此时体系内的叶黄素质量浓度无显著差异,因此推测自由基清除能力与体系内的叶黄素质量浓度具有一定的相关性。
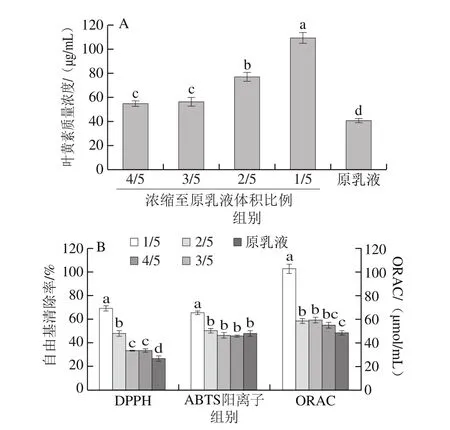
图4 浓缩对叶黄素纳米乳液稳定性和抗氧化活性的影响Fig. 4 Lutein stability and free radical scavenging capacity in nanoemulsion under condensation treatment
2.3 叶黄素纳米乳液的FTIR分析
冻干叶黄素纳米乳液样品与叶黄素标准品粉末的FTIR谱图如图5所示。叶黄素纳米乳液样品未发生吸收峰位移和产生新的吸收峰,说明乳化之后叶黄素与酪蛋白酸钠未发生化学反应,仅通过物理相互作用结合,可能有利于叶黄素在目标位点的释放。
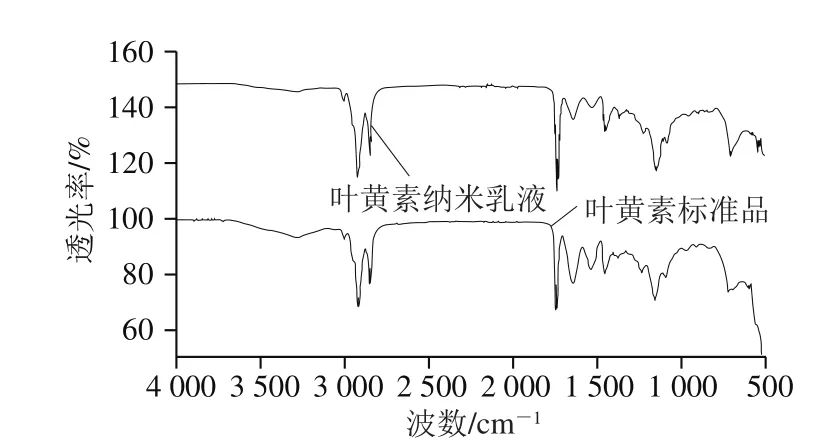
图5 叶黄素纳米乳液及叶黄素标准品的FTIR图Fig. 5 Fourier transform infrared spectra of lutein-enriched nanoemulsion and lutein
3 结 论
本实验利用高压均质法以酪蛋白酸钠为乳化剂构建了一种叶黄素纳米乳液,同时评价其自由基清除活性及ORAC,所得纳米乳液的平均粒径、PDI和Zeta电位分别为(223.77±2.40)nm、0.119±0.018和(-40.22±1.39)mV。结果表明,该纳米乳液体系显著改善了叶黄素的自由基清除活性和ORAC;pH值(6.0~12.0)、离子强度(50、100 mmol/L NaCl)和热处理对体系中叶黄素稳定性的影响均不显著,仅当pH值为2.0及100 ℃热处理后叶黄素的降解量相对较大,且此时自由基清除活性及ORAC有不同程度的减小;而浓缩处理后纳米乳液体系的叶黄素质量浓度和抗氧化活性均显著增大;加入NaCl溶液后乳液的抗氧化活性则有所减小。综上,在食品工业中,应尽量避免将该叶黄素纳米乳液应用在高温、偏酸性和较高的离子强度条件下,以免造成叶黄素生理活性的损失,同时需进一步研究如何改善纳米乳液在生产加工过程中的稳定性。

