酸应激对大肠杆菌O157:H7生物菌膜形成的影响
王娴静,董 晨,禹金龙,胡 洁,付文静,张 苏,江 芸,*
(1.南京师范大学食品与制药工程学院,江苏 南京 210023;2.江苏省疾病预防控制中心,江苏 南京 210009)
近年来,食源性致病菌生物菌膜已成为食品安全领域中的研究热点[1-2]。生物菌膜是细菌在生长过程中为适应生存环境而黏附、生长于组织表面,在菌体-菌体和菌体-接触面的相互作用下,通过菌体增殖、分泌胞外基质而形成的具有一定空间结构的细菌聚集体[3-4]。形成菌膜后,细菌菌体对外界环境的抵抗力会大大增强,对工业清洗剂和消毒剂具有更强耐受性,不易清除,残留的生物菌膜可在环境适宜时脱落出细菌菌体,成为潜在污染源,进一步造成交叉污染,引发严重的食品安全问题[5-6]。大肠杆菌O157:H7是全球范围内备受关注的食源性致病菌,每年都会爆发多起因大肠杆菌O157:H7污染而引发的食物中毒事件。有研究表明,大肠杆菌O157:H7在固体表面(如加工器械表面、畜禽胴体表面等)产生黏附的特性是其造成交叉污染的主要原因[7]。
大肠杆菌O157:H7等食源性致病菌大多是嗜中性菌。然而食品加工过程常存在低pH值环境,如使用酸性洗液和酸性食品添加剂、酸乳和发酵香肠等酸性食品的加工与贮藏等。目前关于食品加工环境影响食源性致病菌生物菌膜生长的研究较多集中在各类环境因子(如培养基类型、温度、pH值、接触面类型)的影响作用[8-11],而结合食品实际加工环境探究较长时间酸应激对食源性致病菌生物菌膜形成的影响,可以揭示菌膜形成的真实规律,有助于针对性地制定消除和控制菌膜的策略和有效措施,具有更为现实的指导意义。
因此,本研究以大肠杆菌O157:H7为对象,通过比较不同菌株黏附性能,选择代表菌株分析在较长时间酸应激时其生物菌膜形成规律,进一步采用共聚焦激光扫描显微镜(confocal laser scanning microscope,CLSM)比较黏附力不同的菌株在酸性环境下生物菌膜形态结构变化。本研究将为酸性食品实际生产加工中大肠杆菌O157:H7风险评估提供理论参考,为研究致病菌生物菌膜的有效防控技术提供科学思路。
1 材料与方法
1.1 菌株、材料与试剂
实验用大肠杆菌O157:H7共14 株,包括菌株CICC21530(购自中国工业微生物菌种保藏中心)菌株ATCC43895(购自美国菌种保藏中心)、菌株NCTC12900(购自广东环凯微生物科技有限公司),其余11 株为南京师范大学食品与制药工程学院实验室分离自牛肉和牛粪[12]。
胰蛋白胨大豆琼脂(tryptone soya agar,TSA)培养基、胰蛋白胨大豆肉汤(tryptic soy broth,TSB)、胰蛋白胨大豆琼脂酵母提取物(tryptone soya agar yeast extract,TSAYE)培养基 北京陆桥技术有限公司;LIVE/DEAD®BacLight Bacterial Viability Kits(L7012)美国Molecular Probes公司;磷酸二氢钠、磷酸氢二钠、氯化钠、结晶紫、乳酸、戊二醛、锇酸、乙醇 南京化学试剂有限公司。
1.2 仪器与设备
M2多功能酶标仪 美国Molecular Devices公司;SZX超净工作台 上海浦东跃欣仪器厂;LDZX-30FBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;SG403A Sterile GDRD生物安全柜 美国Baker公司;拍打式均质器 青岛众瑞智能仪器有限公司;生化培养箱 上海新苗医疗器械制造有限公司;QL-200微型漩涡混合仪 海门其林贝尔仪器有限公司;2-16KL高速冷冻离心机 美国Sigma公司;DHP-9052型电热恒温培养箱 上海一恒科技有限公司;LSM 710 CLSM德国Carl Zeiss公司。
1.3 方法
1.3.1 菌液制备
冻藏的14 株大肠杆菌O157:H7经TSA平板划线,于37 ℃培养24 h,挑取单菌落接种至3 mL TSB中,37 ℃摇床培养18 h,再吸取1 mL菌液转接至100 mL TSB中,37 ℃摇床培养18 h,使菌液浓度达到108CFU/mL左右。取1 mL培养好的菌液离心(6 000×g、5 min、4 ℃),弃去上清液,用磷酸盐缓冲液(pH 7.2)洗涤2 次,重悬后备用。
1.3.2 大肠杆菌O157:H7黏附性能比较
采用微孔板结合结晶紫染色法[13-14]。取500 μL备用菌液,接种至一定体积TSB中(菌体浓度约为2~3(lg(CFU/mL))。吸取180 μL置于96 孔细胞培养板中,封口膜包被,于25 ℃培养72 h,以不接种细菌的TSB作为空白对照。培养结束后,弃去微孔中的细菌培养液,无菌蒸馏水洗涤3 次,室温下干燥45 min后,每孔加入200 μL 0.25 g/100 mL结晶紫染液染色30 min,弃去染液并用无菌蒸馏水洗涤3 次,200 µL体积分数95%乙醇溶液洗脱30 min,最后将微孔板置于酶标仪中在570 nm波长处测定其OD值。每个菌株重复6 次。
1.3.3 微孔法分析大肠杆菌O157:H7生物菌膜的形成曲线
根据1.3.2节结果,选取生物菌膜形成能力不同的几株大肠杆菌O157:H7,按1.3.2节方法进行微孔板操作,分别在培养2、4、8、12、16、24、36、48、60、72、120、168 h取样[15],以不接种的TSB作为对照组。经结晶紫染液染色、乙醇洗脱,570 nm波长处测定其OD值,所得OD值按照培养时间绘制菌膜形成曲线。每个菌株每个时间点均重复6 次。
1.3.4 酸应激对菌株生物菌膜形成的影响
根据1.3.2节和1.3.3节结果选取代表菌株,研究酸应激对其生物菌膜形成的影响。用3 mol/L乳酸溶液和1 mol/L盐酸溶液分别配制系列pH值梯度(pH 3.5、4.0、4.5、5.0)TSB作为酸性培养液,同时以未经酸处理的正常TSB作为对照。采用机械脱落平板计数法检测菌膜形成[16]。
按1.3.1节方法进行菌液制备,取100 μL备用菌液接种于10 mL载有不锈钢片的上述不同酸度TSB中,菌液浓度约为106CFU/mL。将接种好的样品于25 ℃静置培养2、4、8、12、24、48、72、120、168 h,规定时间取样后,对培养装置里的浮游菌数和不锈钢表面形成的生物菌膜进行计数。生物菌膜计数前用无菌生理盐水清洗不锈钢片3 次以去除钢片表面未黏附的游离菌体,用拍击-冲击法采集钢片表面的黏附菌体,将清洗后的载有生物菌膜的不锈钢片放入装有80 mL无菌生理盐水的均质袋中,并放入少量无菌棉,在480 击/min条件下拍击60 s,吸取均质液进行梯度稀释,涂布至TSAYE平板中,37 ℃下培养24 h后计数。每组实验重复3 次。
1.3.5 酸应激下不同黏附力菌株生物菌膜的CLSM观察
根据1.3.2节和1.3.3节结果选取黏附力不同的代表菌株,采用CLSM比较不同pH值时代表菌株生物菌膜的结构变化。按1.3.1节方法制备菌液,取100 μL备用菌液接种于10 mL载有不锈钢片的酸性和正常TSB中,菌液浓度约为106CFU/mL。将接种好的样品于25 ℃静置培养,分别在24、72 h和168 h取出,无菌蒸馏水充分洗涤不锈钢片以去除其上的游离菌体,吸取LIVE/DEAD®荧光染液对不锈钢片表面进行染色,室温避光条件下充分作用15 min后,用无菌蒸馏水充分洗涤不锈钢片以除去多余荧光染料,室温避光条件下放置自然干燥,使用CLSM(60×,油镜)观察染色后的生物菌膜结构。LIVE/DEAD®为由核酸染料SYTO 9和碘化丙啶(propidium iodide,PI)复配的荧光染料;其中SYTO 9激发波长和吸收波长分别为480 nm和500 nm,可以将生物菌膜中具有完整细胞膜的菌体(活菌)染成绿色,PI激发波长和吸收波长分别为490 nm和635 nm,可以将生物菌膜中细胞膜损伤的菌体(死菌)染成红色,从而可以区别生物菌膜中的活菌和死菌[17]。每组随机选用10 张CLSM图像,使用NIS-Element Viewer软件和Image J 软件对图像进行处理。
1.4 数据统计与分析
数据处理应用SPSS 17.0软件,采用单因素方差分析及Duncan’s多重比较检验进行差异显著性分析。
2 结果与分析
2.1 大肠杆菌O157:H7不同菌株黏附性能比较
采用微孔板结合结晶紫染色法,14 株大肠杆菌O157:H7在聚苯乙烯微孔表面底部可形成淡紫色薄膜,其黏附性能如图1所示。14 株大肠杆菌O157:H7均具有一定的黏附能力,但存在明显的菌株差异性,其中菌株J29黏附力最强,显著高于其他菌株(P<0.05),菌株ATCC43895黏附力中等,其余12 株黏附力均较弱。
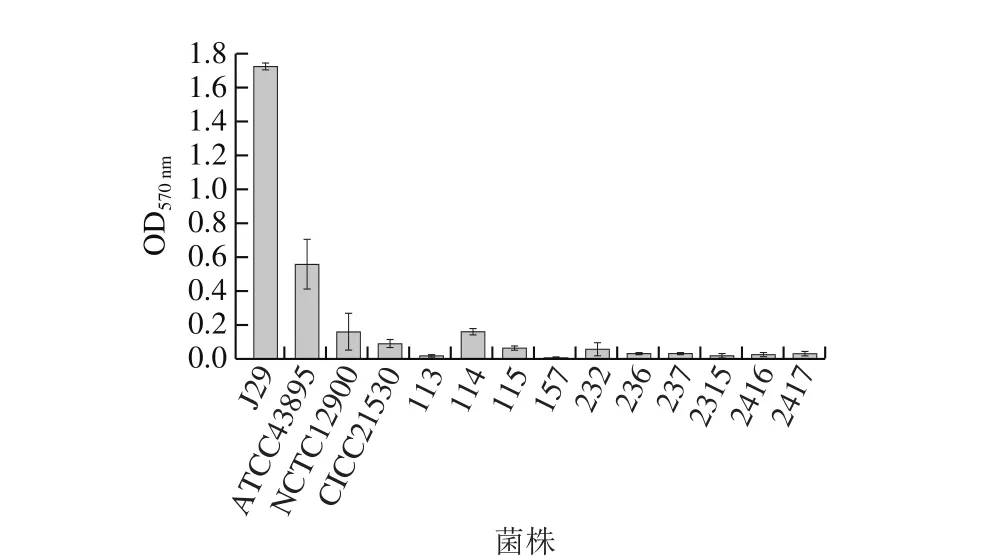
图1 大肠杆菌O157:H7在微孔板表面生物菌膜形成能力比较(n= 6)Fig. 1 Comparison of biofilm formation abilities of E. coli O157:H7 strains on polystyrene microplate surface (n = 6)
2.2 大肠杆菌O157:H7生物菌膜形成曲线

图2 大肠杆菌O157:H7生物菌膜形成曲线(n=6)Fig. 2 Biofilm formation curves of E. coli O157:H7 (n = 6)
根据2.1节结果,进一步选取较强黏附力菌株J29、中等黏附力菌株ATCC43895和4 株较弱黏附力菌株(113、157、236和CICC21530),利用微孔板结合结晶紫染色法绘制各菌株生物菌膜的形成曲线,结果如图2所示。各菌株均在培养2 h时开始产生黏附,但黏附性能不同的菌株其形成曲线差异明显,4 株较弱黏附力菌株在2 h后随培养时间延长,菌膜形成量变化不大,基本维持在相对稳定状态;而中等黏附力菌株ATCC43895和较强黏附力菌株J29菌膜形成量明显依赖于培养时间,其中菌株ATCC43895在培养2 h时完成初黏附后,2~48 h时菌膜形成量比较稳定,48~168 h时菌膜形成量呈较快增长趋势;菌株J29在培养2 h时完成初黏附后,2~24 h时菌膜形成量比较稳定,24~48 h时菌膜形成量迅速增加,48~168 h时菌膜形成量呈较缓增长趋势。
2.3 酸应激下中等黏附力菌株ATCC43895生物菌膜的形成过程
根据2.1节和2.2节结果,进一步选取中等黏附力菌株ATCC43895为代表菌株,利用机械脱落平板计数法观察酸应激下不锈钢表面该菌株生物菌膜的形成。结果表明,pH 3.5乳酸-TSB的抑菌效应强,该菌株浮游菌数和生物菌膜形成数量均未达到检测限,而pH 3.5盐酸-TSB对该菌株浮游菌数和生物菌膜数量影响均较小,故对pH 3.5乳酸-TSB和pH 4.0、4.5、5.0盐酸-TSB未作进一步研究。pH 4.0、4.5、5.0乳酸-TSB、pH 3.5盐酸-TSB对菌株ATCC43895浮游菌数及其生物菌膜形成过程的影响如图3、4所示。

图3 酸应激下菌株ATCC43895浮游菌数变化(n= 3)Fig. 3 Effect of acid stress on planktonic cell count of strain ATCC43895 (n = 3)
由图3可知,酸应激下对照组(正常TSB)浮游菌数在2~8 h显著增大,8 h时其浮游菌数达8.70(lg(CFU/mL)),此后至168 h基本保持稳定。乳酸-TSB各组在整个培养过程中浮游菌数均低于对照组,尤其是pH 4.0乳酸-TSB组,其浮游菌数显著低于对照组(P<0.05),从培养4 h起即随培养时间的延长而减小,168 h时已减小至检测限以下。pH 3.5盐酸-TSB组的浮游菌数变化与pH 5.0乳酸-TSB组类似。结果表明,浮游菌数显著依赖于pH值,pH值越低,即培养条件酸性越强,浮游菌数越少;pH值相同时乳酸对浮游菌数的抑制效应显著高于盐酸。
酸应激下菌株ATCC43895生物菌膜形成情况如图4所示。对照组(正常TSB)生物菌膜形成量逐渐增多,从2 h的3.42(lg(CFU/cm2))增长至168 h时的7.03(lg(CFU/cm2))。乳酸-TSB各组和pH 3.5盐酸-TSB组在培养2 h时的菌膜形成量显著低于对照组(P<0.05),表明乳酸和盐酸显著抑制了菌膜形成。酸应激下形成的菌膜逐渐减少,其中pH 5.0乳酸-TSB和pH 3.5盐酸-TSB组在培养120 h时形成的菌膜略微减少,pH 4.5乳酸-TSB组生物菌膜形成量缓慢增加,介于pH 5.0乳酸-TSB组和pH 4.0乳酸-TSB组之间,而pH 4.0乳酸-TSB组从培养8 h起即逐渐减少,直至低于检测限。结果表明,生物菌膜形成量明显依赖于pH值,pH值越低,即培养条件酸性越强,生物菌膜形成量越少,较长时间酸处理可导致已形成的菌膜发生部分甚至全部消除;pH 3.5盐酸-TSB组培养2 h时的菌膜形成量较少,4 h后大幅增多,至24 h时菌膜形成量接近pH 5.0乳酸-TSB组,表明pH值相同时乳酸对菌膜最终形成的抑制效应显著高于盐酸。

图4 酸应激下菌株ATCC43895生物菌膜形成量变化Fig. 4 Effect of acid stress on biofilm formation of strain ATCC43895
2.4 酸应激下不同黏附力菌株生物菌膜的CLSM比较
根据2.1节和2.2节结果,进一步选取较强黏附力菌株J29和一株较弱黏附力菌株CICC21530进行生物菌膜的CLSM比较。同时根据2.3节结果,因酸性较强时菌膜形成较少,为了更好地观察菌膜结构,选取pH 5.0乳酸-TSB作为酸应激组,以正常TSB作为对照组。
较弱黏附力菌株CICC21530在正常和酸性TSB中形成生物菌膜的CLSM图像变化如图5所示。培养24 h时可发现两种培养条件下均开始有少量单个菌体黏附于不锈钢表面,培养72 h时正常TSB中已有少量小的细菌“团状物”出现,而pH 5.0乳酸-TSB组中的菌体出现连接趋势,但未观测到“团状物”出现,培养168 h时正常TSB中的菌体连接成“网状”结构,而pH 5.0乳酸-TSB组中的菌体网状结构比较松散,且观察到较多红色菌体,表明死菌数明显增加。
较强黏附力菌株J29在正常和酸性TSB中形成生物菌膜的CLSM图像变化如图6所示。培养24 h时可发现正常TSB组中已有细菌黏附体出现,pH 5.0乳酸-TSB组中为大量单个菌体黏附,并伴有少量细菌“团状物”出现;培养72 h时正常TSB中形成了复杂的细菌黏附聚集体,呈现密集的“网状”结构,而pH 5.0乳酸-TSB组中的菌体呈现松散“网状”结构;培养168 h时正常TSB中“网状”结构更加密集,呈“云雾状”,而pH 5.0乳酸-TSB组与正常TSB相比,“网状”结构较松散,无“云雾状”形成。
通过两种培养液之间进行比较发现,两株菌均为pH 5.0乳酸-TSB组的菌膜形成明显弱于正常TSB组,形成过程慢、菌膜形成量少、结构较单薄,表明乳酸对菌株生物菌膜的形成具有抑制效应。而在两株菌之间比较发现,黏附力较弱的菌株CICC21530和黏附性较强的菌株J29形成生物菌膜的数量和结构变化明显不同,菌株CICC21530黏附少,且成熟期“网状”结构单薄,而J29黏附量大,且成熟期“网状”结构更致密,表明生物菌膜的形成过程表现出明显的菌株差异性。

图5 不同pH值时菌株CICC21530生物菌膜的CLSM图(600×)Fig. 5 CLSM images of biofilms formed by CICC21530 at different pH values (600 ×)

图6 不同pH值时菌株J29生物菌膜的CLSM图(600×)Fig. 6 CLSM images of biofilms formed by J29 at different pH values (600 ×)
3 讨 论
食源性致病菌生物菌膜比游离菌体对食品安全的威胁更大,菌体形成成熟生物菌膜的初始步骤是黏附于接触面[1-3],因此本研究首先对14 株大肠杆菌O157:H7黏附性能进行比较,发现14 株菌株均能在聚苯乙烯微孔表面产生黏附,表明这些大肠杆菌O157:H7都具有形成生物菌膜的能力,但不同菌株菌膜形成能力存在差异。杨沁南[18]采用微孔结晶紫法评价北京市市售鸡肉中的大肠杆菌黏附性能,Díez-García等[13]比较了69 株鸡源沙门氏菌黏附性能,李琼琼[19]研究112 株金黄色葡萄球菌菌膜形成能力,均发现不同菌株的菌膜形成能力具有较大差异。近年对肉类腐败相关的肠杆菌、鸡源性莓实假单胞菌的研究也发现不同菌株菌膜形成能力存在差异[20-21],这与本研究结果一致。然而,Lianou等[14]研究认为沙门氏菌生物菌膜的形成与血清型及菌株无关,这可能与各自研究中所用的测试菌株不同有关。致病菌的黏附特性应引起高度重视,因为食品加工设备表面会用到类似材质,如分隔板、传送带、集装框和包装袋等,由于清洗消毒不完全,残留的致病菌可发生黏附进而形成生物菌膜,引发食品安全风险。
食品加工工业中,食源性致病菌更倾向于黏附、生长于食品及加工器械表面,通过形成生物菌膜以应对外界各种不良环境的刺激[2,4]。本实验进一步选用中等黏附力的菌株ATCC43895为测试菌株,采用食品级不锈钢片为黏附表面,研究在长时酸应激环境中菌膜形成能力的变化。选用乳酸和盐酸分别作为有机酸和无机酸的酸应激代表物,设置系列pH值梯度,选择25 ℃(室温)为培养温度,在这些条件下研究大肠杆菌O157:H7的生物菌膜可获得与实际生产情况更为接近的信息,为了解实际食品加工环境中致病菌生物菌膜的形成状况提供更可靠的科学依据。
本实验结果表明无论是在有机酸还是无机酸环境中,菌株ATCC43895均能够黏附在不锈钢表面形成生物菌膜,且生物菌膜形成量显著依赖于pH值,其中酸度较强的有机酸(pH 3.5乳酸)可以明显抑制该菌株生物菌膜的形成,而在酸度相对较弱的有机酸(pH 4.5、5.0乳酸)环境中,该菌株可在很长一段时间内不断形成生物菌膜。王虎虎[22]研究沙门氏菌在酸应激条件下生物菌膜的形成时得到了相似结论。本实验结果表明,大肠杆菌O157:H7在较强的酸性环境中可在很长一段时间内不断形成生物菌膜,需要对这一结果引起重视。现代食品工业中有较多食品加工体系处于酸性环境中,如酸乳生产、发酵香肠加工、食醋酿造等。此外,有机酸和无机酸作为食品添加剂、防腐剂和消毒剂也被广泛应用于食品工业中,尤其是当酸性消毒剂使用后没有被完全清洗而残留在食品加工接触面上时,将会给食源性致病菌提供一个弱酸性生存环境[23-25],而在弱酸性环境中可以形成生物菌膜的食源性致病菌将会对食品安全造成极大的威胁。
本实验发现,菌株ATCC43895在相同pH值的乳酸和盐酸环境中其黏附能力也存在显著差异,这说明酸种类是影响大肠杆菌O157:H7成膜能力的关键因素。已有研究发现有机酸对细菌存活能力的影响比无机酸更大[26],另有学者指出,相对于无机酸而言,有机酸可以以未解离的方式进入菌体细胞,在细胞质内释放质子,使得胞内pH值迅速降低,从而对微生物代谢活动起到抑制作用而达到显著抗菌效果[27],不同的有机酸由于未解离分子结构不同,对大肠杆菌O157:H7生物菌膜形成的影响亦不同[23]。
随着CLSM技术的发展,研究者对细菌生物菌膜的微观结构进行了较多探索[28-31]。本研究应用CLSM对酸应激下不同黏附力的2 株大肠杆菌O157:H7生物菌膜结构变化规律进行比较发现,正常TSB培养液中2 种菌株均能形成一定形态结构的生物菌膜,而黏附力较弱菌株的菌膜形成量显著少于黏附力较强菌株(P<0.05),这与上述微孔板结合结晶紫染色法观察到的菌膜形成(图2)结论相一致。pH 5.0乳酸条件下,菌膜仍可逐渐形成,但菌膜形成量和微观结构与正常TSB组相比受到明显抑制,这与上述平板计数法观察到的酸应激下菌膜形成(图4)结论相符合。pH 5.0乳酸条件下,菌株CICC21530从培养24 h初始黏附到培养72 h时呈现片状、网状的菌膜结构,表明弱酸性环境中黏附性能较弱的菌株仍然能够逐渐形成菌膜;而黏附性能较强菌株J29在24~72 h逐渐形成大量菌膜,至168 h时形成大量黏附聚集体,导致其中死亡菌体的比例大大减少,故反而不易观察到其中的红色死亡菌体(图5、6)。为较好地观察到菌膜微观结构的动态变化,本研究采用pH 5.0弱酸性条件,实验结果提示一定浓度乳酸能够有效抑制大肠杆菌O157:H7生物菌膜的形成。当然其他菌膜抑制剂应用[31-32]或多种防控技术联合效应[9]值得进一步深入研究。
4 结 论
生物菌膜是食品加工中微生物交叉污染的源头,本实验结合食品加工实际环境探究较长时间酸应激对大肠杆菌O157:H7生物菌膜形成的影响。采用微孔板结合结晶紫染色法比较14 株大肠杆菌O157:H7黏附性能差异,结果发现黏附性能存在明显菌株差异。选取较强黏附力菌株J29,中等黏附力菌株ATCC43895和4 株较弱黏附力菌株,采用微孔板结合结晶紫染色法观察菌膜形成曲线,结果表明各菌株均在培养2 h开始产生黏附,但黏附性能不同的菌株其菌膜形成曲线呈现明显差异。选取中等黏附力菌株ATCC43895作为代表菌株,采用平板计数法观察酸应激对生物菌膜形成的影响,结果表明环境pH值越低,其浮游菌数和生物菌膜形成量越少,pH值相同时乳酸抑制效应显著高于盐酸。CLSM发现黏附能力较强的菌株J29和较弱的菌株CICC21530在酸性和正常TSB培养液中均能形成一定结构的生物菌膜,且前者的菌膜形成量多于后者,酸性条件成膜过程较正常条件(pH 7.2)时缓慢。本实验结果揭示了大肠杆菌O157:H7菌膜形成的菌株差异性,及酸应激时菌膜形成和微观结构的变化规律,可为酸性食品实际生产加工中大肠杆菌O157:H7风险评估提供理论参考,并为研究致病菌生物菌膜的有效防控技术提供科学思路。

