产耐热β-半乳糖苷酶蜜源芽孢杆菌的鉴定及酶学性质
李 云 , 朱少华 ,管政兵 ,蔡宇杰 , 廖祥儒 *
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
关键字:β-半乳糖苷酶;酶学性质;地衣芽孢杆菌
β-半乳糖苷酶 (β-galactosidase,EC 3.2.1.23),又称乳糖酶(Lactase),是一种重要的生物催化剂,具有催化乳糖水解和转糖苷两种重要的功能。工业上常利用其水解活性来减少乳制品中的乳糖含量及废水处理,具有重要的工业应用价值。β-半乳糖苷酶广泛存在于动物、植物及微生物中[1-2]。细菌、霉菌、酵母等微生物均有β-半乳糖苷酶的发现[2],而在乳酸菌、大肠杆菌和芽孢杆菌[3-4]等细菌中分布最为广泛。目前,来源于微生物的β-半乳糖苷酶备受关注,因具有酶源丰富、产量高、生产成本低、周期短等特点,而且生产不受季节、地理位置等因素的影响等[5]。因此,与其它来源相比,微生物来源的β-半乳糖苷酶在工业应用中极具优势。例如,乳品工业用于分解乳糖的β-半乳糖苷酶多来源于酵母、米曲霉、黑曲霉或乳酸菌。但以上来源的β-半乳糖苷酶往往存在稳定性差[6]以及酶活易受到降解产物葡萄糖或半乳糖的抑制,会限制β-半乳糖苷酶的工业应用[7-8]。因此,筛选具有高稳定性、耐受高浓度葡萄糖或半乳糖的β-半乳糖苷酶十分必要。
近年来,耐热β-半乳糖苷酶在乳制品生产中具有显著优势,并逐渐引起人们的研究兴趣。一般把最适温度在50℃以上的β-半乳糖苷酶称作耐热β-半乳糖苷酶。例如,来源于嗜热菌和霉菌的乳糖酶就具有较高的反应温度[9]。对芽孢杆菌来源的β-半乳糖苷酶的研究也逐步深入,已发现的特性有高转糖基活性、热稳定性及pH稳定性[10-13]。除了热稳定性外,耐高浓度葡萄糖或半乳糖抑制的β-半乳糖苷酶也是应用中急需的,而这方面的工作尚不深入[8]。有研究表明,蜂蜜来源的芽孢杆菌产生的果聚糖合酶具有较好的高糖耐受性[14]。Esawy的研究认为,蜂蜜是葡萄糖和果糖构成的糖过饱和溶液,其中分离的芽孢杆菌及其产生的酶等生物大分子很可能具有较好的糖耐受性。因此,作者以分离自蜂蜜的芽孢杆菌为资源,从中得到能够产耐高浓度单糖的β-半乳糖苷酶的安全菌株。
1 材料与方法
1.1 材料
1.1.1 菌种作者所在实验室保藏蜜源菌,是从蜂蜜中分离得到的芽孢杆菌菌株。
1.1.2 试剂乳糖、胰蛋白胨、酵母膏、ZnCl2、NaCl、KH2PO4、 K2HPO4·3H2O、CaCl2·2H2O、CuCl2·2H2O、MgCl2·6H2O、BaCl2·2H2O、KCl、MnCl2·4H2O、NiSO4·6H2O及CoCl2·6H2O:均为国产分析纯试剂;邻硝基酚 β-D-半乳糖苷(ONPG)、邻硝基酚(ONP):购买于上海生工;考马斯亮蓝R250:上海化学试剂公司进口分装。
1.1.3 仪器与设备紫外可见分光光度计UV-6000 METASH:上海元析仪器有限公司产品;PCR仪:美国Applied Biosystems产品;DYY-8C电泳仪、DNA水平电泳槽:北京六一仪器厂;立式蒸气压力灭菌锅:YXQ-LS-50上海博迅公司产品;组合式摇床:太仓市强乐实验设备有限公司产品;培养箱:LRH-250广东省医疗器械厂;恒温水浴锅:常州中诚仪器制造有限公司;超净工作台:苏州净化设备有限公司;JG-1A型高压细胞破碎机:宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 菌种鉴定
1)形态学和生理生化特征鉴定:将待测菌株划线于LB固体培养基,在30℃下培养2 d,利用电子显微镜观察菌株的形态。根据《伯杰细菌手册》、《常见细菌鉴定手册》和《微生物学实验教程》(第二版)中的方法对其生理生化特性进行测定。
2)16S rRNA基因鉴定:采用16S rRNA基因序列分析法,按试剂盒说明提取细菌DNA并以通用引物 F27 (5’-AGAGTTTGATCCTGGCTCAG-3’)和R1492(5’-TACGGCTACCTTGTTACGACTT-3)扩增细菌16S rRNA基因,扩增产物交由生工生物工程(上海)有限公司进行测序,序列测定结果通过BLAST进行同源比对分析,选取高同源性序列,利用MEGA4.0软件构建系统发育树。系统发育树的构建中采用邻接法(Neighbor-Joining method),并重复取样1 000次进行自展值(bootstrap value)分析,以评估系统发育树的置信度,确定菌种在进化过程中的位置[15]。
1.2.2 β-半乳糖苷酶活力的测定
1)粗酶液的制备:芽孢杆菌hb15液态发酵48 h后,取发酵液15 mL,于4℃、8 000 r/min离心10 min,收集菌体,用 0.1 mol/L、pH 7.0磷酸缓冲液洗涤两次。采用高压破碎,再于4℃、8 000 r/min离心10 min,上清液作为进一步实验的粗酶液。
2)酶活的测定:采用ONPG法,0.5 mL、pH 7.0的磷酸缓冲液和1.5 mL 0.25%的ONPG加入试管,30℃预热5 min,加入1 mL适当稀释的粗酶液,反应30 min后,加入1 mL 10%Na2CO3终止反应,用分光光度计测定吸光值(在波长420 nm处),以磷酸缓冲液代替酶液作对照[16]。
酶活定义:在上述条件下,1 min催化水解ONPG生成1 μmol ONP的量,定义为1 U。
通过对硝基苯酚标准曲线方程Y=0.828 3X-0.001 2(R2=0.999 9),以吸光度(OD 值)为纵坐标Y,ONP浓度为横坐标X计算酶活。
1.2.3 酶的纯化和酶学性质的测定
1)酶的纯化:将粗酶液经过硫酸铵分级盐析、HiTrap Q HP离子交换层析和Superdex G-200 10/300 GL凝胶过滤层析等方法进行分离纯化,得到纯酶,研究其酶学性质。
2)β-半乳糖苷酶的最适反应温度:将酶液分别在 25、30、35、40、45、50、55、60、65、70、75 ℃下与底物进行反应,然后参照1.2.2所述测定其酶活力,以最高酶活定义为100%,分别计算不同温度条件下β-半乳糖苷酶的相对酶活。
3)β-半乳糖苷酶的热稳定性:将酶液在30、40、50、60、70、80 ℃下分别放置 0.5、1.0、1.5、2.0 h,然后参照1.2.2所述测定其剩余酶活力,以初始酶活定义为100%,分别计算不同温度条件下放置不同时间的β-半乳糖苷酶的相对酶活。
4)β-半乳糖苷酶的最适反应pH:在最适温度条件下,测定β-半乳糖苷酶在不同pH值(3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0)下的酶活。将最高的酶活力定义为100%,分别计算不同pH值条件下β-半乳糖苷酶的相对酶活。
5)β-半乳糖苷酶的pH稳定性:将酶液的pH分 别 调 至 3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0,于 4 ℃下放置 4.0、8.0、12.0、16.0 h后,再将酶液 pH调至最适pH,然后参照1.2.2所述在最适温度和最适pH条件下测定其酶活,分别计算不同pH条件下放置不同时间β-半乳糖苷酶的相对酶活。
6)金属离子对β-半乳糖苷酶的影响:酶液中分别加入不同的金属离子 (Na+、K+、Co2+、Cu2+、Ca2+、Mg2+、Mn2+、Zn2+、Ba2+、Ni2+),使其终浓度为 2 mmol/L,4℃下放置5 min后,在最适温度和最适pH下测定酶活力,将不添加离子的酶活力定义为100%,分别计算不同离子条件下β-半乳糖苷酶的相对酶活性,考察金属离子对酶活的影响。
7)酶反应的动力学常数:在最适的反应温度和pH条件下,酶液与不同浓度的底物反应,其中ONPG 的 浓 度 为 0.5、1.0、1.5、2.0、3.0、4.0、5.0、6.0、7.0、8.0 mmol/L,参照1.2.2所述测定β-半乳糖苷酶水解酶活,之后采用Linewear-Burk双倒数作图,研究该β-半乳糖苷酶催化ONPG水解的反应动力学常数,求出β-半乳糖苷酶水解活性的动力学常数Km和Vmax。
2 结果与讨论
2.1 菌种鉴定
对实验室保藏的127株蜜源菌,利用X-gal平板筛选培养基初筛,30℃培养箱静置培养后观察,看是否有蓝色菌落出现。初筛得到3株菌,之后以ONPG为底物测酶活复筛,见表1。最终选取一株产β-半乳糖苷酶高的菌株,其编号hb15,对其进行菌种鉴定。

表1 各菌株酶活Table1 β-galactosidase activity of each strain
2.1.1 形态学和生理生化特征鉴定菌株hb15在LB培养基上形成圆形菌落,边缘不整齐,生长初期表面光滑,后期表面粗糙,有褶皱,菌体杆状,革兰氏染色阳性,大小为 0.8 μm×1.5 μm,以端生鞭毛运动,形成芽孢。其生理生化特征见表2。

表2 菌株hb15的生理生化特征Table 2 Physiological and biochemical characteristics of hb15
2.1.2 16S rRNA基因克隆及其序列分析PCR扩增获得菌株hb15的16S rRNA核苷酸片段,大小为1 438 bp。将其进行BLAST同源性序列比对,结果表明该序列与多个已发表的芽孢杆菌菌株的16S rRNA基因序列的相似性达到99%以上,如BacilluslicheniformisXmb047和BacilluslicheniformisML103A。选取7株模式菌和两株序列相似度高的菌株,通过MEGA4.0软件进行聚类分析和进化树构建,结果见图1。
结合该菌株的生理生化鉴定结果,确定该菌株为芽孢杆菌属中的地衣芽孢杆菌(Bacillus licheniformis), 命名为Bacillus licheniformisSYBC hb15。
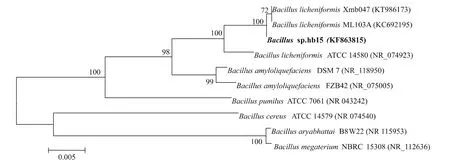
图1 基于16S rRNA基因序列对目的细菌构建的系统进化树Fig.1 Phylogenetic tree of the target strain based on 16S rRNA gene-sequencing analysis
2.2 β-半乳糖苷酶的分离纯化
2.2.1 硫酸铵饱和度的确定将粗酶液经不同饱和度的硫酸铵沉淀后,测定上清液β-半乳糖苷酶活力,结果见图2。
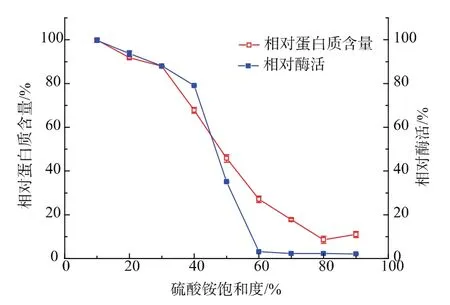
图2 硫酸铵分级盐析Fig.2 Ammonium sulphate salt fractionation
由图2可知,硫酸铵饱和度低于30%时,上清液中β-半乳糖苷酶活力基本没有下降;饱和度高于30%,上清液中的酶活开始下降,至60%饱和度时基本检测不到β-半乳糖苷酶活力,此时β-半乳糖苷酶沉淀完全。因此,确定β-半乳糖苷酶的硫酸铵分级盐析方法为:首先加入硫酸铵粉末至饱和度30%去除部分杂蛋白质,然后再添加硫酸铵粉末至饱和度60%沉淀β-半乳糖苷酶,用于后续的纯化。
2.2.2 HiPrepTM26/10 Desalting对蛋白质进行脱盐将硫酸铵沉淀得到的蛋白质溶于小体积的磷酸盐缓冲液,用HiPrepTM26/10 Desalting脱盐柱进行脱盐,脱盐柱是分子筛层析柱,β-半乳糖苷酶的脱盐柱层析见图3。将有β-半乳糖苷酶活力的活性峰收集,进行下一步的离子交换层析。

图3 β-半乳糖苷酶的脱盐柱层析Fig.3 Hi PrepTM 26/10 Desalting for β-galactosidase
2.2.3 离子交换柱层析据文献报道,细菌产β-半乳糖苷酶的等电点在5.7~6.0,pH的稳定范围6.0~8.0[17],因此选择了阴离子交换柱HiTrap Q HP对β-半乳糖苷酶进一步分离纯化,经优化条件选择缓冲液的pH为7,此时β-半乳糖苷酶带负电,上样之后结合到柱子上,梯度洗脱时随着盐离子的浓度增加酶被洗脱下来。
β-半乳糖苷酶经过阴离子交换柱层析结果见图4。确定梯度洗脱,在NaCl质量浓度为30 g/dL时酶被洗脱下来,将具有β-半乳糖苷酶活力的活性峰收集,超滤管浓缩,4℃保存,待进行Superdex G-200分子筛层析。

图4 β-半乳糖苷酶的HiTrap Q HP离子交换层析Fig.4 HiTrap Q HP ion exchange chromatography for β-galactosidase
2.2.4 凝胶过滤层析据文献报道,微生物β-半乳糖苷酶的相对分子质量范围广,在35 000~850 000[18-19],因此选择 Superdex G-200 10/300 GL凝胶柱做进一步的分离纯化。如图5所示,对各洗脱峰的酶活测定,经检测洗脱体积11~15 mL处洗脱出的单峰具有β-半乳糖苷酶酶活,收集活性峰,之后利用SDS-PAGE进行验证。

图5 β-半乳糖苷酶的superdex G-200凝胶过滤层析Fig.5 Superdex G-200 gel chromatography for βgalactosidase
利用凝胶过滤层析测定酶的相对分子质量,将该酶在Superdex G-200 10/300 GL凝胶柱中的洗脱体积12.460 5 mL代入到凝胶过滤蛋白标准曲线lgMw=-2.991Kav+5.936,Kav=(Vc-Vo)/(Vt-Vo),得到该酶的相对分子质量为114 500。
2.2.5 β-半乳糖苷酶分离纯化各步骤的总结B.licheniformisSYBC hb15产β-半乳糖苷酶的各步的分离纯化的结果见表3。

表3 B.licheniformis SYBC hb15产β-半乳糖苷酶的分离纯化结果Table 3 Purification of β-galactosidase from B.licheniformis SYBC hb15
由表3可知,粗酶经过硫酸铵分级沉淀、离子交换层析以及凝胶过滤层析等步骤分离纯化后,比酶活提高到121.4 U/mg,纯化倍数达38.65,回收率为31.48%。
将纯化各步骤所得的组分进行变性蛋白质电泳SDS-PAGE,结果见图6。经凝胶过滤层析收集到的样品在电泳图中呈现一条带,达到电泳纯。电泳纯度的β-半乳糖苷酶的迁移率Rf为0.771 1,相对分子质量标准曲线lgMw=-0.994 3Rf+5.523 0,求出该β-半乳糖苷酶的相对分子质量为57 000。结合凝胶过滤层析测定的相对分子质量约为114 500,推断该β-半乳糖苷酶为一个二聚体蛋白质。

图6 β-半乳糖苷酶的SDS-PAGEFig.6 SDS-PAGE for purified β-galactosidase
2.3 β-半乳糖苷酶的酶学性质
2.3.1 β-半乳糖苷酶的最适反应温度由图7可知,B.licheniformisSYBC hb15发酵产的β-半乳糖苷酶随温度升高催化活性增强,当达到60℃时,酶活力最高,是30℃时酶活的10倍。温度继续升高,酶活开始下降。因此,此β-半乳糖苷酶的最适反应温度为60℃。

图7 β-galactosidase的最适反应温度Fig.7 Optimal reaction temperature of β-galactosidase
报道认为芽孢杆菌等细菌产生的β-半乳糖苷酶最适催化温度一般为50~70℃[9],如表4所示,部分芽孢杆菌属的菌株所产该酶的最适反应温度较高,同样嗜热菌及真菌中霉菌所产的该酶也有很高的最适反应温度。在高温下,有利于缩短水解反应时间和减少污染的风险[20]。

表4 不同微生物来源的β-半乳糖苷酶的最适反应温度Table 4 β-galactosidases from different microbial sources and its optimal reaction temperature
2.3.2 β-半乳糖苷酶的热稳定性由图8可知,β-半乳糖苷酶在30~50℃水浴放置0.5~2 h,酶活力下降在10%以内。但在60℃水浴放置0.5 h后下降了25%,之后酶活力下降不显著;在70℃以上,酶活力下降明显,80℃下水浴0.5 h后酶几乎完全丧失活性。相比之前报道的Bacillus licheniformisDSM 13、Bifidobacterium longum和Bacillus megaterium2-37-4-1所产的酶有更高的热稳定性[21-22,27]。

图8 β-galactosidase的温度稳定性Fig.8 Thermostability of β-galactosidase
β-半乳糖苷酶是一种蛋白质,它的活性主要由具有特殊空间结构的活性中心决定,故其酶活的稳定性与蛋白质三维空间结构相关。而加热会改变蛋白质空间结构而使蛋白质变性,造成β-半乳糖苷酶失去活性。在食品实际发酵过程中一般要保持一定的温度以控制发酵周期与产品品质,因此要求所用的酶制剂必须具有较好热稳定性,从而β-半乳糖苷酶能够更好的发挥作用[28]。从实验结果可知,B.licheniformisSYBC hb15发酵产的β-半乳糖苷酶具有较强的热稳定性,具有良好的应用前景。
2.3.3 β-半乳糖苷酶的最适反应pH由图9可知,B.licheniformisSYBC hb15发酵产的β-半乳糖苷酶在pH 5.0~9.0范围内活性较高,但pH低于或高于6.0酶活力迅速下降,pH 6.0时表现出最高的催化能力,因此pH 6.0是最适反应pH,但当pH小于5.0或超过9.0时,酶基本失去了活力。一般认为细菌产的β-半乳糖苷酶的最适pH介于6.0~7.5。
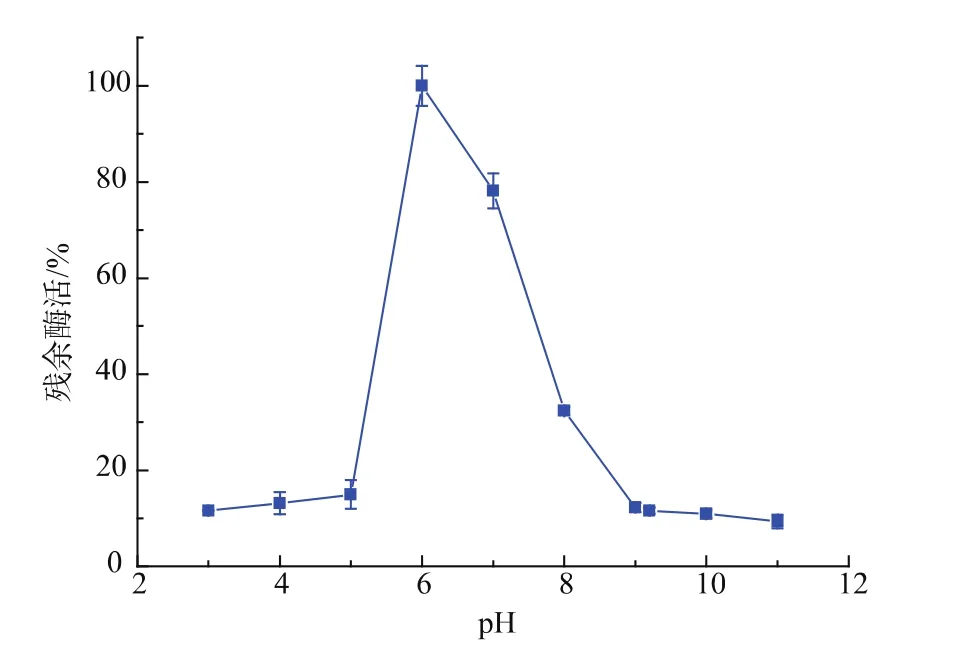
图9 β-galactosidase的最适反应pHFig.9 Optimal reaction pH value of β-galactosidase
2.3.4 β-半乳糖苷酶的pH稳定性由图10可知,B.licheniformisSYBC hb15发酵产β-半乳糖苷酶在pH 6.0~9.0范围内,酶活力较稳定。而Chunli Song报道的Guehomyces pullulans17-1所产β-半乳糖苷酶在pH 4.0~5.0之间有较高的活性并保持相对稳定。pH是β-半乳糖苷酶最重要的环境因素之一,对酶活性产生较大影响。当pH过高或过低时会通过改变酶活性中心而影响酶活性。因此为了使酶发挥最佳催化效果,必须了解其最适pH及其稳定性,并在实际应用中合理控制催化环境。

图10 β-galactosidase的pH稳定性Fig.10 pH stability of β-galactosidase
2.3.5 金属离子对β-半乳糖苷酶酶活的影响分别加入不同金属离子,测定其相对酶活力,见表5。结果显示:金属离子中K+对β-半乳糖苷酶酶活有明显的激活作用,可能K+会在β-半乳糖苷酶中形成盐桥从而稳定酶的立体结构,在一定程度上提高了酶活性。而Na+对酶活力几乎无影响,Mg2+、Ba2+、Zn2+、Ni2+有一定抑制作用,Co2+、 Cu2+、Ca2+、Mn2+对酶活力有强烈抑制作用,特别是Ca2+、Mn2+的抑制作用很强,可能它们破坏了酶活性中心,使蛋白质变性,酶活降低[28-29]。

表5 金属离子对β-galactosidase活性的影响Table 5 Effects of metal ions on β-galactosidase activity
2.3.6 单糖对β-半乳糖苷酶酶活的影响由图11可知,半乳糖和葡萄糖对β-半乳糖苷酶的水解酶活有一定的影响。可以看出,葡萄糖对该酶的水解酶活具有较弱的抑制作用,相对水解酶活均大于50%,而半乳糖对水解酶活具有较强的抑制作用,低浓度下就会使酶活降低到10%。Yi-Ning Dong报道半乳糖对β-半乳糖苷酶水解ONPG抑制作用比葡萄糖的强[30],也有报道的理论与此相反[31],并且葡萄糖对水解酶活的抑制作用随浓度的增大越来越显著。
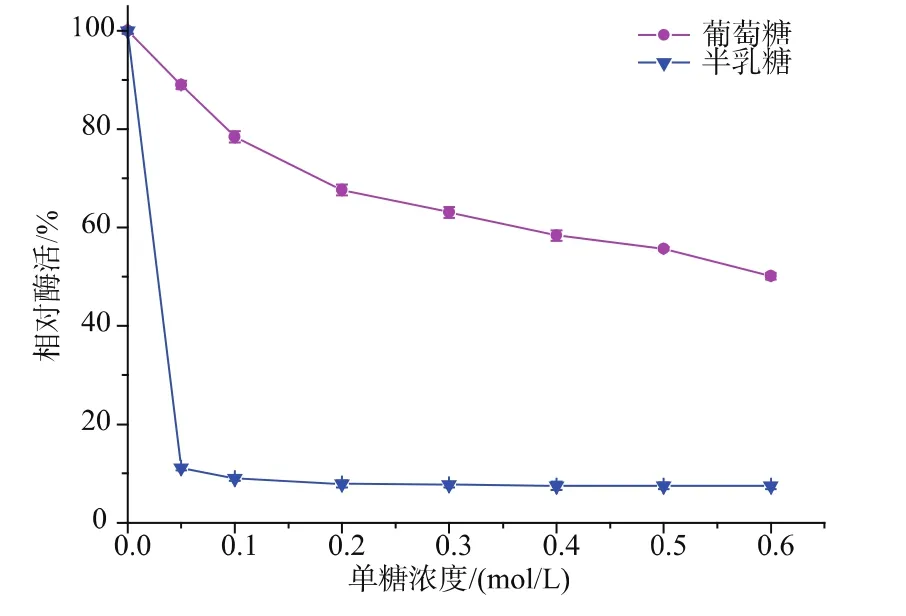
图11 葡萄糖和半乳糖对β-galactosidase活性的影响Fig.11 Effectsofglucoseandgalactoseonβgalactosidase activity
葡萄糖浓度为0.6 mol/L时,本研究酶的相对酶活为55.6%,与陈真真报道的同样葡萄糖浓度下宋氏志贺氏菌ShigellasonneiSK22.001所产的酶相对酶活55%相当[16],但蜜源菌株B.licheniformisSYBC hb15所产酶的安全性更好。Lactobacillus reuteri在半乳糖浓度200 mmol/L时相对酶活为45%,在葡萄糖浓度170 mmol/L时相对酶活为95%[32],而在葡萄糖浓度仅10 mmol/L时,所研究酶的相对酶活高于Talaromyces thermophilusCBS 236.58所产酶的58.3%[31]和Bifidobacterium longumCCRC 15708所产酶的97.5%[27]。同时,低聚糖合成过程中,半乳糖被大量消耗,使半乳糖的含量远远小于葡萄糖的含量,会降低其对酶的抑制作用。
2.3.7 β-半乳糖苷酶的反应动力学常数Km是酶的一个特征常数,Km的大小只与酶的性质有关,与酶浓度无关。Km近似表示酶与底物结合的亲和力大小,即Km值愈小,则酶与底物的亲和力愈大;反之,则越小。
由图12的回归方程求得该酶对ONPG的特征常数Km为 4.853 mmol/L,最大反应速率Vmax为14.705 μmol/(min·mg)。 Onladda Juajun 等报道的此酶以ONPG为底物时Km为13.7 mmol/L[21],另有Bacillus megaterium的 9.5 mmol/L[22]和BacillusNo.C-125 的 9.26 mmol/L[33],但Bacillus coagulans的仅为4.2 mmol/L[20]。可见该酶对底物ONPG的亲和性较大。(y代表1/V,x代表1/S)
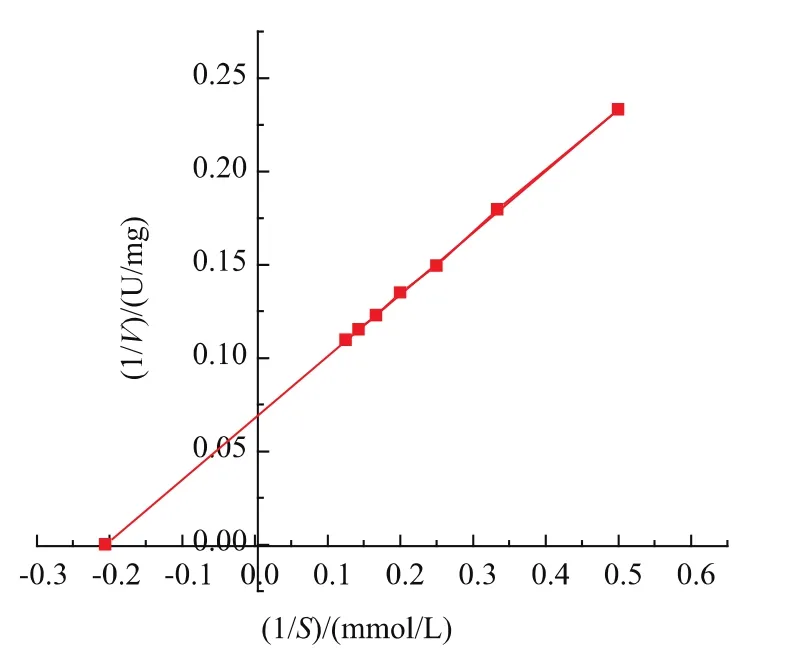
图12 β-半乳糖苷酶对ONPG的Lineweaver-Burk双倒数曲线Fig.12 Lineweaver-Burk plot of β-galactosidase using ONPG as substrate
3 结语
筛选到一株可产β-半乳糖苷酶的蜜源芽孢杆菌,对其进行生理生化及16S rRNA鉴定确定为地衣芽孢杆菌,在此基础上分离纯化酶,进行酶学性质研究。结果表明:β-半乳糖苷酶的最适水解反应温度是60℃;该酶具有较高的热稳定性;最适反应pH为6,在pH 6.0~9.0范围内酶活稳定;K+对此酶有明显激活作用;当葡萄糖浓度为0.6 mol/L时,酶活力仍然保持50%以上。因此,B.licheniformisSYBC hb15所产β-半乳糖苷酶属于一种耐热、耐葡萄糖的β-半乳糖苷酶。

