转录因子FOSB mRNA 5′非翻译区内部核糖体进入位点的活性
马 晶,孙柳柳,马文囡,陶义芬,陈 蕴,朱瑞宇,金 坚
(江南大学 药学院,江苏 无锡 214122)
小鼠骨肉瘤病毒癌基因同源物B(FBJmurine osteosarcoma viral oncogene homolog BFOSB或FOSB)是Fos转录因子家族的一员,与细胞的增殖、分化、转化及肿瘤发生密切相关。Fos家族包括4种转录因子:FOS、FOSB、FOSL1和FOSL2, 这些基因能够编码亮氨酸拉链蛋白,与其它蛋白质形成同源或异源二聚体,二聚体与靶基因的碱性激活因子-1(Activatingprotein-1,AP-1)结合,以调节靶基因的表达[1]。FOSB基因的蛋白质产物除全长的FOSB外,还存在一个在C端比FOSB短101个氨基酸残基的DeltaFOSB蛋白[2],它是一种FOSB的较短的剪切形式,但比FOSB更为稳定,在治疗慢性上瘾症状中扮演着重要的角色[3-6]。而FOSB基因不仅与药物成瘾相关,也与乳腺癌和卵巢癌的发生有关,在诱导因子的作用下会引起三阴性乳腺癌细胞的死亡[7-9]。最近研究发现,FOSB基因有望成为血管内皮瘤细胞及胃癌细胞的有效生物标记物[10-11],而对FOSB基因蛋白表达调控机制的研究,很少报道。
真核生物中经典的翻译机制是帽依赖型的翻译起始机制,需要mRNA上的帽子结构和真核翻译起始因子来招募核糖体进而起始翻译。然而在病毒中,存在着另一种更为高效的翻译起始机制,即非帽依赖型翻译起始机制,其mRNA并没有帽子结构,核糖体的40S小亚基直接通过识别mRNA序列结构或mRNA的5’非翻译区(5’UTR)起始翻译。其mRNA 5’UTR上核糖体能识别的序列称为内部核糖体进入位点((internal ribosme entry site,IRES)[12]。事实上,在真核生物中,也已发现许多转录因子的mRNA具有IRES活性,而这些转录因子大多与细胞增殖、分化、凋亡以及细胞耐药等有关,如血管内皮生长因子 (Vascular Endothelial Growth Factor,VEGF)[13]、NF-κB 抑 制 因 子 (NF-κB repressing factor,NRF)[14]、原癌基因 c-myc[15]、DNA 损伤结合蛋白 2(DNA damage-binding protein 2,DDB2)[16]、核糖体结合蛋白 1(Ribosome Binding Protein 1,RRBP1)[17]等。而已发现的IRES元件通常5’UTR偏长、GC含量丰富、二级结构复杂。FOSBmRNA 5’UTR符合上述IRES的基本特征,作者将FOSBmRNA 5’UTR的基因序列插入到研究IRES活性常用的双荧光素酶报告质粒(pRL-FL)中,检测其是否有IRES活性并初步探究其IRES的结构与功能。
1 材料与方法
1.1 实验材料
在实验室初期构建并保存真核表达载体即双荧光素酶报告载体pRL-FL以及去启动子载体pRL-FL△SV40;大肠杆菌DH5a:天根生化科技有限公司;DNA限制性内切酶NdeⅠ和EcoRⅠ:Fermantas公司;T4 DNA连接酶和prime STAR HS DNA聚合酶:TaKaRa公司;重组质粒pRL-FOSBFL:作者构建;重组质粒pRL-c-myc-FL:中美泰和购买,DMEM、RPMI1640培养基和胎牛血清:美国Gibco公司;人胚肾细胞HEK293、人卵巢癌细胞A2780/WT、人结肠癌细胞HCT-8/WT、人肝癌细胞Bel-7402/WT及宫颈癌细胞Hela/WT:均保存于作者所在实验室的液氮罐中;紫杉醇,顺铂药物:Sigma公司;LipofectamineTM 2000:美国Invitrogen公司;双荧光素酶报告基因检测试剂盒(Dual®Luciferase Reporter Assay System):美国Promega公司;其他试剂均为分析纯试剂。
1.2 表达载体的构建
FOSB 5’UTR cDNA 序列 (NM_001114171)由生工生物工程(上海)有限公司合成,合成序列含有NdeⅠ和EcoRⅠ酶切位点。FOSB5’UTR的全长基因序列和实验所需的各截短基因序列均以重组质粒pRL-FOSB-FL为模板进行扩增,在SV40启动子的载△pRL-FL上插入FOSB5’UTR的全长基因序列,构建△pRL-FOSB-FL;同时又载体pRL-FL上插入各截短片段,构建出的截短片段的重组质粒分别为 pRL-FOSB-J1-FL (-376 to-1)、pRL-FOSBJ2-FL(-592 to-217)、pRL-FOSB-J3-FL(-592 to-377)、pRL-FOSB-J4-FL (-188 to-1)、pRL-FOSBJ5-FL(-377 to-217)。将各重组质粒转化到感受态大肠杆菌Escherichia coliDH 5a中,涂板摇菌后,将菌液送至生工生物工程(上海)股份有限公司进行测序,质粒截短PCR所用引物见表1,其中下划线是NdeI和EcoRI的酶切位点和保护碱基。引物均由生工生物工程(上海)股份有限公司合成。

表1 构建截短质粒PCR所用引物序列Table 1 Oligonucleotide primers used in PCR for deletion plasmids construct
1.3 细胞培养与转染
人胚肾细胞HEK293、人卵巢癌细胞A2780/WT、人宫颈癌细胞Hela/WT培养于DMEM完全培养基(加10%的血清),而肝癌细胞Bel-7402/WT和结肠癌细胞HCT-8/WT培养于RPMI 1640完全培养基(加10%的血清),待细胞长至80%~90%时,用胰酶消化传代,待细胞再次长至80%~90%时,铺细胞于24孔板,铺板后第二天加入100 uL的opti-MEM,1 ug的质粒以及 2 uL的 LipofectamineTM 2000混匀,孵育25 min,加入已换好液的24孔板中,培养 18~24 h后将细胞用 1×PLB(Passive Lysis Buffer)裂解,收于-80℃待用。
1.4 双荧光素酶检测活性
在24孔板中铺细胞(70%~80%),细胞贴壁后(16~24 h)将质粒转染进细胞中,24 h后取出24孔板,用PBS洗两遍,可轻微振荡,并用枪头将残留PBS 吸干,加 100 uL 1×PLB(Passive Lysis Buffer)到每个孔中去裂解细胞,并在摇床上充分裂解15 min后,用枪头吹打板底并收集细胞裂解液,将待检样置于-80℃中保存。对双荧光素酶的活性检测时,准备干净的Corning Costar 96孔白板,先加入20 uL的细胞裂解液,接着将加过裂解液的孔板放在GloMaxTM_96孔板发光检测仪上,然后加入100 uL的萤火虫荧光素酶底物(LARⅡ),在充分混合后迅速地测定其荧光值,最后加入100 uL的反应终止液海肾荧光素酶底物(Stop&Glo®reagent),使之充分混匀后,再测其荧光值。IRES的活性以萤火虫荧光素酶活性与海肾荧光素酶活性的比值表示(即Fluc/Rluc)。
1.5 统计学分析方法
本研究所有的数据均用GraphPad Prism 5.0软件分析,统计数据采用SEM表示,组间比较采用Student t检验分析统计学差异。 *:P<0.05;**:P<0.005;***:P<0.000 5。
2 结果与分析
2.1 FOSB序列与结构分析
在NCBI里搜索FOSB序列发现,FOSB序列较长(592 bp)(见图 1(a))且 GC 含量偏高(56.5%),在各种族间序列同源性较高达到55.74%(见图1(b))。而用RNA Folding Form模拟其二级结构(见图 1(c)),可以看出 FOSB 5′UTR 可以形成稳定且复杂的二级茎环结构(ΔG=-202.87 kcal/mole),存在潜在的IRES元件。
2.2 FOSB mRNA 5’UTR IRES活性初步确定
FOSBmRNA 5’UTR是否含有 IRES活性,目前仍要借用工具质粒,而检测mRNA是否有IRES元件,国际上较为通用的是双顺反子报告载体的方法,由帽依赖型机制来起始载体中的第一个顺反子翻译,在载体上游顺反子的3’端和下游顺反子的5’端间插入有潜力的IRES元件,来介导下游顺反子的翻译[18]。而本研究中用到的双荧光素酶报告载体,上游是萤火虫荧光素酶(FL),下游是海肾荧光素酶(RL)。如图2(a)所示,在RL和FL之间有许多克隆位点,将基因目的片段克隆到I两个酶切位点(NdeI和EcoR)之间,通过两个荧光素酶活性比值的大小,来判断目的基因是否具有IRES活性,如FL比RL的活性较高时,可初步认为该目的基因有潜在的IRES元件。作者将FOSB5’UTR序列和阳性对照c-myc 5’UTR序列分别插入到报告载体pRL-FL两个阅读框中间构建目的载体pRLFOSB-FL、pRL-c-myc-FL(图 2(b)),其中阳性对照与阴性对照分别是pRL-c-myc-FL与pRL-FL。然后将这三种质粒分别转染进人胚肾细胞HEK293中,收集细胞裂解液,24 h后,接着通过双荧光素酶分析实验得到Fluc/Rluc的值。结果pRL-FOSB-FL活性远大于阴性质粒(***,P<0.000 5),且与阳性质粒pRL-c-myc-FL活性相似,初步确定FOSBmRNA 5’UTR中存在假定的IRES元件。
虽然双荧光素酶报告基因检测系统已相对成熟,但如果插入的检测序列中有内部启动子,就会在细胞内形成含有下游萤火虫荧光素酶的单顺反子mRNA的存在,从而影响实验结果的判断。为了排除这种潜在的可能性,于是将载体pRL-FL中的SV40启动子删除,从而得到新的载体ΔpRL-FL(图2(c)),接着仍将FOSBmRNA 5’ UTR 基因克隆到这个载体的两个酶切位点(NdeI和EcoRI)之间,如FL有高表达,则目的基因中有隐含启动子,反之没有内部启动子。将FOSB克隆到载体△pRL-FL上得到△pRL-FOSB-FL,分别将pRL-FOSB-FL与△pRL-FOSB-FL瞬转染入人胚肾细胞HEK293中,24 h后收集细胞并充分裂解,通过1.5实验步骤可得 Fluc/Rluc的值。如图 2(d)所示,△pRL-FOSBFL的RL与FL值均远小于pRL-FOSB-FL的值(***,P<0.000 5),所以FOSB不含有内部启动子,进一步证明FOSBmRNA 5’UTR具有IRES活性。

图1 FOSB mRNA 5’UTR序列与结构分析Fig.1 Sequence and structure analysis of FOSB mRNA 5’UTR
2.3 FOSB mRNA 5’UTR IRES活性中心的鉴定
对FOSB 5’UTR IRES元件活性中心域的的探究,通过RNA Folding Form软件来模拟FOSBmRNA 5’UTR全长序列的二级结构,并对其二级结构进行分析,分别构建了5个截短质粒:pRLFOSB-J1-FL(-376 to-1)、pRL-FOSB-J2-FL(-592 to-217)、pRL-FOSB-J3-FL (-592 to-377)、pRLFOSB-J4-FL(-188 to-1)、pRL-FOSB-J5-FL(-377 to-217)。将pRL-FOSB-FL以及各截短质粒瞬转染入人胚肾细胞HEK293与肝癌细胞Bel-7402中,24 h后收集细胞裂解液用于测定Fluc/Rluc(见图3(a)),两种细胞的测活结果基本一致。首先从5’端开始截短,发现-376至-1活性仅降为全长活性的75%左右,说明5’端可能对其活性贡献较大;继续截短发现在-188至-1活性降为全长的21%~30%,猜测可能中间片段对其IRES活性贡献更大;为了验证其3’端的重要性,对3’端进行截短,发现-592至-377活性下降了75%左右,证明3’端对其IRES活性确实重要,但是截到-217(即-592至-217)时活性又增加到全长的60%左右,怀疑其活性中心序列可能是位于中间的-376至-217,并将该片段插入到双顺反子载体pRL-FL中。如图3(b)所示,截短质粒-376至-217与全长活性相比,展现出为全长活性的70%~85%,从而判断确定其IRES活性中心为-376至-217,即-376至-217对最高活性的贡献较大。结果显示FOSB mRNA 5’端非翻译区-376至-217序列可能是其IRES活性重要活性区域,而其两端序列可能抑制其IRES的活性。

图2 FOSB mRNA 5'UTR IRES活性初步确定Fig.2 Activity of FOSB mRNA 5'UTR IRES preliminary determined
2.4 FOSB mRNA 5’UTR在各细胞中的IRES活性
从上述实验不难发现,FOSBmRNA 5’UTR在HEK293细胞与Bel-7402/WT细胞中IRES活性不同,其中在肝癌细胞Bel-7402/WT中活性较高。为了继续探究其IRES活性在癌细胞中是否是异常表达,作者将重组质粒pRL-FOSB-FL转染进另外3株癌细胞包括人卵巢癌细胞A2780/WT、人结肠癌细胞HCT-8/WT、人宫颈癌细胞Hela[19]。24 h后收集细胞裂解液,测定萤火虫荧光素酶和海肾荧光素酶的活性并计算其比值(Fluc/Rluc)。如图4所示,在不同细胞中FOSBmRNA 5’UTR IRES活性有着明显的区别,其中与HEK293细胞相比,A2780/WT中的活性较高(***,p<0.000 5),Hela 与 Bel-7402/WT细胞的活性也高于 HEK293 细胞(*,p<0.05;**,p<0.005)。而大多数文献报道[20],IRES的活性与细胞中 IRES 结合蛋白(IRES trans-acting factors,ITAFs)的表达量有密切关系,可能在这些癌细胞中,其ITAFs表达量较高,这需要进行进一步的研究。

图3 重组质粒pRL-FOSB-FL及其截短转染细胞的IRES的相对活性Fig.3 Relative IRES activities of cells transfected with recombinant plasmids pRL-FOSB-FL and its deletions
2.5 FOSB mRNA 5’UTR在细胞压力下的IRES活性
将重组质粒pRL-FOSB-FL转染进肝癌细胞Bel-7402/WT中24 h以后,分别用药物紫杉醇(PTX)和顺铂(DDP)处理细胞,PTX 的使用质量浓度分别为 0、0.25、0.5 ug/mL,DDP 的使用质量浓度为 0、0.5、1 ug/ml),加药培养 18 h,在两种药物中,随着药物质量浓度的增加,其IRES活性均呈现逐渐上升的趋势,见图5。说明IRES作为一种应激翻译起始机制,在药物刺激下FOSBIRES活性会增加,另外在紫杉醇刺激下比顺铂更为明显 (*,p<0.05;**,p<0.005),可能与药物不同的作用机制相关。
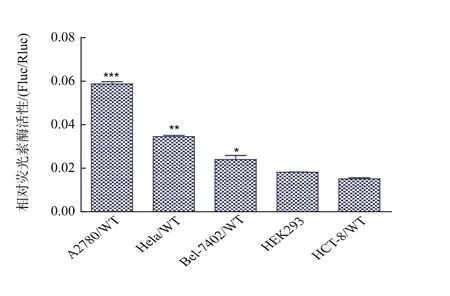
图4 重组质粒pRL-FOSB-FL转染各个细胞的荧光素酶的相对活性Fig.4 Rletive luciferase activity of pRL-FOSB-FL in various cell lines.(*,p <0.05;**,p <0.005;***,p <0.000 5;student t test).The expression data are presented asthemean + SEM oftriplicate samples

图5 细胞压力条件对Bel-7402细胞中FOSB IRES活性的影响Fig.5 FOSB IRES activity in Bel-7402 cells during different cell stress (*,p<0.05;**,p<0.005;***,p<0.000 5;student t test).The expression data are presented asthemean + SEM oftriplicate samples
3 结语
在真核生物内环境稳定状态下大多以帽依赖型机制进行翻译,而真核细胞处于细胞压力条件(低氧、饥饿、药物刺激),此时细胞的生长、分化及凋亡会使细胞的稳态迅速打乱。这时帽依赖的翻译效率会降低,而此时IRES介导的翻译却会增加,进而使细胞继续维持稳态环境。FOSB作为立早基因中的一员,在多种刺激后会立即表达,从而产生不同的转录因子,进而调控其他基因的转录与表达来维持细胞的生长、发育和分化[21]。最新的报道显示,FOSB基因在抗癌药物的刺激下在细胞增殖速率增加[22],故作者在研究FOSBmRNA 5'UTR活性的同时,对其进行加药刺激,发现其不仅具有IRES活性,并且其在抗癌药物(紫杉醇和顺铂)刺激下IRES活性增加,这或许与IRES是一种应激翻译机制,能够维持IRES在细胞压力条件下的基本表达密切相关。另外FOSB/ΔFOSB作为慢性成瘾的关键分子转换机制,在成瘾药物慢性刺激后出现累积现象,并表现出独特的高度稳定性[23],这暗示着FOSBmRNA 5'UTR的IRES活性可能与其在药物刺激下的稳定表达有关。
据文献报道,具有IRES活性的RNA有以下特征:1)富含 GC 碱基;2)较长的 5'UTR;3)二级结构较复杂。决定IRES功能的因素是IRES元件的序列结构以及其反式作用因子(ITAFs),故IRES元件研究的热门总是去寻找其序列结构抑或者机制上的共性。而作者通过截短分析发现了FOSBmRNA 5'UTR IRES活性中心位于其5'UTR的-376至-217之间,并通过将该片段连接到双顺反子载体再次验证-376至-217的IRES活性。相较于国内外已报道的细胞内的IRES元件,FOSBIRES元件在序列与结构上相似度均不高,但是通过在NCBI里面进行序列搜索,并在DNAMAN中对其物种间同源性进行比对,发现种族间相似性达55%以上,其同源性位置包括其活性中心,IRES的活性序列位于FOS基因种族保守序列中,这间接说明了FOSBIRES序列的保守性,暗示IRES元件在Fos家族中具有相对稳定性。
FOSB/Delta FOSB与药物成瘾的机制研究较多,而其与肿瘤形成的机制鲜少提到,其实FOSB与乳腺癌和卵巢癌的形成密切相关,而目前的研究显示,在FOSB基因在乳腺癌、卵巢癌、胃癌及肺癌等多种癌细胞中发挥重要的作用,这或使FOSB基因成为某些肿瘤的诊断标志物,用于肿瘤的预防。而本研究中选用不同的癌细胞测其IRES活性,发现FOSBIRES活性在不同的癌细胞中明显不同,在卵巢癌细胞中活性较高,这为其成为肿瘤诊断标志物提供了另一种思路。

