强化交联促进透明质酸凝胶的抗酶解能力
陆柳伸,郑梦玲,郝梦瑶,王 武,辛 瑜
(江南大学 生物工程学院,江苏 无锡 214122)
透明质酸(hyaluronic acid,HA)又称玻璃酸、玻尿酸,是由D-葡萄糖醛酸和N-乙酰葡萄糖胺以β-1,4和β-1,3糖苷键交替连接而成的线性高分子粘多糖[1],通常以钠盐形式广泛存在于动物组织的细胞外基质中,如皮肤、眼睛玻璃体、滑液和血液等[2]。其相对分子量一般在104~107之间。1934年Meyer和 Palmer[3]最先在从牛眼玻璃体中分离得到HA,由于HA特殊的理化性质[4-5],广泛应用于临床、诊断、食品和化妆品行业中[6-9]。目前,HA主要利用微生物发酵法进行大规模生产[10-11]。
HA是细胞外基质和细胞间质的主要成分,在维持细胞和组织的结构完整以及细胞内外的环境平衡中起到重要作用,并且对细胞的生理功能有重大影响。HA在水溶液中与水分子结合形成氢键,因此具有良好的保水性,经研究发现[12],HA分子可以保留其自身质量的500~1 000倍的水,被誉为“天然保湿因子”。HA在水溶液中呈网状结构,使其拥有特殊的流变学性质即粘弹性。HA具有保湿护肤、抗衰老的功能,还有营养皮肤、润滑性和增稠等作用,因此,富含透明质酸的化妆品目前在国际上被誉为“仿生化妆品”。注射用透明质酸凝胶已经广泛用于整形行业,如Restylane、YVOIRE、润百颜、海薇等国内外品牌。
人体中HA含量减少会使皮肤变得粗糙并产生皱纹,会导致关节炎、动脉硬化和脑萎缩等疾病,也会产生早老症[13-18]。为了补充人体内HA含量,可以通过口服透明质酸来补充,其效果明显,已在欧美、日本等发达国家应用于保健食品中。美国透明质酸保健食品在近几年有许多品牌上市,如Natural Max公司生产的Beauty Fast胶囊,Source Naturals公司生产的含HA的胶丸和片剂等。我国台湾和大陆也有产品陆续上市,如口服美容胶原透明质酸、瑞尔水缘胶囊等。
由于透明质酸凝胶在人体内会被自身透明质酸酶降解,从而限制了其应用[19-21]。为了增强凝胶的机械强度以及在人体内的滞留时间,目前常用BDDE以及DVS等交联剂进行交联[22-24]。为了进一步强化透明质酸凝胶的稳定性,作者拟采用初次交联-强化交联偶联的制备模式,见图1。在透明质酸凝胶成型后进一步加固凝胶颗粒的结构,以此来提高透明质酸凝胶的抗酶解能力。
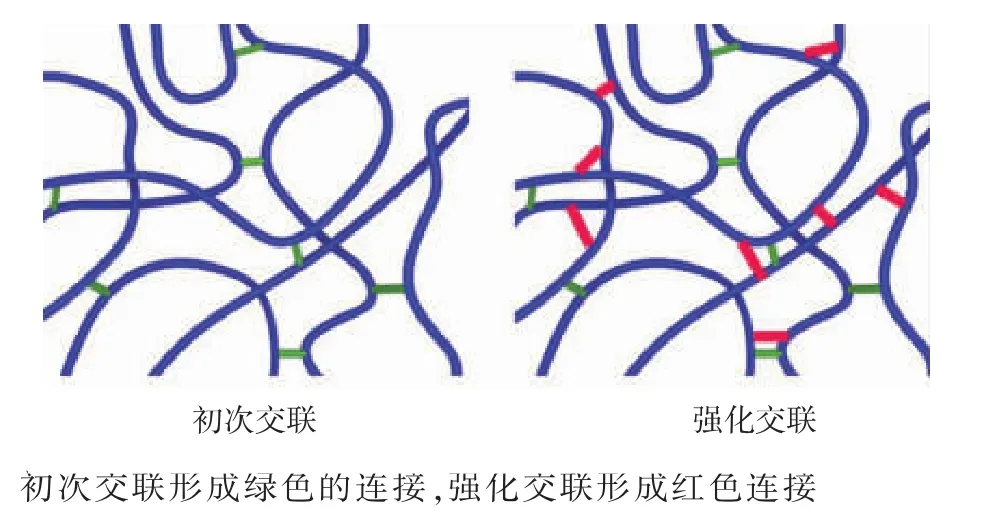
图1 初次交联-强化交联偶联的模式Fig.1 Schematic of the primary and enhanced crosslinking of HA
1 材料与方法
1.1 实验试剂
透明质酸(相对分子质量1.7×106):购自华熙福瑞达生物医药有限公司;润百颜、艾丽薇、海薇、瑞兰:福瑞达生物医药有限公司;1,4-丁二醇缩水甘油醚(BDDE)、透明质酸酶、小鼠胚胎成纤维细胞和葡萄糖醛酸:Sigma公司;遗传毒性Ames试剂盒:汇智泰康生物技术有限公司;无水乙醇、硫酸、氯化钠、氢氧化钠和硼砂等:由江南大学试剂科提供。
1.2 实验方法
1.2.1 透明质酸凝胶的制备及初次交联条件的筛选HA交联采用的工艺流程见图2。HA交联反应与NaOH的浓度、反应温度、反应时间及HA与BDDE的摩尔比有关。通过设计一个四因素四水平的正交试验来确定最佳交联条件,其因素水平表见表1。

图2 HA交联的工艺流程Fig.2 Process of crosslinking of HA

表1 HA初次交联的因素水平表Table 1 Factor level table for primary crosslinking of HA
1.2.2 透明质酸钠含量的测定透明质酸钠(SH)是由D-葡萄糖醛酸和N-乙酰氨基葡萄糖组成的非均一的物质,其中含有多种不同相对分子质量的透明质酸钠分子,因此不能用均一物质的测定方法来测量透明质酸钠质量浓度。采用改良的咔唑法[25-26]来测定透明质酸钠的质量浓度,透明质酸钠分子在酸性条件下被水解成 D-葡萄糖醛酸和N-乙酰氨基葡萄糖,其中D-葡萄糖醛酸能与咔唑发生显色反应,在530 nm波长处有最大吸收,且吸光值与D-葡萄糖醛酸质量浓度成正比,以吸光值(A)对葡萄糖醛酸质量浓度(C)做线性回归方程,得到回归方程:A=0.015 3C-0.007 2,R2=0.998 6。 表明葡萄糖醛酸质量浓度在0~50 μg/mL范围内,A与C呈良好的线性关系。此方法通过回归方程来确定葡萄糖醛酸质量浓度,进而计算出透明质酸钠的质量浓度。

式中,Ci为葡萄糖醛酸的质量浓度(μg/mL);401.3为透明质酸钠单体相对分子质量;194.1为葡萄糖醛酸相对分子质量;200为稀释倍数。
1.2.3 透明质酸凝胶强化交联为了提高交联透明质酸凝胶的理化性质,将初次交联所得的凝胶进行强化交联,并通过NaOH的浓度、反应温度、反应时间及HA与BDDE的摩尔比这4个因素来设计一个四因素四水平的正交试验,见表2,以此确定强化交联的最佳条件。

表2 HA强化交联的因素水平表Table 2 Factor level table for enhanced-crosslinking of HA
1.2.4 透明质酸凝胶的降解率取0.5 g HA凝胶,加300 U/mL的透明质酸酶溶液2 mL,37℃下反应24、48、72 h,取 0.2 mL 加无水乙醇 4.8 mL,用滤器过滤得到1 mL溶液,加PBS至8 mL,作为甲液。另取HA凝胶0.5 g,加0.5 mol/L的硫酸溶液10 mL,沸水浴水解15 min,定容至100 mL,作为乙液[27]。分别取甲液和乙液各1 mL,用改良的咔唑法测定溶液中糖醛酸的质量浓度。

1.2.5 透明质酸凝胶交联度的测定将最佳交联条件得到的凝胶用酸水解后,所得的甘油的量用气相色谱法检测[28],以此来确定交联度。
样品处理:取凝胶2.5 g,加2.5 mol/L HBr 5 mL,沸水浴水解50 min,用NaOH调节pH至中性,冷冻干燥,加4 mL无水乙醇过滤,滤液用于气相色谱测定。
色谱条件:色谱柱:HP-INNOWAX(30 mm×0.25 mm×0.25 mm);柱温:100℃;20℃/min程序升温至230 ℃,并保持 0.5 min;柱流速:8.0 mL/min;分流比:1∶1;进样量:1 μL;进样口温度:250 ℃;检测器温度:270℃;载气:氮气;检测器:氢火焰离子化检测器。
1.2.6 透明质酸凝胶的红外光谱将初次交联得到的凝胶和强化交联得到的凝胶冷冻干燥,做FTIR,与未交联的透明质酸作对比。
1.2.7 透明质酸凝胶的细胞毒性根据GB/T16886国家标准[29],透明质酸凝胶需进行体外细胞毒性测试。其中浸提条件:浸提介质为10%血清细胞培养液,浸提比例为每0.2克样品加1 mL浸提介质,浸提温度为37℃,浸提时间为24 h。采用小鼠胚胎成纤维细胞,用细胞培养液配制成1×104个/mL的细胞悬液,在96孔板中加入100 μL的细胞悬浮液。在37℃、5%的CO2培养箱中培养48 h,弃去原培养液,每孔加入200 μL的空白对照液以及透明质酸凝胶,每组设立8个孔。并在37℃、5%的CO2培养箱中培养48 h。接着加入20 μL噻唑蓝(MTT,质量浓度为5 mg/mL),置含 5% 二氧化碳培养箱,在(37±2)℃下培养 5 h,弃去孔内液体,并加入200 μL DMSO,用酶标仪在570 nm和630 nm处测吸光值,其结果根据细胞的相对增生率(RGR)来判断,见表3。其中2级毒性以内的测试材料生物安全性均符合要求。

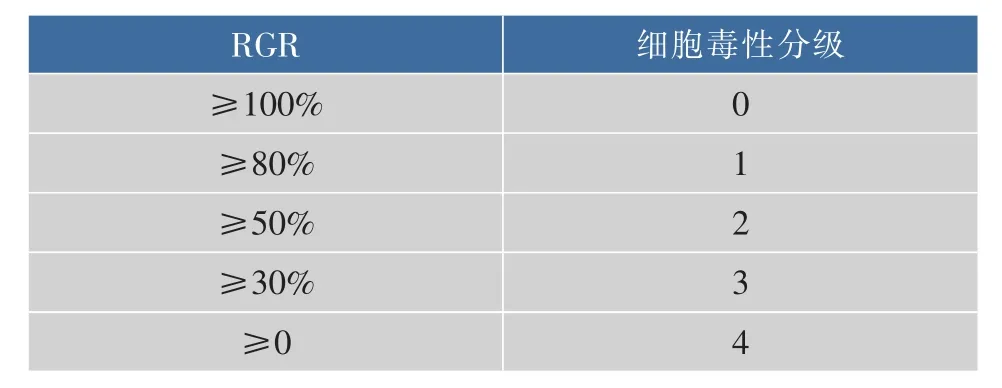
表3 细胞相对增生率与细胞毒性的分级关系Table 3 Relationship between cell relative proliferation rate and cytotoxicity grade
1.2.8 透明质酸凝胶的Ames试验根据GB15193.4的要求[30],采用平板渗入法在加与不加S9混合液的条件下对TA97、TA98、TA101和TA102共4株菌株进行Ames试验,并统计回变菌落数。受试物透明质酸凝胶设立 4 个剂量:5、50、500、5 000 μg/皿,同时设立空白对照 (自发回变)、溶剂对照(200 μL/皿的无菌水)以及阳性对照(2-氨基芴、甲基磺酸甲酯、敌克松、1,8-二羟基蒽醌)。其中每个剂量组做3个培养皿,并在相同条件下重复2次试验。其结果根据回变率(MR,受试物回变菌落数/自发回变菌落数)来判断,若MR≥2,则结果判断为阳性结果,若MR<2,则结果判定为阴性结果。
1.2.9 透明质酸凝胶的溶血实验乙醚麻醉兔后,自心脏抽取血液40 mL,加入4 mL肝素抗凝,用生理盐水洗涤,离心至上清液不显红色,取2 mL上清液加入到100 mL生理盐水中,即得2%的兔红细胞混悬液[31]。各取凝胶1 mL,加生理盐水至2.5 mL,在37℃恒温水浴30 min,加2%的兔红细胞混悬液2.5 mL,在576 nm处测其吸光值,并设立阳性对照组(蒸馏水)和阴性对照组(生理盐水),溶血度计算如下:

一般认为生物材料的溶血度小于5%,都是可以接受的。
2 结果与分析
2.1 透明质酸凝胶初次交联条件的筛选
HA的交联条件根据降解率(R,%)的大小以及透明质酸钠的质量浓度来选择。降解率越小,说明凝胶的抗酶解能力越高,结果见表4。可以看出,第9组实验得到的降解率在前3天都是最小的。通过极差分析可知,对交联反应的影响程度大小依次是NaOH的浓度、BDDE/HA、反应时间、反应温度。即NaOH的浓度影响最大,温度的影响最小。得到初次交联的最佳条件为:反应温度是50℃,NaOH的浓度是 0.1 mol/L,反应时间是 4.5 h,BDDE/HA 是 1∶2。采用此条件得到的凝胶有最好的抗酶解能力。此凝胶连续3 d的降解率分别为9.76%、16.79%、20.45%,透明质酸钠质量浓度为28.84 mg/mL,接近市场现有水平,见表5。所以选择此凝胶强化交联。

表4 HA初次交联Table 4 Primary crosslinking of HA

续表4

表5 市场上透明质酸凝胶产品中透明质酸钠的质量浓度及降解率Table 5 Content of HA and the degradation rate of HA with the products on the market
2.2 透明质酸钠质量浓度的测定
透明质酸钠的质量浓度可以通过测定葡萄糖醛酸的质量浓度来计算得到,目前市场上透明质酸凝胶产品中透明质酸钠的质量浓度见表5。筛选出抗酶解能力强并且透明质酸钠质量浓度接近目前市场现有产品的凝胶及交联条件。
2.3 透明质酸凝胶强化交联条件的筛选
以反应温度是50℃,CNaOH的浓度是0.1 mol/L,反应时间是 4.5 h,BDDE/HA 是 1∶2 为条件,将得到的透明质酸凝胶进行强化交联,所得的结果如表6所示。由表6可知,强化交联对初次交联的影响有增强作用也有减弱作用。其中第1组实验得到的降解率最小。通过极差分析可知,对交联反应的影响程度大小依次是反应时间、BDDE/HA、NaOH的浓度、反应温度。即反应时间影响最大,温度的影响最小。采用反应温度是35℃,CNaOH的浓度是0.05 mol/L,反应时间是 1.5 h,BDDE/HA 是 1∶8 的条件将得到。此凝胶连续三天的降解率分别为6.85%、7.56%、12.4%,透明质酸钠含量为29.03 mg/mL。

表6 HA强化交联Table 6 Enhanced-crosslinking of HA

续表6
2.4 透明质酸凝胶的交联度
所得的气相色谱图见图3。通过计算得到2.5 g凝胶酸解得到甘油的摩尔数分别是4.91×10-5mol和 8.53×10-5mol,HA双糖与甘油的摩尔比约为4.2:1,假设HA的羟基与BDDE中所有的醚键均开环反应,得到初次交联得到的凝胶的交联度为16.54%,强化交联得到的凝胶的交联度为54.52%。

图3 将透明质酸凝胶完全酸解后,通过气相色谱测定甘油的质量分数(6.0 min)Fig.3 Determination of cross-link degree After an acidic hydrolyzation,the glycerol content was determined by GC chromatography,and the glycerol peak was at 6.0 min
2.5 透明质酸凝胶的红外光谱分析
初次交联得到的凝胶、强化交联得到的凝胶以及未交联的透明质酸的FT-IR图谱见图4。从图4可以看出,在3 420-1cm附近有羟基O-H或N-H吸收峰,在1 660-1cm附近有C=O吸收峰,在1 400-1cm附近有C-N吸收峰,在1 050-1cm附近有C-O-C吸收峰。说明初次交联、强化交联后得到的凝胶的特征吸收峰与未交联的透明质酸的特征吸收峰基本一致,符合规定。

图4 红外光谱分析Fig.4 FT-IR spectra of different HA gels
2.6 透明质酸凝胶的细胞毒性
通过计算得到透明质酸凝胶的细胞相对增生率(RGR)以及毒性级别见表7。其中初次交联所得的凝胶在570 nm和630 nm处的RGR分别为88.9%和85.6%,均大于80%,为一级毒性,强化交联所得的凝胶的RGR在570 nm和630 nm处分别为85.5%和80.9%,均大于80%,为一级毒性,都符合要求。
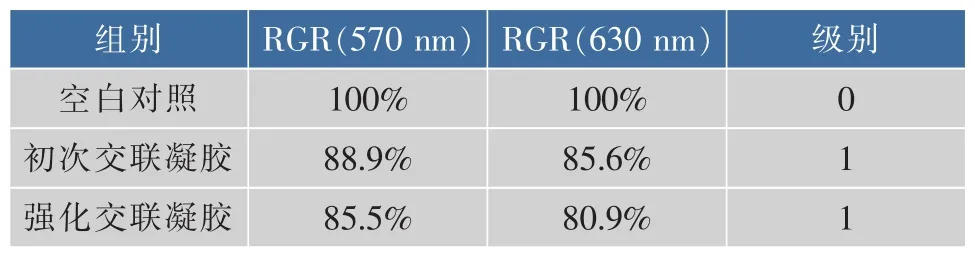
表7 透明质酸凝胶的细胞毒性分级Table 7 Cytotoxicity grade for HA gels
2.7 透明质酸凝胶的遗传毒性
其遗传毒性结果见表8。可知,初次交联和强化交联所得的凝胶在加与不加S9混合物的条件下,其回变率(MR值)均小于2,判定为阴性结果,没有明显的致突变性。
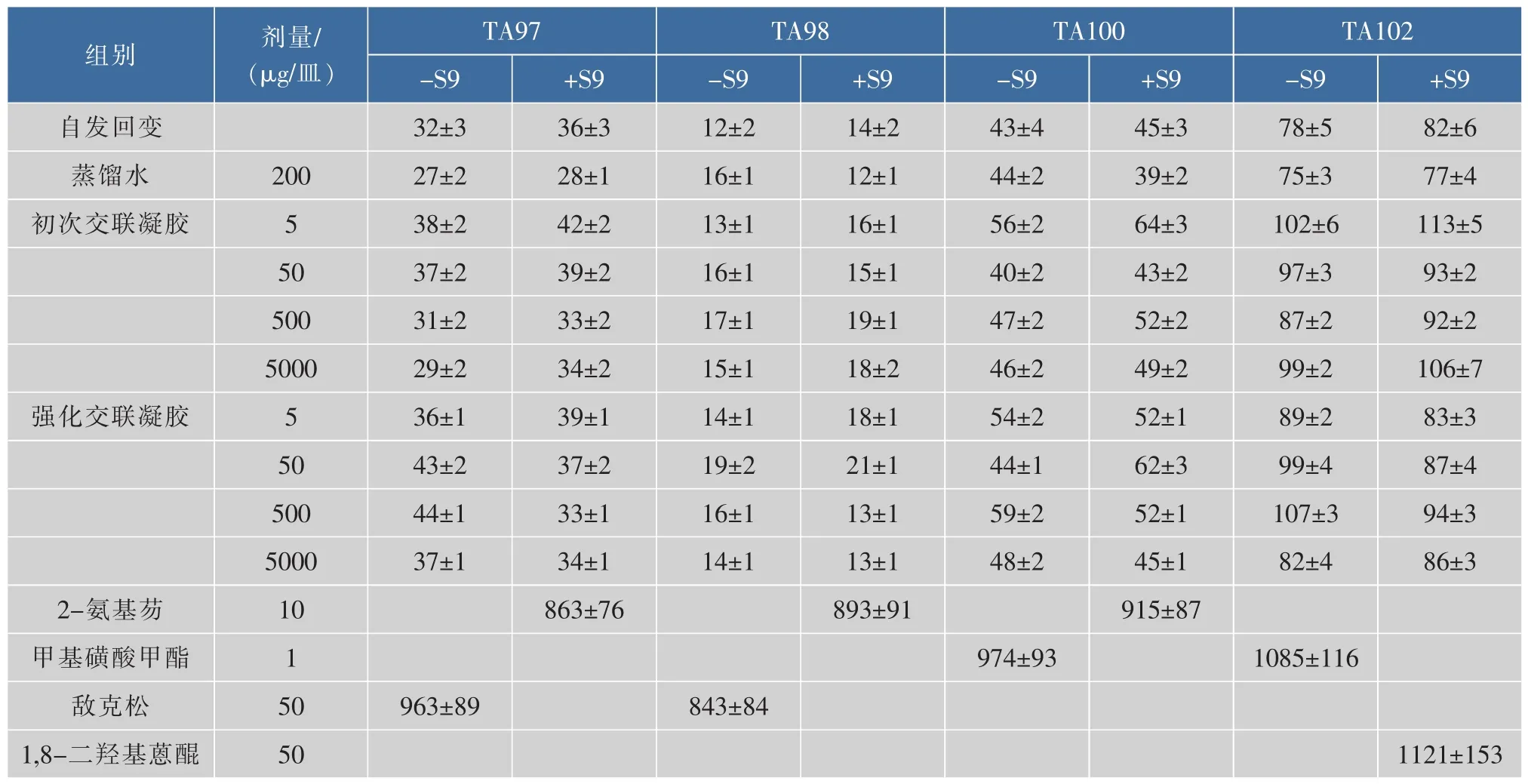
表8 透明质酸凝胶的Ames试验(x±s,n=3)Table 8 Ames test of HA gels(x±s,n=3)
2.8 透明质酸凝胶的溶血性
初次交联和强化交联所得的凝胶的溶血度见表9。其中溶血度分别为2.67%和2.60%,均小于5%,认为具有良好的生物相容性,没有明显的溶血性,符合一般生物材料溶血度的要求。

表9 透明质酸凝胶的溶血度Table 9 Hemolysis for HA gels
3 结语
通过初次交联-强化交联的偶联模式来制备透明质酸凝胶,得到初次交联凝胶和强化交联凝胶。设计四因素四水平的正交试验来确定初次交联的最佳条件:反应温度50℃,氢氧化钠浓度为0.1 mol/L,反应时间4.5 h,透明质酸与交联剂的摩尔比为2∶1;强化交联的最佳条件:反应温度35℃,氢氧化钠浓度为0.05 mol/L,反应时间1.5 h,透明质酸与交联剂的摩尔比为8∶1。并测得凝胶的透明质酸钠质量浓度从初次交联的28.84 mg/mL上升到强化交联的29.03 mg/mL,没有较大的变化。分别用透明质酸酶降解凝胶,发现强化交联的凝胶的降解率下降了30%左右,交联度提高了3倍多。其中初次交联凝胶的抗透明质酸酶降解效率接近市场现有水平,强化交联凝胶的抗透明质酸酶降解效率在原有水平有较大提升。通过FT-IR分析发现,凝胶的结构与HA相比基本没有变化,并且在细胞毒性、遗传毒性、溶血试验中,结果均符合要求。因此,本方法可以得到抗酶解能力强的凝胶,并且可以提高交联度。但是,透明质酸凝胶在人体内的滞留时间需要进一步通过实验证明。

