免疫组化和直接测序以及焦磷酸测序对IDH1突变的比较研究
赵焕英,方 霄,李慎涛,甄亚萍,李 峰,王雷明
免疫组化和直接测序以及焦磷酸测序对IDH1突变的比较研究
赵焕英1,方 霄1,李慎涛1,甄亚萍2,李 峰3,王雷明4
(1. 首都医科大学 中心实验室,北京 100069;2. 首都医科大学 临检中心,北京 100069; 3. 首都医科大学 神经生物系,北京 100069;4. 首都医科大学 宣武医院,北京 100053)
采用免疫组化法、直接测序法、焦磷酸测序法分别对弥漫性脑胶质瘤患者异柠檬酸脱氢酶1(IDH1)第132位精氨酸的突变进行检测。结果表明:3种方法对高频突变的检出一致性为90.62%,免疫组化只能检测出R132H突变类型,而两种测序方法都能检测出R132-其他类型的突变;焦磷酸测序检出灵敏度最高达3%,直接测序法最经济和简便,但灵敏度低,仅能检测突变率为20%以上的突变。建议先用免疫组化和直接测序初筛IDH1基因突变,对发现的低频突变用焦磷酸测序验证。
异柠檬酸脱氢酶1;免疫组化;直接测序;焦磷酸测序
脑胶质瘤是源于神经上皮组织的中枢神经系统最常见的恶性肿瘤,目前临床上胶质瘤常用诊断标准是根据组织形态分成良恶性程度不同的Ⅰ~Ⅳ级[1]。随着分子生物学研究的不断深入,现已发现不同类型胶质瘤存在不同的分子发病机制,而根据组织学形态特征分类,相同级别的胶质瘤也可具有不同的分子遗传学变异背景及生物学标志物[2]。随着临床精准医疗的开展,脑胶质瘤的诊断与治疗越来越依赖于临床分子诊断。如6-氧-甲基鸟嘌呤DNA甲基转移酶(MGMT)启动子甲基化、1p/19q共缺失、编码组蛋白家族H3.3/H3.1基因突变、异柠檬酸脱氢酶(IDH)基因突变等[3]。IDH1基因突变最为常见(约占全部IDH1/2基因突变的90%),而且主要是R132H(CGT>CAT)型(占全部IDH1基因突变的90%)[4]。另外还发现了R132C(CGT>TGT)、R132L(CGT>CTT)、 R132S(CGT>AGT)、R132G(CGT>GGT)等其他少见突变类型[5-6]。IDH基因突变后,酶活性发生改变,催化α-KG(α-酮戊二酸)生成D-2HG(羟基戊二酸)[7],大量异常水平的D-2HG积累影响细胞增殖分化的多条信号通路,导致肿瘤发生。此外IDH1突变可导致分化相关基因高甲基化等[8]。目前临床上IDH1突变不仅用于脑胶质瘤的诊断与鉴别诊断,也用于脑胶质瘤的预测疗效和预后评价,并有望成为神经胶质瘤治疗的靶点[9]。针对IDH1突变,临床常用的检测方法有免疫组化、直接测序、焦磷酸测序,但每种方法均有其优缺点,本文旨在比较三种方法的检测灵敏性以及实际应用效果。
1 实验材料与仪器
实验材料:32例形态学诊断为脑弥漫性胶质瘤(15例弥漫性星形细胞瘤、10例少突胶质细胞瘤和7例胶质母细胞瘤)的石蜡组织包埋标本由首都医科大学宣武医院病理科提供。
主要试剂:即用型鼠抗人IDH1R132H 单克隆抗体(克隆号:H09,德国Dianova公司),PV 6000抗鼠二抗(北京中杉金桥生物公司),蛋白酶K(merk),焦磷酸测序试剂(Qiagen 970902),Pyromark PCR kit (Qiagen, 978703)。
仪器:核酸提取试剂盒、Lab-Aid 824核酸提取自动提取仪(厦门至善生物科技有限公司),pGEMT-esay载体(Promega),石蜡切片机(Leica),紫外分光光度计(IMPLEN),PyroMark Q24测序仪、QIAxcel Advanced毛细管电泳(Qiagen),Quant Studio3D数字PCR仪、一代测序仪(ABI)等。
2 实验方法
2.1 石蜡切片准备
间隔保留10~15张、10 μm厚的胶质瘤组织切片粘在玻片上,用于后续的免疫组化;剩余的切片10~15张,用于后续的DNA提取。
2.2 免疫组化按照试剂盒操作流程
石蜡标本石蜡切片进行脱蜡处理后,柠檬酸盐抗原修复液进行抗原修复;以IDHl R132H特异一抗(1∶1000)4 ℃过夜,PV6000抗鼠二抗室温孵育2 h;二氨基联苯胺显色液控制显色,苏木精复染核,镜下观察IDH1R132H的表达情况。IDH1为胞浆蛋白,在胞浆及胞核部位着色为黄色、棕黄色或者褐色颗粒为阳性,并且明显高于背景为阳性细胞,观察切片中5个高倍视野(×200),阳性病例又可根据染色强度分为强阳性和阳性和弱阳性。
2.3 测序法
(1)设计合成IDH1 132 位点上下游引物。上游:5ʹ-accaaatggcaccatacga-3ʹ,下游:5ʹ-tgacttacttgatccccataagc-3,一代测序上机引物为上游引物;焦磷酸测序用下游引物5ʹ端标记生物素,上机测序引物为taaaccctatcatcata,引物由生工生物工程(上海)股份有限公司合成。
(2)DNA提取。石蜡标本二甲苯脱蜡后,蛋白酶K 55 ℃消化2 h,然后90 ℃、15 min灭活蛋白酶,离心后将上清加入至善生物核酸自动提取试剂条中第一孔,装入核酸自动提取仪中提取DNA。提取后用紫外分光广度计检测浓度和质量。
(3)PCR扩增IDHl片段。IDHl上游、下游引物扩增待测序片段。分别扩增直接测序和焦磷酸测序的IDH1片段产物,其中用于焦磷酸测序下游引物带生物素标记。扩增体系为Pyromark PCR kit中2×Master Mix 25 μL,10 pmoL/L上、下游引物各1 μL,DNA模板100 ng,补水至50 μL。PCR程序:95 ℃ 15 min,1个循环;95 ℃ 15 s,60 ℃ 20 s,72 ℃30 s,40个循环;72 ℃ 5 min,1个循环。PCR产物经毛细管电泳检测目的条带。一代测序利用测序试剂盒中bigdye mix,上游引物为测序引物,于ABI公司3700型测序仪进行测序。焦磷酸测序:首先将PCR扩增产物与连接链霉亲和素的小珠子进行振荡孵育20 min,后对双链DNA进行变性和清洗掉没有生物素标记的正义链,获取结合在小珠子上的反链DNA序列,80 ℃加热2 min,使单链DNA从小珠子上解离下来,并进而与测序引物结合。在PyroMark Q24测序仪上对引物结合单链DNA进行焦磷酸测序及结果收集。通过PyroMark Q24软件对序列进行分析。
(4)IDH1 R132H 测序标品的构建。构建IDH1 R132H 突变质粒和野生质粒,经测序验证有高突变的PCR IDH1片段;进行凝胶电泳、胶回收,回收PCR片段与PGEMT-easy载体进行连接,转化感受态DH5a细胞,铺板,进行蓝白斑筛选;挑取白色克隆在氨苄琼脂培养液过夜培养,提取质粒,通用引物SP6一代测序,直到测出R132H突变型质粒;然后阳性目标菌液再放大培养重新大量提取质粒,经数字PCR及Qubit核酸定量仪对标品进行绝对定量。
2.4 统计学方法
判读免疫组化阳性结果,分析脑胶质瘤各蛋白的表达情况。统计测序方法突变情况。采用SPSS 13.0 统计学软件进行数据处理和统计分析,计数资料采用百分数表示,测序方法突变检出阳性率的比较采用χ2检验。以<0.05为差异,有统计学意义。
3 结果与讨论
3.1 免疫组化学结果
32例脑弥漫性胶质瘤患者中,17例IDHl R132H免疫组化结果为阴性;其余15例IDHl R132H免疫组织化阳性,4例为强阳性,6例为阳性,3例为弱阳性,见图1。
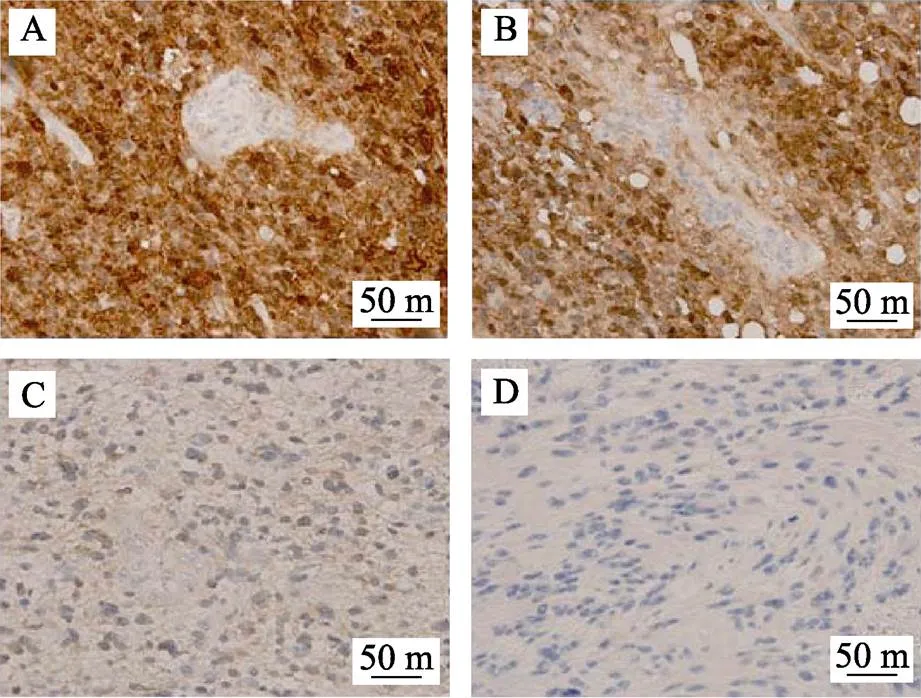
A-强阳性;B-阳性;C-弱阳性;D-阴性。
3.2 焦磷酸测序与直接测序结果
利用含生物素标记的IDH1引物样本DNA经毛细管电泳检测条带单一且大小为141 bp,继而进行生物素单链的获取,于PyroMark Q24测序仪上利用测序引物引导序列测定。图2为焦磷酸测序结果,图2中 E—H对应图1的A—D。图2中E显示CAT占86%,远远大于CGT 14%,跟图1A显示强阳性结果一致,图2中F对应图1B中阳性结果,CAT占55%,图2中G对应图1中C阳性,CAT占21%,图2中H中CAT检测1%,对应图1中D阴性免疫组化,一般商用的PyroMark检测试剂盒,其灵敏度都建议设在5%~10%之间,如MGMT[10],不同的研究者针对IDH1 132位点建立焦磷酸测序方法也有很多,报道的灵敏度一般不超过5%[11-12],有研究者检测灵敏度,甚至达到2%[13]。本方法建立中,构建IDH1野生和突变质粒,经过数字PCR绝对定量后,按比例两者混合,检测到突变灵敏度为3%。这可能与扩增产物的长度不同、标记的生物素位置不同、扩增产物的纯度不同、及测序引物不同导致的检测灵敏度会有差异。
图3为直接测序结果。

图2 焦磷酸测序结果

图3 直接测序结果
3.3 利用IDH1非生物素引物扩增后
电泳检测单一目的条带121 bp,进行 sanger一代直接测序,4个样品对应的一代测序结果见图3。图3中I和J明显看出有套峰,绿色峰是A碱基,蓝色峰是G碱基,这与图2的E、F测出的A碱基与G碱基比率结果类似,而图3K中A套峰很低,单从一代测序判断是否有突变不好判断,而图2G给出的A碱基突变率是21%,这与一代测序检测灵敏度低,对低于20%的突变易造成漏检,从而易产生误诊[14]。
3.4 3种方法
对32例样本检测结果比较见表1,其中17个未突变样本及12个阳性或强阳性R132H突变样本3种方法都能检测出,3个结果的一致性为90.62%;但免疫组化受限于抗体种类,只能检测R132H突变类型,仅检测CGT→CAT之间的突变,其他的突变类型不能检测,本组样本中有一例为CGT→AGT突变类型未测到。另外,免疫组化弱阳性的结果受限于检测者熟练程度及主观性的特点[5],比Pyromark 焦磷酸测序少检出一种。直接测序是目前应用最广的检测方法,需要靠有无套峰来判断,受测序基线干扰,经统计只有超20%以上的突变才能判断出是否由突变引起的套峰,这与其他作者的报道类似。对3种方法综合比较见表2。

表1 3种方法检测IDH1R132H突变结果

表2 3种方法检测IDH1突变优缺点
4 结语
目前临床上普遍开展的IDH1 突变检测是利用商业化的IDH1R132H 单克隆抗体进行免疫组化检测,但检测只限CGT→CAT突变类型。科研中直接测序因价格低廉和操作简便备受青睐,但对低频突变因检测灵敏度低会漏检。焦磷酸测序因其高灵敏度近几年不断在突变检测中被开发利用,尤其对低频突变它更有优势。因此建议先用直接测序或免疫组化进行初步检测,对弱阳性样本用焦磷酸测序验证。
[1] LOUIS D N, OHGAKI H, WIESTLER O D, et al. The 2007 WHO classification of tumours of the central nervous system[J]. Acta Neuropathol, 2007, 114(2): 97–109.
[2] VIGNESWARAN K, NEILL S, HADJIPANAYIS C G. Beyond the World Health Organization grading of infiltrating gliomas: advances in the molecular genetics of glioma classification[J]. Ann Transl Med, 2015, 3: 95.
[3] FUNATA N, NOBUSAWA S, NAKATA S, et al. A case report of adult cerebellar high-grade mutations produce 2-hydroxyglutarate [J]. Nature, 2009, 462(7274): 739–744.
[4] YAN H, PARSONS D W, JIN G, et al. IDH1 and IDH2 mutations in gliomas[J]. N Engl J Med, 2009, 360: 765–773.
[5] AGARWAL S, SHARMA M C, JHA P, et al. Comparative study of IDH1 mutations in gliomas by immunohistochemistry and DNA sequencing[J]. Neuro Oncol, 2013, 15(6): 718–726.
[6] BLEEKER F E, LAMBA S, LEENSTRA S, et al. IDH1 mutations at residue p. R132 (IDH1R132) occur frequently in high-grade gliomas but not in other solid tumors[J]. Hum Mutat, 2009, 30(1): 7–11.
[7] WARD P S, PATEL J, WISE D R, et al. The common feature of leukemia- associated IDH1 and IDH2 mutations is a neomorphic enzyme activity converting alpha-ketoglutarate to 2-hydroxyglutarate[J]. Cancer Cell, 2010, 17(3): 225–234.
[8] BORODOVSKY A, SALMASI V, TURCAN S, et al. 5-azacytidine reduces methylation, promotes differentiation and induces tumor regression in a patient-derived IDH1 mutant glioma xenograft [J]. Oncotarget, 2013, 4(10) : 1737–1747.
[9] TATEISHI K, WAKIMOTO H, LAFRATE A J, et al. Extreme Vulnerability of IDH1 Mutant Cancers to NAD+ Depletion[J]. Cancer Cell, 2015, 28(6): 773–784.
[10] LUQUAIN A, MAGNIN S, GUENAT D, et al. Analysis of MGMT methylation with the therascreen(®) MGMT Pyro(®) Kit (Qiagen): A method verification[J]. Ann Biol Clin, 2015, 73(6): 665–670.
[11] ARITA H, NARITA Y, MATSUSHITA Y, et al. Development of a robust and sensitive pyrosequencing assay for the detection of IDH1/2 mutations in gliomas[J]. Brain Tumor Pathol, 2015, 32(1): 22–30.
[12] SETTY P 1, HAMMES J, ROTHÄMEL T, et al. A pyrosequencing-based assay for the rapid detection of IDH1 mutations in clinical samples[J]. J Mol Diagn, 2010, 12(6): 750–756.
[13] 王丹慧,蔡彦宁,张燕莉,等, 异柠檬酸脱氢酶1 基因突变焦磷酸测序检测方法的建立[J].首都医科大学学报,2014, 35(4): 219–224.
[14] VAN DEN BENT M J, HARTMANN C, PREUSSER M, et al. Interlaboratory comparison of IDH mutation detection[J]. J Neurooncol, 2013, 112(2): 173–178.
Comparative study of IDH1 mutation by immunohistochemistry, direct sequencing and pyrophosphatic acid sequencing
ZHAO Huanying1, FANG Xiao1, LI Shentao1, ZHEN Yaping2, Li Feng3, WANG Leiming4
(1. Central Laboratory, Capital Medical University, Beijing 100069, China; 2.Clinical Inspection Center, Capital Medical University, Beijing 100069, China; 3.Neurobiology Department, Capital Medical University, Beijing 100069, China; 4. Xuanwu Hospital, Capital Medical University, Beijing 100053, China)
Mutations in 132 arginine of isocitrate dehydrogenase 1 (IDH1) in diffuse glioma patients are detected by immunohistochemistry, direct sequencing and pyrophosphate sequencing respectively. The results show that the consistency of the three methods is 90.62%. Immunohistochemistry can only detect the mutation type of R132H, and both sequencing methods can detect the mutation of R132-other types. The sensitivity of pyrophosphate sequencing is up to 3%. Direct sequencing is the most economical and simple method, but its sensitivity is low, which can only detect mutations with mutation rate of more than 20%. It is suggested that IDH1 gene mutation should be screened by immunohistochemistry and direct sequencing, and low frequency mutation should be verified by pyrophosphate sequencing.
IDH1; immunohistochemistry; direct sequencing; pyrophosphate sequencing
Q754
A
1002-4956(2019)10-0073-04
10.16791/j.cnki.sjg.2019.10.017
2019-02-26
赵焕英(1975—),女,河北邯郸,硕士,副主任技师,研究方向为分子测序。E-mail: zhaohy75@sina.com

