核磁共振结合血清肿瘤标志物及细胞因子检测在乳腺癌诊断中的应用价值研究*
王群拴 , 黎小花
1.陕西省铜川市人民医院医学影像科(铜川 727000);2.陕西省铜川市妇幼保健院检验科(铜川 727000)
乳腺癌是严重威胁女性生命健康的恶性肿瘤之一,乳腺癌发病早期多无症状,就诊时病期已相对较晚,而病灶的进一步转移又常常是致使乳腺癌治疗失败的主要原因[1]。因此早诊断、早治疗对乳腺癌的防治显得尤为重要。近年来随着影像学的快速发展,乳腺癌的早期诊断水平有了极大的提高。核磁共振(Nuclear magnetic resonance,MR)敏感度和特异度较高,但乳腺检查技术复杂且检查时间较长[2]。血清肿瘤标志物是临床上常用的乳腺癌检查指标,但其敏感性普遍较低[3]。近年来有研究表明,相关细胞因子水平对乳腺癌的诊断及预后具有重要的临床意义[4]。本研究拟探讨MR结合血清肿瘤标志物及细胞因子检测在乳腺癌诊断中的应用效果,现报告如下。
资料和方法
1 一般资料 选取2016年3月至2018年6月就诊于本院的乳腺肿瘤患者与同期体检健康者为研究对象。体检健康者40例设为对照组,年龄分布为25~75岁,平均年龄(60.1415.27)岁;乳腺肿瘤良性病变患者34例设为良性肿瘤组,患者年龄分布为28~79岁,平均年龄(56.7416.58)岁;乳腺癌患者45例设为乳腺癌组,患者年龄平均分布为30~81岁,平均年龄(57.4216.19)岁。患者纳入标准:①女性;②符合有关乳腺肿瘤的诊断标准,且经过病理活检确诊为良性或恶性。排除标准:①临床资料不完整;②患有精神类疾病或精神意识障碍;③心脏、肝肾等脏器患有严重疾病。两组患者均是在知情同意的情况下接受本次研究的,并签署有关知情同意书,本研究经过医院伦理委员会批准。
2 检查方法 检查前向患者讲解相关的注意事项,并告知患者身体上不要带金属物品。指导患者采用俯卧位,脚先进,双侧乳腺自然悬垂于线圈的双孔里。首先进行T1、T2加权成像和动态扫描。矢状面和横断面扫描后,注射对比剂并进行MR动态增强扫描,20 s 后扫描第一期,以后扫描余下5期。结束扫描后,对扫描后的图像进行处理、观察、测量与分析。
血清肿瘤标志物检测: 取三组全部对象空腹静脉血,离心,取血清,采用电化学免疫发光分析仪检测血清糖类抗原153(Carbohydrate anigen 153,CA153)、血清糖类抗原125(Carbohydrate anigen 125,CA125)、癌胚抗原(Carcino embryonic antigen,CEA)及细胞角蛋白19片段抗原21-1(Cytokeratin 19 fragmentantigen 21-1,CYFRA21-1)的水平,严格按照操作要求进行操作。阳性参考值:CA15-3>28 U/ml、CA125>40 U/ml、CEA>6 ng/ml、CYFRA21-1>3.5 ng/ml。
细胞因子检测:采用酶联免疫法检测:肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、白介素-6(Interleukin-6,IL-6)、白介素-8(Interleukin-8,IL-8)、人生长分化因子3(Growth differentiation factor 3,GDF3)水平。
采用联合法分析时,规定若其中一种方法检测结果为阳性,则联合检测结果为阳性。

结 果
1 三组血清肿瘤标志物水平比较 乳腺癌组患者的平均CA153、CA125、CEA及CYFRA21-1水平与对照组和良性肿瘤组均存在统计学差异(P<0.05),良性肿瘤组患者这4项指标与对照组比较无统计学差异(P>0.05),见表1。

表1 三组血清肿瘤标志物水平比较
注:与对照组比较,*P<0.05;与良性肿瘤组比较,#P<0.05
2 三组细胞因子水平比较 乳腺癌组患者4项细胞因子水平与对照组和良性肿瘤组患者对应指标均存在统计学差异(P<0.05),良性肿瘤组患者这4项指标与对照组患者对应指标差异无统计学意义(P>0.05),见表2。

表2 三组细胞因子水平比较(pg/ml)
注:与对照组比较,*P<0.05;与良性肿瘤组比较,#P<0.05
3 MR、血清肿瘤标志物及细胞因子单独检查和联合检查对乳腺癌的诊断效果 MR检测乳腺癌的敏感度、特异度及准确度均高于单独采用血清肿瘤指标和单独采用细胞因子指标检测,但差异不具有统计学意义(P>0.05)。三种检测方法联合使用,可以显著提高乳腺癌的敏感度、特异度和准确度(P<0.05),见表3。
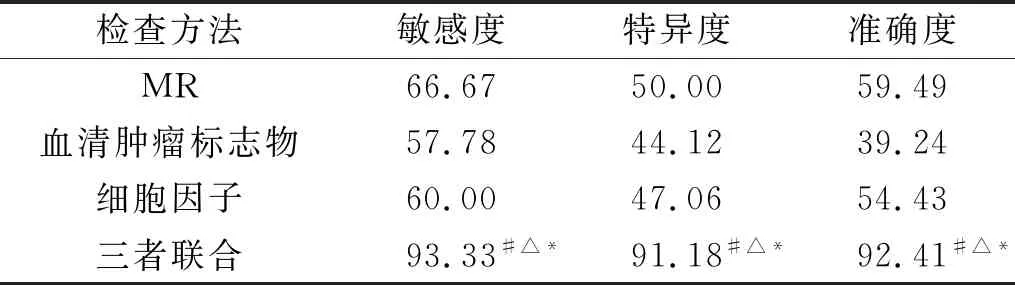
表3 MR、血清肿瘤标志物及细胞因子单独检查
注:与单独采用MR检测方法比较,#P<0.05;与单独采用血清肿瘤标志物检测方法比较,△P<0.05;与单独采用细胞因子检测方法比较,*P<0.05
讨 论
乳腺癌发病率为女性恶性肿瘤的首位,且近年来发病率持上升趋势[5]。临床诊断出的乳腺癌大多为中晚期,为随后的治疗带来了很大挑战。早发现,早确诊对乳腺癌针对性治疗及预后有着积极影响。
血清肿瘤标志物是肿瘤患者的癌细胞产物并释放到血液中的,正常人血清中含量较低[6]。一种肿瘤可以释放数种肿瘤标志物,而一种肿瘤标志物也可以出现于多种肿瘤中,所以,单一肿瘤标志物作为肿瘤的检测手段具有一定的局限性。因此近年来国内外学者一致认为多种肿瘤标志物联合检测是提高肿瘤诊断阳性率的有效手段[7]。CA153存在于乳腺、肺、卵巢和胰腺的恶性肿瘤细胞上,是一种较好的乳腺癌血清指标,可为乳腺癌的临床诊断及治疗提供辅助[8]。CA125来源于胚胎发育期体腔上皮,正常乳腺组织中不存在此种糖类抗原,因此其常见于上皮性乳腺肿瘤患者的血清中[9]。CEA是目前临床常采用的肿瘤标志物之一,其实质是一种酸性糖蛋白。有研究发现,CEA在肺癌、乳腺癌、膀胱癌和卵巢癌有较高表达。还有研究表明,乳腺癌患者血清中CEA含量与肿瘤的负荷和进展呈正相关关系[10]。CYFRA21-1是一种上皮性肿瘤标志物,其在正常情况下无表达或表达量较低,而在乳腺癌患者中表达较高,因此对于乳腺癌的诊断有一定的借鉴作用[11]。本研究中,乳腺癌组患者的4项血清肿瘤指标均高于临界值,且显著高于对照组和良性肿瘤组(P<0.05)。良性肿瘤组与对照组间这4项指标比较无统计学性差异(P>0.05)。这与孙小涵等[12]的研究结果一致。
TNF是由单核巨噬细胞产生的一种碱性多肽,是一种参与多种生理和免疫过程的重要介质。在正常情况下其对机体具有免疫应答的作用,但如果含量过多则会导致与其他细胞因子关系失调,进而引起机体发热等一系列反应[13]。TNF-α对肿瘤的作用具有双面性,一方面其可以抑制某些肿瘤的生长,而另一方面它又可以促进癌细胞的转移。有研究显示,乳腺癌患者的TNF-α水平显著高于正常人,且随着乳腺癌临床分期的增加而逐渐升高[14]。本研究中,乳腺癌组患者的平均TNF-α水平显著高于对照组和良性肿瘤组(P<0.05),而对照组和良性肿瘤组间比较无统计学差异(P>0.05)。IL-6是一种多功能的细胞因子,具有多种生物学活性。其主要由淋巴细胞、激活的巨噬细胞和血管内皮细胞产生,可促进炎症介质的释放。研究表明,IL-6与多种肿瘤的发生与发展密切相关,它可以通过干预血栓的形成、肿瘤特异性抗原的表达以及肿瘤细胞的增殖等方面来影响肿瘤的进展。肿瘤在增殖和浸润的过程中会产生和分泌内源性的IL-6,这是恶性肿瘤进一步恶化的标志之一[15]。IL-8属于趋化因子CXC基因家族的一种白细胞趋化因子,是一种二聚体糖蛋白。其可影响嗜中性粒细胞的趋化、脱落、释放及溶酶。同时还可加强炎症防护,并促进T细胞的趋化游走。在加强免疫反应及创伤愈合等方面具有重要作用。随着现代研究的深入,发现IL-8在多种恶性肿瘤组织中表达较高。研究还发现IL-8也是癌细胞分泌的一种重要的促血管生成因子,其可以通过自分泌和旁分泌两种方式影响癌细胞的浸润和转移,进而引起肿瘤病灶局部复发以及向其他地方转移,在乳腺癌的进展中起着重要作用,成为研究肿瘤发病机制及靶向治疗的研究热点[16]。本研究中乳腺癌组患者IL-6及IL-8水平显著高于对照组和良性肿瘤组(P<0.05)。GDF3是转化因子-β(GDF-β)中的重要成员,有研究发现其与脂肪生成及早期胚胎发育有着重要的关系,同时还在乳腺癌的发生发展中起重大作用。还有研究证明,乳腺癌患者血清中GDF3水平显著高于正常者和肿瘤良性病变者。分析表明这是由于癌变组织中GDF3释放后进入血清,致使患者血清中GDF3水平升高。这与本研究的结果一致。
现代临床上影像学检查是乳腺癌重要的诊断手段。MR是目前公认的检测早期乳腺癌的有效手段之一。其对软组织具有良好的分辨力,且无辐射,对检查者的身体无不良影响。MR对传统超声检查难以辨别区分的非典型病变,其可以从病变组织的形态学、信号强度表现、动态增强血流动力学及功能磁共振应用方面联合分析乳腺病变,在发现微小病灶方面有着显著的优势[17]。本研究联合三种检测方法,显著提高了乳腺癌诊断的敏感度、特异度和准确度。综上所述,MR结合血清肿瘤标志物及细胞因子检测对于乳腺癌的早期诊断有着积极地价值。

