糖尿病肾病患者血清铁代谢指标与尿蛋白排泄量相关性分析*
徐 琳,贺菲菲
西安市第四医院内分泌科(西安 710004)
糖尿病肾病(Diabetic nephropathy,DN)是诱发终末期肾病的首要病因,是导致糖尿病患者残疾、甚至死亡的首要并发症。据统计资料显示,目前全球1.71亿糖尿病患者中DN发病率最高可达42%[1]。及时发现、及时治疗是提高治疗效果,改善患者预后的关键;一旦进入明显的蛋白尿使其病情无法逆转,最终会进展为慢性肾功能衰竭。早期DN又称“持续微量白蛋白尿期”,因此尿微量白蛋白是DN早期诊断的重要生物学指标[2]。报道显示,机体铁超负荷会对胰岛素分泌和机体对葡萄糖耐受量产生影响,导致血糖升高,促进糖尿病发生发展及慢性并发症形成[3]。近年,多项报道显示,铁代谢在慢性肾病发生发展过程中扮演重要角色[4-5]。笔者通过分析DN患者血清铁代谢指标与尿蛋白排泄率的相关性,旨在寻求DN早期诊断和靶向治疗的关键。
资料和方法
1 一般资料 选择2016年4月至2019年1月西安市第四医院内分泌科临床确诊的106例2型糖尿病T2DM患者作为研究对象,其中男48例,女58例;年龄42~78岁,平均(58.33±10.62)岁。纳入标准:入选者均符合WHO糖尿病诊断标准。排除标准:合并恶性肿瘤、全身感染、甲状腺疾病等;合并血液系统、免疫系统疾病;原发性肾病;既往存在激素治疗或使用史;近期实施输血;近期接受铁制剂治疗;近期发生过心脑血管疾病或其它急性并发症。依据入选者尿微量白蛋白与肌酐比值将其分为尿蛋白正常组[<30μg/(mg·Cr)](31例)、尿蛋白微量组[30~300μg/(mg·Cr)](42例)和尿蛋白大量组(≥300μg/(mg·Cr))(33例)。采用分层年龄抽签法从同期健康体检人群抽选40例作为对照组。所有入选者均明确研究内容的前提下自愿签署知情协议书。各组入选者基线资料如表1所见,组间差异无统计学意义(P>0.05)。
2 研究方法 入选者均于空腹状态下抽取静脉血样5 ml,室温下离心取血清,用于测定血清铁(Fe)、铁蛋白(SF)、转铁蛋白(TRF)、可溶性转铁蛋白受体(sTfR)、空腹血糖(FBG)、糖化血红蛋白(HbAlc)、血尿酸。其中Fe使用亚铁嗪显色法测定;SF、TRF使用化学免疫发光法;FBG采用葡糖糖氧化法;HbAlc采用高效液相色谱法;血尿酸采用酶法。精确收集受试者24 h尿液,采用放射免疫法测定其尿蛋白排泄量(UAE),计算尿蛋白排泄率(UAER)。

表1 各组入选者基线资料对比
3 统计学方法 采用SPSS 20.0统计学软件包进行计数计量资料分析。各组间计量资料比较采用单因素方差分析,其中两两比较选择SNK法;各组间计数资料比较采用卡方检验。铁代谢指标与其他指标的相关性分析采用Pearson分析法。均以P<0.05为差异具有统计学意义。
结 果
1 各组受试者血清铁代谢指标测定结果比较 见表2。单因素分析显示,各组受试者血清Fe、SF、TRF、sTfR水平间差异均存在统计学意义(P<0.05)。两两组间对比,尿蛋白正常组Fe、TRF水平低于对照组(P<0.05),尿蛋白微量组低于尿蛋白正常组和对照组(P<0.05),尿蛋白大量组低于其它3组(P<0.05);尿蛋白正常组SF、sTfR水平高于对照组(P<0.05),尿蛋白微量组高于尿蛋白正常组和对照组(P<0.05),尿蛋白大量组高于其它3组(P<0.05)。

表2 各组受试者血清铁代谢指标测定结果比较
注:与对照组比,*P<0.05;与尿蛋白正常组比,#P<0.05;与尿蛋白微量组比,▲P<0.05
2 各组FBG、HbAlc、血尿酸和UAER水平比较见表3。单因素分析显示,各组受试者FBG、HbAlc、血尿酸和UAER水平间差异均存在统计学意义(P<0.05)。两两组间对比,尿蛋白正常组FBG、HbAlc、血尿酸和UAER水平高于对照组(P<0.05),尿蛋白微量组高于尿蛋白正常组和对照组(P<0.05),尿蛋白大量组高于其它三组(P<0.05)。

表3 各组FBG、HbAlc、血尿酸和UAER水平比较
注:与对照组比,*P<0.05;与尿蛋白正常组比,#P<0.05;与尿蛋白微量组比,▲P<0.05
3 血清铁代谢指标与FBG、HbAlc、血尿酸和UAER相关性分析 见表4。DN患者血清Fe与FBG、HbAlc、血尿酸和UAER均呈明显负相关,SF与FBG、HbAlc、血尿酸和UAER均呈明显正相关,TRF与HbAlc和UAER呈明显负相关,sTfR与HbAlc、血尿酸和UAER均呈明显正相关(P<0.05)。
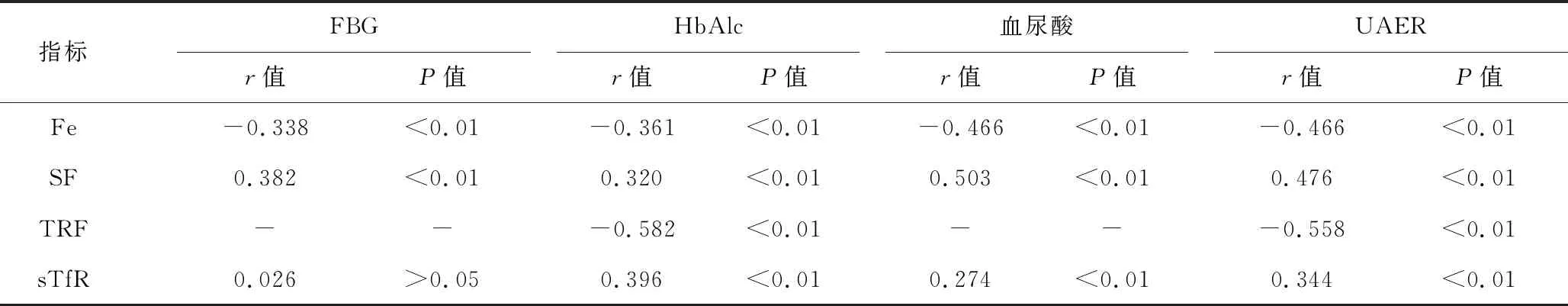
表4 血清铁代谢指标与FBG、HbAlc、血尿酸和UAER相关性分析
讨 论
Fe属于机体代谢所必须的微量元素,参与人体多项生理生化过程。近年来,随着基础医学发展,因铁代谢紊乱所致的功能失调和组织病理改变越来越受关注。且越来越多研究显示,Fe超负荷或缺乏均是影响慢性肾病患者病情进展及预后的重要因素[6-7]。DN是T2DM患者中发病率较高的微血管病变类并发症。肾小球系膜细胞异常增生、胞外基质增加、基底膜增厚、肾小球硬化等为DN的主要病理特征[8-9]。当机体受炎症和其他刺激时,体内氧化应激反应增强,血管基底膜发生脂质过氧化反应,造成肾小球基底膜在增厚,细胞膜受损[10]。铁作为机体的重要氧化剂,具有启动和催化机体氧化应激反应,加速活性氧形成的作用,因此浓度变化会对机体细胞内的物质交换产生影响,诱发肾脏血管内皮细胞功能异常,是导致T2DM血管病变的发病机制之一[11]。
正常状态下,机体铁代谢指标均维持在稳定范围内,当机体铁含量过高则会诱发毒性效应,损伤胰岛β细胞。UAER是评估DN病情的重要指标。进入血液中的铁绝大多数与血浆中TRF结合,由TRF与sTfR系统转送至身体各组织器官;剩余部分则被输送至骨髓、肝脾等组织中储存,或由肠黏膜细胞氧化后与脱铁后的SF结合后存储起来,因此虽然血清Fe可反应机体铁储备状态,但无法反应机体循环中可利用铁浓度[12]。血清SF是机体主要的铁存储蛋白,其含量受细胞内铁浓度影响。每个SF分子可存储4000多个铁原子,因此是反应机体铁含量和评估铁负荷的最敏感的指标;此外,SF还是一种应急反应蛋白,在机体受炎症或肿瘤刺激时其表达水平增高[13]。TRF水平可反应机体血液循环中蛋白结合铁的总含量。sTfR是细胞膜中的TRF受体水解后分泌至血液中的蛋白片段,可更好的反应机体Fe储备情况。当机体Fe存储减少时,sTfR水平会略升高,但随着组织存储Fe耗竭时,则sTfR水平会迅速升高[14]。因此可用于缺铁性贫血诊断、慢性贫血是否缺铁的鉴别、白血病和再生障碍性贫血预后的预判等。本研究结果显示,随着尿蛋白含量增加,血清Fe、TRF水平下降,该结果与张木勋等报道结果相一致[15]。分析原因:当患者肾脏受损时,机体促红细胞生成素合成下降,从而影响机体正常造血功能所致;同时,胰岛素分泌不足造成的氧化应激水平上升也会造成血液循环中游离Fe浓度进一步下降[16]。尿蛋白水平正常的T2DM患者血清SF水平明显高于健康对照组,且随着尿蛋白含量增加,DN患者血清SF水平明呈明显上升趋势,该结果与潘建新等[17]报道结果相一致。提示,机体血清SF可作为机体微血管损伤程度的良好指标,且其与DN发生发展密切相关。进一步相关性分析显示,DN患者血清Fe与FBG、HbAlc、血尿酸和UAER均呈明显负相关,SF与FBG、HbAlc、血尿酸和UAER均呈明显正相关,TRF与HbAlc和UAER呈明显负相关,sTfR与HbAlc、血尿酸和UAER均呈明显正相关。Fe存储过量会导致肝脏介导的胰岛素抵抗作用增强,机体对葡萄糖的利用率下降,游离脂肪酸产生过量,进而导致患者肾脏重吸收及排泄异常[18]。血尿酸水平上升是对机体氧化应激产物增加的一种代偿。DN患者体内氧化应激水平升高,导致SF合成增加,作为该异常代谢的代偿机制血尿酸水平亦会明显上升[19]。
综上所述,DN患者体内铁代谢指标随UAER增加而变化,因此可作为预测DN发生发展的预测指标,有利于疾病早期干预和患者预后改善。但受时间和条件限制,关于铁代谢指标与DN间的因果关系、铁代谢指标在DN中的作用机制等方面尚未有明确结论。

