α-平滑肌肌动蛋白在呼吸道合胞病毒感染小鼠肺组织中的表达及意义*
卢飞艳,蒋铁汉,宋文秀
遵义医科大学第五附属(珠海)医院(珠海 519100)
呼吸道合胞病毒(Respiratory syncytial virus,RSV)是人类呼吸道感染的重要病原体之一,是婴幼儿下呼吸道感染最常见的病因,也在儿童支气管哮喘的急性发作中起着重要作用[1]。大量临床研究证实,婴幼儿时期患RSV毛细支气管炎(以下简称毛支炎)与儿童时期患支气管哮喘密切相关[2]。RSV毛支炎与哮喘患儿体内存在共同的炎性细胞因子紊乱,即RSV毛支炎与哮喘在发病机制上具有极强的相关性[3]。
越来越多证据表明,RSV感染和支气管哮喘的发生具有密切的关系,气道炎症和气道重塑是哮喘发病的两个重要的病理学特征,机体反复出现持续的气道炎症,一定程度上会让气道的相关组织学结构发生改变,从而导致气道重塑,而机体出现气道重塑是影响哮喘临床治疗效果的重要因素之一[4-5]。α-平滑肌肌动蛋白(α-Smooth muscle actin,α-SMA)是气道平滑肌细胞的特征性标志物,正因为α-SMA的表达与哮喘气道重塑关系密切,α-SMA已被认为是反映哮喘气道重塑的重要指标[6]。本文通过检测α-SMA在RSV感染小鼠肺组织的动态表达,观察α-SMA在RSV感染后肺组织的变化,探讨α-SMA是否参与了RSV感染小鼠的发病过程。
材料与方法
1 材 料 48 只健康雌性BALB/c 小鼠(15~20 g,4周龄,购自广东省动物实验中心);水合氯醛、4%多聚甲醛购自上海宝曼生物公司;RSV A2株购自广州博特生物科技有限公司;Masson三色染色试剂盒购自南京森贝伽生物有限公司;α-SMA兔抗小鼠一抗抗体、SABC免疫组化试剂盒、PBS缓冲液、枸橼酸盐缓冲液均购自武汉博士德生物技术有限公司;无水乙醇、伊红染液、Harris 苏木精染液均由遵义医科大学珠海校区病理教研室提供。
2 实验方法
2.1 动物分组:查阅参考文献[7]中关于RSV感染小鼠模型的制备方法进行。48只体重 15~20 g的雌性 BALB/c小鼠,按照完全随机法将小鼠分为两组(每组 24 只):对照组(生理盐水组)和观察组(RSV感染组)。感染组小鼠予行腹腔注射麻醉,然后经鼻腔滴入100 μl 106PFU的RSV;对照组小鼠予相同方法麻醉后,经鼻腔滴入相同剂量的生理盐水;分别在四个时间点(第 4天、第8天、第14天、第28天)处死小鼠(每个时间点生理盐水组和观察组各6只)。
2.2 取材及制片:将已处死的小鼠左主支气管及左肺分离出,切下左肺后固定于4%多聚甲醛中。
2.3 小鼠肺组织HE染色:将固定的左肺24 h 后取出,分取小块肺组织,常规梯度酒精脱水、透明、石蜡包埋、切片,展平固定于玻片上,干燥,脱蜡、梯度酒精直至蒸馏水,HE染色,封片,光镜下观察支气管-肺组织病理改变。
2.4 小鼠肺组织Masson染色:肺组织切片脱蜡至水,Weigert铁苏木素染液染色,酸性乙醇分化液分化、水洗,氨水溶液返蓝、水洗。然后再用蒸馏水洗,丽春红酸性品红染色液染色,0.5%冰醋酸水溶液冲洗,磷钼酸溶液冲洗,0.5%冰醋酸水溶液洗。 将标本直接放入苯胺蓝染色液中染色,0.5%冰醋酸水溶液洗,脱水、透明、封固。光镜下观察、采图、分析计算。
2.5 免疫组化法检测肺组织 α-SMA的表达:烤片 2 h;TO型透明剂脱腊 2次,无水乙醇、95%乙醇、80%乙醇、75%乙醇、蒸馏水依次浸泡;滴入3%过氧化氢溶液,室温孵育10 min,蒸馏水洗;切片置于EDTA抗原修复液中,用微波炉进行加热,直至沸腾后断电,间隔5 min后重复1次;PBS冲洗;滴加5% BSA封闭液;滴加一抗,4℃冰箱过夜,PBS液冲洗;滴加二抗,孵育20 min,PBS液冲洗;滴加试剂SABC,37℃恒温箱中孵育20 min,PBS液冲洗; 滴加DAB显色液,显色后用蒸馏水冲洗;苏木素复染,自水来冲洗至水清;1%盐酸乙醇分化2~3 s,自来水冲洗;常规梯度乙醇脱水,透明,风干后封片;阴性对照的一抗用PBS液替代;显微镜下阅片、采图、分析计算。

结 果
1 HE染色观察各组肺组织结构 生理盐水组:可见完整的气道壁结构,光滑、完整的细支气管管壁,气管平滑肌无明显增厚,无明显炎症细胞浸润(见图1)。RSV 感染组:气管平滑肌明显增厚,黏膜皱褶增多,细支气管可见较多以淋巴细胞为主的炎性细胞浸润,部分肺泡腔变狭窄或消失,肺泡壁及肺泡间隔可见充血、水肿、不均匀增厚。感染第4天可见炎性细胞浸润,第 8 天时最为明显,之后炎症浸润逐渐减轻,至第 28天仍可见炎症表现(见图 2)。
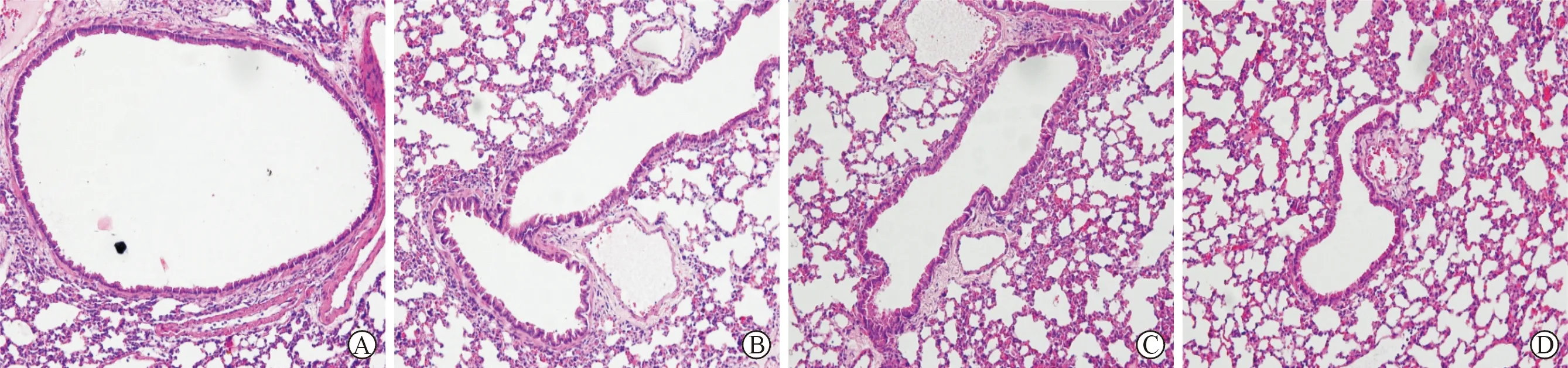
A:生理盐水组 4 d B:生理盐水组 8 d C:生理盐水组 14 d D:生理盐水组 28 d

A:观察组 4 d B:观察组 8 d C:观察组 14 d D:观察组 28 d
2 Masson染色法观测各组气道外周胶原沉积面积结果 生理盐水组(见图 3):气道壁周围在各时间点可见散在少许蓝色胶原沉积,各时间点气道外周胶原沉积面积百分比比较无明显差异(P>0.05);RSV感染组(见图 4):气道外周胶原沉积面积百分比在感染的第4天、第8天及第14天逐渐增加,与对照组相应时间点两两比较,差异有统计学意义(P<0.05),感染第28天气道外周胶原沉积面积百分比明显减少,与对照组相应时间点比较,差异无统计学意义(P>0.05)。感染组各时间点比较,各时间点差异有统计学意义(P<0.05),见表 1。

A:生理盐水组 4 d B:生理盐水组 8 d C:生理盐水组 14 d D:生理盐水组 28 d

A:观察组4 d B:观察组8 d C:观察组14 d D:观察组28 d

组 别n4d8d14d28dF值P值对照组62.01±0.192.12±0.232.05±0.242.18±0.290.160.85感染组64.56±0.75*△7.21±1.01*△10.56±0.47*△2.3±0.38*△121.080.01t值-7.5710.6125.560.28--P值-0.010.000.000.67--
注:与对照组比较*P<0.05,感染组各时间点比较△P<0.05。
3 RSV感染组及对照组各时间点肺组织α-SMA表达结果 对照组(见图 5)小鼠肺组织α-SMA表达为弱阳性,各时间点两两比较,表达无显著差异(P>0.05);RSV感染组(见图 6)小鼠肺组织α-SMA平均光密度值在第4天、第8天和第14天呈逐渐上升趋势,第14天时达高峰,至第28天下降,各时间点两两比较,差异有统计学意义(P<0.05)。RSV 感染组小鼠肺组织α-SMA表达与对照组比较,RSV感染组第 4 天、第 8 天、第 14 天可见α-SMA阳性表达,与对照组各相应时间点比较差异有统计学意义(P<0.05),感染第28天呈弱阳性表达,与对照组相应时间点比较差异无统计学意义(P>0.05),见表2。
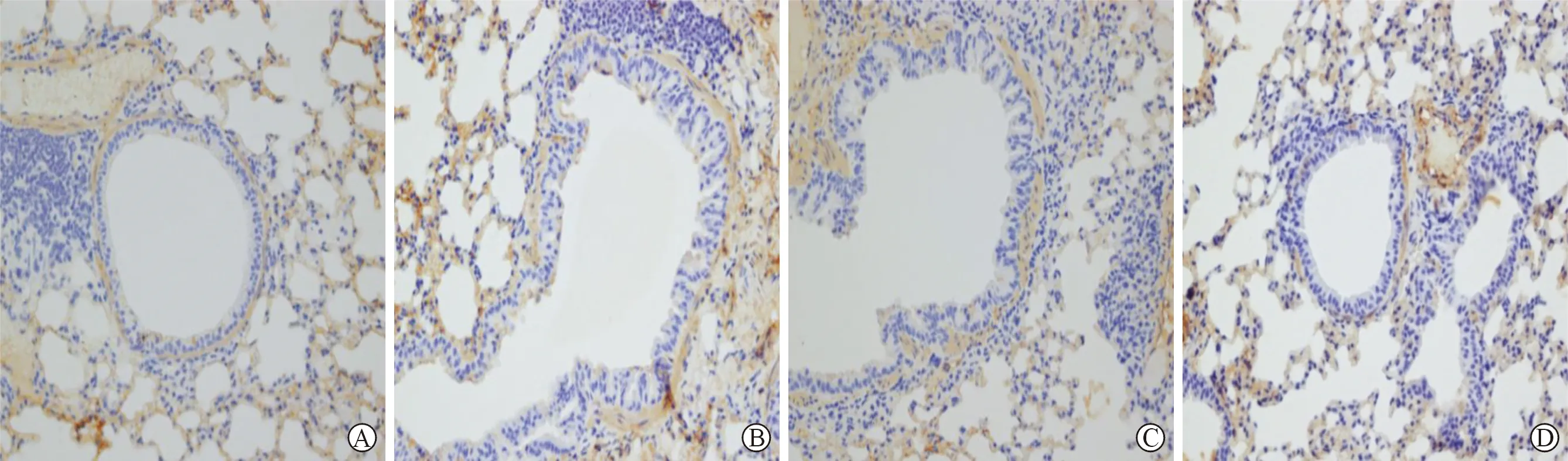
A:生理盐水组4 d B:生理盐水组8 d C:生理盐水组14 d D:生理盐水组28 d

A:观察组4 d B:观察组8 d C:观察组14 d D:观察组28 d

组 别n4d8d14d28dF值P值对照组60.251±0.0170.261±0.0150.245±0.0230.230±0.0184.140.62感染组60.392±0.030*△0.821±0.026*△0.915±0.021*△0.249±0.013△6910.00t值-36.0340.1857.430.97--P值-0.000.000.000.39--
注:与对照组比较,*P<0.05;感染组各时间点比较,△P<0.05
讨 论
RSV是引起婴幼儿喘息最常见和最重要的病原体之一,属副黏病毒科肺炎属,也是儿科常见的呼吸道病原之一,且易感染呼吸道上皮细胞,RSV感染机体后能导致喘息反复,甚至哮喘,该危险因素在哮喘发病过程中既重要而又独立。
研究表明,RSV感染小鼠肺组织病理变化最初表现为炎症改变[7]。实验的第3天肺组织出现大量炎性细胞浸润,到感染的第7天,主要表现为典型的间质性肺炎改变,可见肺泡间隔内的炎性细胞明显减少,同时可见肺泡腔扩大,部分肺泡壁断裂融合。而这种肺部炎症变化与我们人类大体一致,并且小鼠感染RSV后肺部的病理改变持续的时间会较长,可持续至28 d。肺部的这种持续性病理改变可能与RSV感染与日后发生哮喘的关系密切。
1 Masson染色胶原沉积变化 肺细胞外基质 (Extracellular matrix,ECM) 蛋白的一个主要成分是胶原,主要由成纤维细胞合成并分布于上皮、内皮基底膜及肺间质。胶原积聚是促使肺纤维化的一个重要特征,而气道重塑的主要病理改变就是ECM的过度沉积[8]。本实验通过制作RSV感染动物模型,经肺组织Masson染色后结果显示生理盐水组气道外周未见或仅见少量蓝色胶原沉积,而感染组小鼠气道外周蓝色胶原沉积在第4天出现,第8天增多,至14天达高峰,第28天未见或仅见少量蓝色胶原沉积,相较于对照组明显增多,从而提示RSV感染过程中出现了胶原沉积。这一结果也与导师组前期研究结果[9]相近。
2 α-SMA与气道炎症 现人们已认识到气道平滑肌(Airway smooth muscle,ASM)不仅影响气道张力,还可通过合成、分泌活性介质发挥免疫炎症作用,这些活性介质包括黏附分子、细胞因子、蛋白酶和细胞外基质成分等,同时还可参与肥大细胞、嗜酸性粒细胞、中性粒细胞和T细胞的活化过程,是哮喘发病过程中出现支气管痉挛和气道急性狭窄的最终效应器官,在哮喘出现慢性气道炎症的发生发展过程中起重要作用。α-SMA是气道平滑肌细胞(Airway smooth muscle cell,ASMC)的一个具有特征性的标志物,α-SMA的含量一方面可反映气道平滑肌细胞的数量,另一方面可反映收缩能力的改变[10]。本次实验免疫组化法检测α-SMA结果显示:α-SMA表达量在感染第 4 天开始出现,第8天表达量明显增加,与本实验研究RSV感染小鼠肺组织病理学在气道炎症的改变规律一致,从而推测α-SMA可能参与了RSV感染后气道炎症的发生、发展。虽然第14天时表达量无明显减少,仍呈高表达,推测可能有其它因素如胶原纤维的大量沉积等同时参与RSV感染过程。
3 α-SMA与气道重塑 近年研究发现,α-SMA具有促进细胞外基质中I型胶原过度沉积、促进支气管管壁增厚和僵硬等功能[11],除了在气道平滑肌细胞中表达之外,α-SMA还可作为一种表型标志,在成纤维细胞以及上皮细胞向肌成纤维细胞转化和活化的过程中起作用,而纤维化中最主要的效应细胞正是活化的肌成纤维细胞[12-13]。
本实验表明:通过构造RSV感染小鼠模型后,小鼠肺组织Masson染色结果显示,对照组各时间点气道壁周围未见明显蓝色胶原沉积,而RSV感染组在第 4 天可见少量蓝色胶原沉积,至第8天时蓝色胶原沉积明显增多,并在第 14天时达到高峰,感染的第 28 天未见或仅见少量蓝色胶原沉积,另外本实验中RSV感染小鼠肺组织免疫组化α-SMA阳性表达从第4天开始增加,第8天明显增多,至第14天时达到高峰,其变化与本实验RSV感染小鼠肺组织Masson染色中胶原沉积的变化规律一致,说明RSV感染后气道平滑肌细胞(ASMC)合成α-SMA功能增强,从而推测,α-SMA可能参与到了RSV感染胶原沉积的产生过程。本次实验小鼠肺组织免疫组化染色见α-SMA特异表达于气道平滑肌内,这与文献报告一致。而其他因素如细胞外基质、血管的重构等是否同时参与气道重塑还有待进一步研究。
综上所述,α-SMA参与了气道胶原沉积,因而寻找能下调胶原沉积的药物,实现早期及时干预,从而为药物治疗提供理论依据。当然,引起RSV感染后胶原沉积的细胞因子很多,α-SMA只是其中一个指标,因而继续寻找其他细胞因子,对探明RSV感染的发病过程有一定的临床意义。

