钴60照射治疗大鼠胶质瘤后脑水肿与erb-B1基因转录水平的关系
石新东,胡胜,冯军
胶质瘤是颅内发病率最高的恶性肿瘤,因手术全切困难、放射治疗并发症多、复发率高,预后差[1]。Co60放射治疗是高级别胶质瘤综合疗法的有效手段之一。但Co60照射后可能导致神经功能损伤和并发症,特别是放射性脑水肿(radioactive cerebral edema,RCE)。目前有关Co60照射治疗胶质瘤后RCE程度与癌症相关基因表达水平之间关联性的研究报道较少。部分具有酪氨酸蛋白激酶活性的细胞因子,参与调节细胞增殖、分化、生长、凋亡,广泛影响组织代谢、微血管活性、血脑屏障稳定性等。erb-B基因编码物是具有典型酪氨酸蛋白激酶活性的细胞因子,其成员包括erb-B1,即表皮生长因子受体(epidermal growth factor receptor,EGFR),erb-B2-4[2]。EGFR基因表达物与胶质瘤恶性级别和辐射耐受性均密切相关[3]。本研究探讨Co60治疗后RCE的发生程度与erb-B1转录水平的内在关联性。
1材料与方法
1.1 主要试剂与材料
C6胶质瘤细胞(购于华中科技大学同济医学院中心实验室)。8周龄雄性SD大鼠40只(购于华中科技大学同济医学院动物中心),体质量250~300 g。高糖DMEM培养基(购于Hyclone公司),小牛血清(购于杭州四季青生物工程材料有限公司)。
1.2 方法
1.2.1 细胞培养 选取C6细胞,以1×103/μL浓度接种于50 mL培养瓶,用含10%胎牛血清的高糖DMEM常规培养,置于37℃、5%CO2恒温培养箱中。当培养瓶约80%满时,以0.25%胰酶消化,离心,弃上清,用Hank’s液调成细胞浓度为1×105/μL的单细胞悬液
1.2.2 胶质瘤大鼠模型制作[4]水合氯醛腹腔注射麻醉大鼠后,固定于江湾Ⅰ型脑立体定位仪上,常规消毒,于头顶中线处纵向切开头皮,长约1 cm;于前囟处矢状缝右侧旁开3.0 mm,冠状缝前1 mm处用圆头牙钻钻孔,孔径1.2 mm,微量注射器垂直进针,深度为皮质下5 mm(右侧尾状核附近);缓慢注入取15 μL(1×105个/μL)C6混悬液;封闭骨窗,缝合切口。术后定期消毒皮肤,肌注青霉素(1万U/只,1次/d,共2 d)。
1.2.3 分组及治疗治疗 大鼠种植C6细胞15 d后,将成瘤大鼠(有明显左侧肢体偏瘫)随机分为对照组10只,放疗组30只。放疗组大鼠常规麻醉后,每3只1组,俯卧位放置,用Co60行全脑照射,照射剂量为18 Gy(3 Gy/min),初次照射3 min,12 h后再次照射3 min,总计照射6 min[5]。对照组不予任何治疗。
1.2.4 标本采集 Co60照射后第6天,麻醉后处死所有大鼠,取出全脑,取肿瘤组织进行Trizol消化。
1.2.5 RT-PCR ①引物:erb-B1上游引物:5’CTTCTTGCAGCGATACAGCTC 3’,下游引物:5’ATGCTCCAATAAATTCACTGC 3’,上下游引物均跨越内含子设计,避免DNA的干扰,扩增片断大小441 bp。β-actin上游引物:5’TAAGCTGTGCTCGCGCTACTC TCTC,下游引物:5’GTCGGATTGATGAAACCCAGA CACA3’,扩增片断大小168 bp。②逆转录cDNA。Trizol提取含瘤脑组织mRNA,取1 μg做逆转录,反应体系为:RNA 1 μg、M-MLV RT 1 μL(200 U)、M-MLV 5×Reaction Buffer 5 μL、RNasin 0.5 μL、Oligo(dT)2 μL(1μg)、4×dNTP 5 μL,DEPC处理水补至终体积25 μL,37℃孵育60 min。③PCR。循环参数为94℃预变性5 min,94℃变性1 min,60℃退火30 s,72℃延伸1 min;35个循环,72℃延伸7 min。④电泳:记录PCR扩增产物电泳后图像,并选用Band Leader解析图像。
1.2.6 脑组织HE染色 3组均在肉眼下剔除肿瘤之后将剩余右侧大脑半球脑组织进行石蜡包埋,制作4 μm切片,常规法行HE染色。
1.2.7 脑水肿检测 采用HMIAS-2000图象分析仪扫描分析HE染色切片,用光标仪测量水肿组织面积。每只大鼠随机测量4张切片,每片选择5个不重复的高倍视野,计算水肿面积平均百分率(水肿组织面积占视野面积平均百分率)。放疗组水肿面积平均百分率>30%的,定义为“明显脑水肿”;<10%的,定义为“无脑水肿”;10%~30%的大鼠剔除[7]。观察水肿组织形态及分布特点。
1.3 统计学处理
采用SPSS 13.0软件处理数据。符合正态分布以及方差齐性的计量资料以(±s)表示,组间比较采用独立样本均数t检验,P<0.05为差异有统计学意义。
2结果
2.1 水肿组织形态与分布
放疗组中,明显脑水肿12只,无脑水肿11只,明显脑水肿率为40%(12/30)。明显脑水肿大鼠的脑水肿组织呈带条状或团块状,分布较集中,见图1A;无脑水肿大鼠的脑水肿组织呈雪花状,较局限,见图1B;对照组大鼠的脑组织水肿组织散在不均匀分布,见图1C。
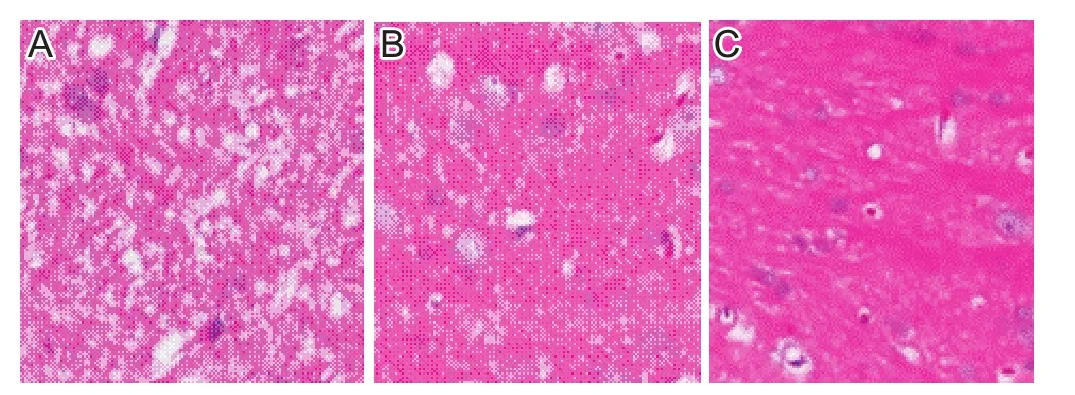
图1 各组大鼠脑组织HE染色(光学显微镜,×200)
2.2 RT-PCR
从大鼠脑瘤组织中成功地扩增出EGFR(即erb-B1)和β-actin的PCR产物,见图2。mRNA转录水平半定量分析结果显示,放疗组明显脑水肿大鼠erb-B1转录水平显著高于对照组和放疗组无脑水肿大鼠(均P<0.01),放疗组无脑水肿大鼠与对照组大鼠的erb-B1转录水平差异无统计学意义(P>0.05),见表1。
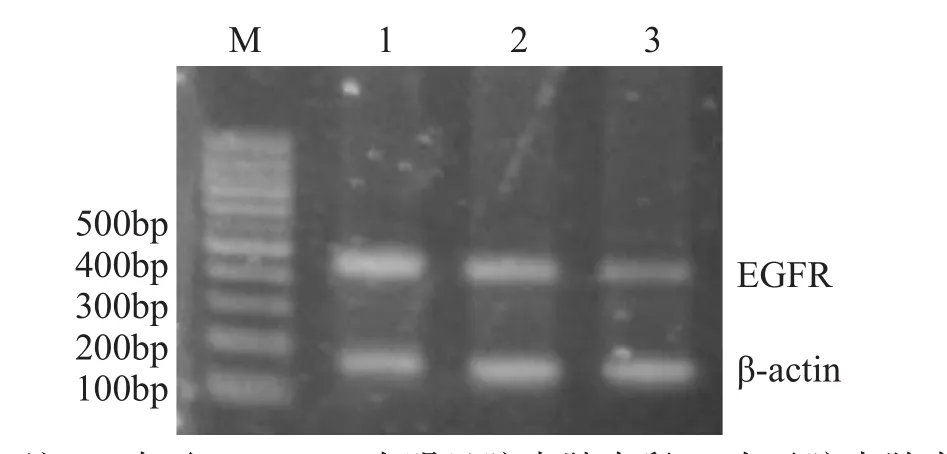
图2 RT-PCR条带
表1 各组大鼠脑组织erb-B1转录水平比较(±s)

表1 各组大鼠脑组织erb-B1转录水平比较(±s)
组别对照组放疗组无脑水肿大鼠放疗组明显脑水肿大鼠只数101112 erb-B1转录水平0.710736±0.057259①0.738544±0.045348①0.925237±0.064943
3讨论
有研究采用SABC法来研究放射性脑水肿的发生与erb-B1(EGFR)基因表达水平的关系[5]。SABC法是蛋白水平的研究,只有具备正常膜外段的erb-B1才能和相应抗体结合而被检测出来。但在胶质瘤细胞中erb-B1表达异常,既有表达数量的异常、也有质量的异常--膜外段发生畸变[6,7]。因此,SABC法不能全面、精确地揭示胶质瘤患者EGFR基因表达程度。RT-PCR法是检测mRNA的转录水平,其灵敏度是SABC法的1000倍以上,且本研究选择EGFR在转录水平相对稳定的区段来进行引物设置进行RT-PCR。可以更全面、精确地反映胶质瘤细胞erb-B1基因的生物活性。
本实验C6胶质瘤荷瘤大鼠模型与人体颅内高级别胶质瘤具有很高的相似性,回转式Co60放射仪也是临床上常用的放疗设备之一。因此实验对于临床诊疗工作和科学研究均具有可靠的参考价值。从本研究相关指标的比较发现,放疗组明显脑水肿大鼠的erb-B1转录水平性明显高于无脑水肿大鼠。erb-B1转录水平越高,发生RCE的可能性越大,发生RCE的程度越重,因此高级别胶质瘤Co60放疗后RCE发生情况可能与含瘤脑组织erb-B1的异常转录有关。
胶质瘤Co60治疗后RCE的发生程度受个体辐射耐受性的影响[8],而辐射敏感性与肿瘤恶性级别密切相关。胶质瘤的恶性度与多种致癌-抑癌基因的表达异常有关,其中癌基因erb-B1过表达是常见方式之一。相关研究证实,胶质瘤的放射敏感性与瘤细胞erb-B1表达水平密切相关[9,10]。致癌-抑癌基因表达、胶质瘤恶性程度及放射敏感性,相互影响、彼此关联。因而erb-B1可通过异常表达来改变胶质瘤的恶性级别,进而改变肿瘤的放射敏感性,最终影响RCE的发生。最新研究显示erb-B1通路底物EPS8可以通过改变血-脑脊髓屏障来影响脑水肿的发生[11]。表皮生长因子受体通路底物8(Eps8)是表皮生长因子受体重要的激酶活性底物之一。Eps8参与神经胶质瘤、宫颈癌、胃肠癌等多类型肿瘤细胞的有丝分裂、分化、增殖、凋亡、转移[12],并与肿瘤的预后及转归密切相关。Eps8可以通过改变在脑脊髓微血管内皮细胞的表达来调节纤维型肌动蛋白在血-脑脊髓屏障的分布[13],进而影响血-脑脊髓屏障功能,这是放射性脑水肿发生的重要病理基础[14]。因而,erb-B1可能通过调节EPS8来改变血-脑脊髓屏障功能,进而直接影响RCE的发生。
胶质瘤放疗后RCE主要是通过激素、脱水药物等进行防治,本研究为胶质瘤RCE的防治和放射剂量的选择提供了新的途径和理论依据。胶质瘤患者放疗前后可以通过阻断、抑制EGFR的表达或降低EGFR的生物活性,积极主动地防治放射性脑水肿。对于EGFR高表达的患者,适当降低放射剂量同时加用抑制EGFR表达的药物,可以避免致死性RCE的发生。对于EGFR低表达的患者,适当增大放射剂量,既可以增强放疗疗效果又不会带来严重的RCE。
除了EGFR,erb-B基因家族还有2-4亚型,目前还无法确定erb-B2-4亚型在高级别胶质瘤放射治疗后RCE形成中扮演何种角色,还需进一步深入研究。

