“镜像”对称性星形细胞瘤1例分析并文献复习
向柳,李俊,贾敏,李金兰,刘群会
脑胶质瘤是临床最常见的一种中枢神经系统原发恶性肿瘤,约占颅内肿瘤的33.3%~58.9%[1],但多发胶质瘤发病率较低,在颅内胶质瘤中所占比例为0.5%~20.0%[2]。目前,有关不同时期“镜像”对称性胶质瘤报道甚少,首次发病后15年再发者尚无相关报道。现报道我院收治1例脑胶质瘤患者,既往15年前有对侧“镜像”对称性胶质瘤,同时对相关的国内外最新研究进展进行文献回顾,探讨该病的临床表现、病理及影像学特征。
1资料与方法
1.1 病例资料
患者,男性,53岁,因“发作性意识丧失伴四肢抽搐半天”于2017年8月12日入院。患者于当天凌晨4点突发意识丧失,伴四肢抽搐、牙关紧闭、大小便失禁,持续时间约2 min后意识恢复正常,醒后感头痛、头晕,伴四肢乏力,无恶心、呕吐,无舌咬伤,无视物旋转,无肢体麻木偏瘫。既往于2002年4月我院诊断:①右侧额叶占位性病变;②继发性癫痫;并行右额叶占位性病变切除术,术后病理检查提示右额叶星形细胞胶质瘤,术后继续给予抗癫痫药物治疗;有吸烟约10年,平均20支/日,否认高血压病、糖尿病及家族遗传病史。神经系统查体未见明显阳性体征。头颅磁共振成像(MRI)平扫+增强显示右侧额叶见斑片状长T1长T2信号,T2Flair呈低信号,灶周见条片状稍高信号环绕,上述异常信号未见明显强化;左侧额叶可见斑片状长T1长T2信号,T2Flair呈稍高信号,轻度强化。左侧额叶异常信号,不除外星形细胞瘤,见图1。根据病史及辅助检查初步诊断为:①左额叶占位性病变,胶质瘤可能;②右额叶胶质瘤术后;③继发性癫痫。
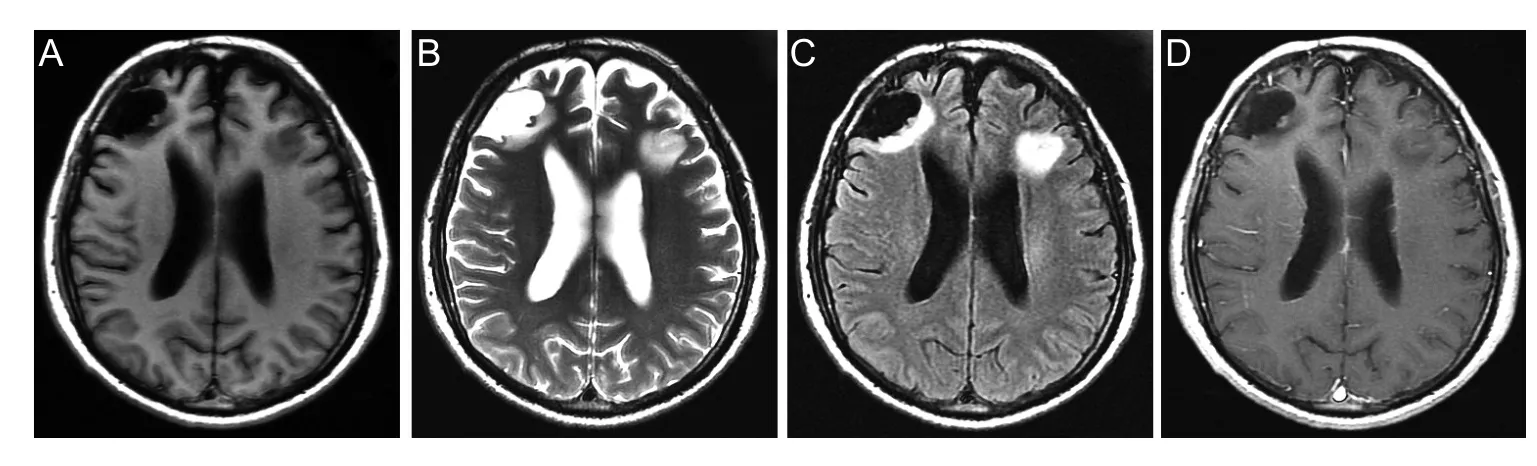
图1 患者术前头部MRI
患者完成术前准备后,行幕上开颅肿瘤切除术,手术采取左侧额部半冠状切口,骨窗缘打孔铣下骨瓣,硬膜悬吊,弧形剪开硬膜,术中见额中回后部脑回明显肿胀,颜色灰白,考虑肿瘤组织,沿周边水肿带切除,见病变周边胶质增生,顺病变周边胶质增生带分离,逐步将病灶切除,大小约3 cm×3 cm×3 cm,呈胶质样改变,肿瘤中心未见陈旧性出血及囊变,无明显界面,质地均一,血供不丰富。将切除的肿瘤组织进行病理学检查。肿瘤组织病理学检查结果:左侧额叶病变局部的细胞密度增高。免疫组织化学结果:GFAP(+),Vim(+),S-100(+),CD34(-),EMA(-),NF(+),NSE(+),Ki-67(+2%),见图2。诊断为左额叶星形细胞瘤(WHOⅡ级)。
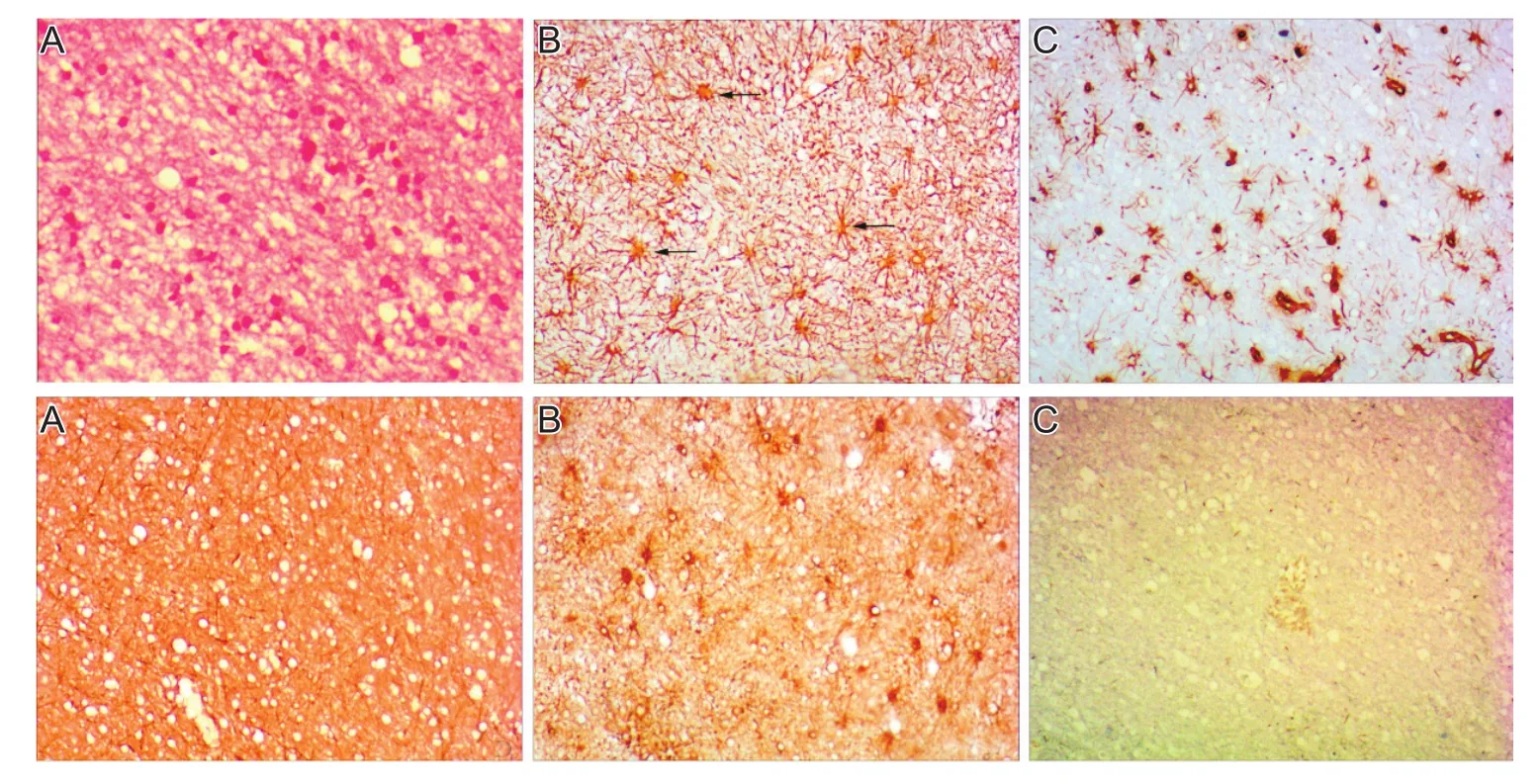
图2 患者术后肿瘤组织病理形态(×400)
术后头部CT检查显示颅内病灶已被切除,患者住院43 d后恢复良好出院,院外建议患者继续行抗癫痫及放化疗治疗。术后半月复查头颅MRI平扫+增强显示:右侧额叶软化灶,与2017.8.15片大致相仿,左侧额叶术后改变,术后周围水肿,左侧硬膜下积液,见图3。术后5个月再次复查头部MRI平扫+增强显示:左侧额叶病灶较前片(2017.9.5)范围缩小,原左侧硬膜下积液基本吸收;右侧额叶脑软化灶较前片大致相仿,见图4。
1.2 方法
收集资料并分析。通过Pubmed数据库、万方数据库、中国知网,输入关键词“multicentric glioma、magnetic resonance imaging、多中心胶质瘤”。收集近5年所有相关文献(检索时间截止2018年8月1日),将可获得详细临床资料的病例纳入研究。采用描述性统计对符合条件的所有病例从临床症状、影像学表现及病理特征进行分析。
2结果
通过搜索关键词“multicentric glioma、magnetic resonance imaging、多中心胶质瘤”共得到31例非同期多中心胶质瘤患者的病例资料。①临床表现:肢体抽搐(89.4%)、头痛(22.5%),一侧肢体无力(16.3%),偏身感觉障碍(6.4%),恶心呕吐(3.7%),视力下降(2.5%),视盘水肿(1.04%)。②影像学表现:头部磁共振成像(MRI)平扫+增强显示:病灶可见团片状混杂异常信号,T1WI呈稍高、稍低及低信号,T2WI呈等及高信号,增强扫描均明显不均匀强化。病灶分布于额叶(61.29%),颞叶(38.71%),额颞叶(22.58%),顶叶(19.35%),额顶叶(19.35%),顶枕叶(16.13%),丘脑基底核区(9.67%),侧脑室壁内(6.45%)。③病理检查:31例患者均行病例组织活检,其中星形细胞瘤(83.9%),室管膜细胞瘤(12.9%),成胶质细胞瘤(3.2%)。
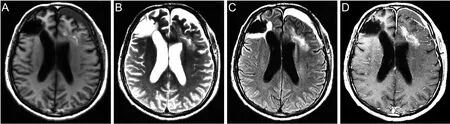
图3 患者术后半月头部MRI
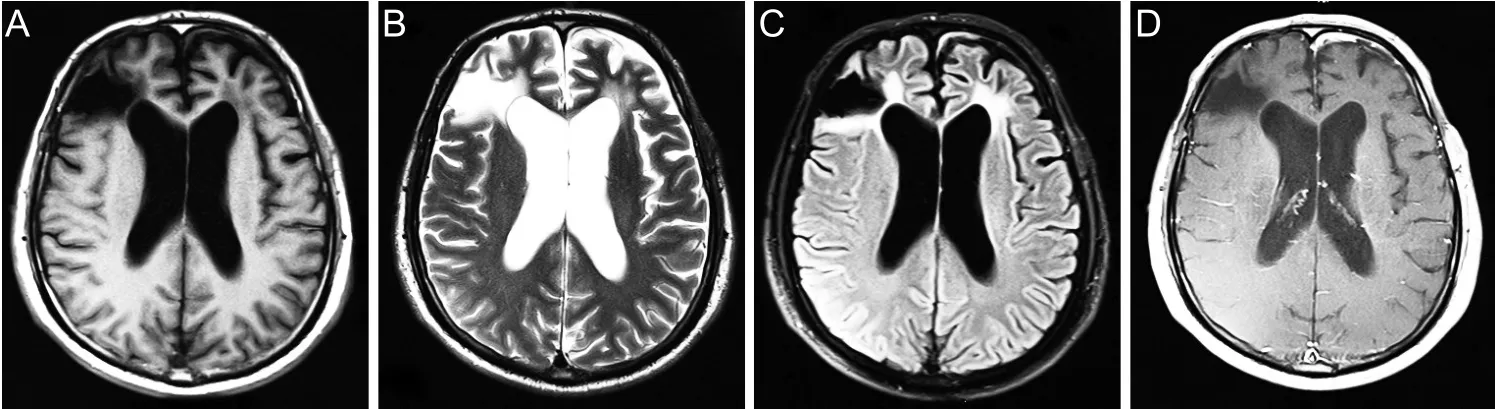
图4 患者术后5月头部MRI
3讨论
颅内多发脑胶质瘤是指不同脑叶或半球发生的2个及以上的胶质瘤病灶,病灶可以同期出现或先后发生。Batzdorf等[3]在1963年首次提出将颅内多发胶质瘤分为多中心胶质瘤和多灶性胶质瘤。多中心胶质瘤是在一侧或两侧大脑半球距离较远,分别独立生长的胶质瘤,其组织学类型可以相同或不同;多灶性胶质瘤是指可用已知播散转移途径(如神经联合纤维扩展、脑脊液播散等)解释的颅内多发胶质瘤。但有时多发胶质瘤之间的联系可能是微观的,宏观并不一定可见[4],因此给多中心胶质瘤的诊断带来了困难。近年来,Thomas等[5]提出如果两处病变之间存在传播途径,在磁共振Flair信号序列上会显示出沿着传播途径的异常水肿区域。本文报道病例的磁共振Flair信号上两个病灶之间并未发现有水肿区域相连接,故本例患者可认定为多中心星形细胞瘤。
多中心胶质瘤的发病机制尚不明确,存在多种假说。有学者认为胶质瘤是从中枢神经系统发展过程中错位的原始细胞分化而来[6]。如果颅内多处存在这种错位细胞,则有可能在颅内不同部位发展成细胞类型相同的胶质瘤;而细胞类型不同的肿瘤,可能是由颅内同时存在的不同残余胚胎组织衍化而来。也有人认为,胶质瘤发生时是多个独立的新生灶发展融合而成单个的肿瘤[7]。Zulch等[8]提出多中心脑胶质瘤的发生可能是通过目前未知的途径进行转移的。但越来越多的学者认为多中心胶质瘤的发病与胶质瘤细胞的长距离迁移及能力有关[9]。其确切发生机制有待进一步明确。
多中心脑胶质瘤的病理学诊断按照就高原则诊断。多中心脑胶质瘤以高级别为主,低级别较为少见,但预后相对较好[10]。Terakawa等[11]报道低级别多中心胶质瘤5例,病理类型为星形或少突胶质细胞瘤(WHO II级),最长随访138个月仍然生存。薛湛等[12]对24例多中心胶质瘤患者的研究发现,低级别胶质瘤占例仅20.8%。多中心胶质瘤的病理类型可相同也可不同,Thomas等[5]对241例胶质瘤患者大脑病理切片的研究发现,多中心脑胶质瘤占7.5%,其中2.9%具有不同的病理学性质。大部分颅内多中心胶质瘤至少一处为胶质母细胞瘤[2],而本例2处病变均为星形细胞瘤,且间隔时间之久,实属罕见。多中心脑胶质瘤的免疫组化染色无特异性。Ki-67抗原标记指数差异较大[13],Ki-67抗原阳性细胞的存在支持脑胶质瘤病的诊断,但不能作为诊断依据。
多中心胶质瘤临床上易与脑转移瘤、脑炎、多发脑脓肿与肉芽肿、多发脑血管畸形、胶质瘤病等混淆。颅内多发转移瘤在身体其他部位有恶性病灶,转移瘤多发生于顶枕叶的皮质或皮质下,多呈不规则环状强化,瘤周水肿明显,多病灶均一强化,大小相近、强化程度相同;胶质瘤则部位不定,环状强化少,瘤周水肿轻,胶质瘤病灶大小、密度可明显不同。脑胶质瘤病为同时累及3个以上脑叶,呈弥漫性生长,病变通常彼此相连,以低级别胶质瘤多见,手术目的以活检为主,预后相对较好[14];多中心胶质瘤为同时或先后存在2个或以上病灶,病灶之间缺乏联系,以高级别胶质瘤多见,手术的目的是尽量的全切病灶,预后更差。本例先为右侧额叶胶质瘤,时隔15年后再次出现对侧“镜像”对称性胶质瘤,在不同时期发病,且病例级别不高,临床上甚为少见。
多中心胶质瘤的治疗方面,广泛认为积极的手术切除病灶有利于延长患者的生存期[2,15,16]。化疗作为一种比较安全且有效的治疗方法,应该被推荐。手术后是否进行放疗暂无定论。Vanden Bent等[17]研究发现,放疗对总生存期和改善预后无明确相关性,且会加重高颅压的发生率。张文超等[19]认为生物大分子LC3B表达与星形细胞瘤患者对放化疗治疗效果抵抗明显相关。因此多中心胶质瘤术后是否进行放疗及放疗的时机需综合考虑。
胶质瘤预后差,其5年生存率因组织学类型而异,Berger等[18]研究发现,星形细胞瘤的5年生存率为44%,少突胶质细胞瘤为61%,室管膜瘤为65%,胶质母细胞瘤5年生存率只有5%。胶质瘤预后与长期生存有关的因素很多。牟永告等[20]筛选出了8个影响长期生存的预后因子:病理级别、年龄、KPS、肿瘤部位(颞叶、顶叶)、肿瘤复发、复发后再手术、切除程度和术后放疗。本例先为右侧额叶胶质瘤,时隔15年后再次出现对侧“镜像”对称性胶质瘤,患者生存期较平均时间明显延长非常少见,考虑与患者发病年龄较轻,病理级别低、手术切除程度相关。
综上所述,多中心脑胶质瘤通过积极手术治疗,有机的结合放疗、化疗以及基因和生物学治疗的综合治疗原则对延长患者的生存期有利。未来,对多中心脑胶质瘤的研究将有助于进一步认识其发病机制,并明确其诊治原则和预后判断。

