Nrf-2/HO-1通路在糖尿病大鼠神经病理性痛中的作用
刘康,赵博,周芳,谢恒韬,黎梅
糖尿病神经病理性疼痛是糖尿病最常见的慢性并发症之一,多以自发痛、诱发痛、痛觉过敏、痛觉超敏及异常性疼痛为特征[1,2]。其机制不清,尚无有效的治疗。研究糖尿病神经病理性痛的发病机制对于获取更为有效的治疗措施,降低糖尿病并发症及死亡率,改善患者生存质量,降低医疗成本,都具有重要的意义。核转录因子红细胞系-2相关因子-2(nuclear factor erythroid-2 related factor-2,Nrf-2)信号通路作为对抗外来异物和氧化损伤的关键环节,在机体各个系统的应激反应中发挥重要作用。在外界应激下,Nrf-2通过诱导II相解毒酶的表达,激活血红素氧合酶-1(heme oxygenase-1,HO-1)、谷胱甘肽 S-移酶酶(glutathione S-transferase,GSTs)、谷氨酰半胱氨酸合成酶(glutamyl cysteine synthethase,GCS)等最终起到保护作用[3,4]。糖尿病神经病理性痛中脊髓部位Nrf-2表达减少,稳定性下降,Nrf-2依赖的抗氧化产物HO-1的表达亦减少[5]。进而导致微环境异常,导致神经细胞的表型和结构及功能状态发生不可逆损伤,形成神经痛的病理学基础[6]。本研究拟观察Nrf-2/HO-1通路在糖尿病神经病理性痛中的作用。
1材料与方法
2结果
1.1 实验动物及分组
清洁级健康成年雄性SD大鼠24只,体质量200~220 g,购自湖南斯莱克景达实验动物有限公司。采用随机数字表法将大鼠分为3组,各8只:对照组(C组)、糖尿病组(D组)、糖尿病+Nrf-2激动剂tBHQ组(DT组)。tBHQ(美国Selleck公司)为Nrf-2特异性激动剂。腹腔注射1%链脲佐菌素-柠檬酸盐缓冲液(美国Sigma公司)60 mg/kg,3 d后于尾静脉采血检测血糖,血糖≥16.7 mmol/L为大鼠糖尿病模型制备成功,饲养周期为6周。DT组于糖尿病模型制备成功后第3天,腹腔注射tBHQ 30 mg/kg至42 d。
与C组相比,D组MWT在2周后即明显降低,MNCV在4周后明显降低(均P<0.05)。与D组相比,DT组MWT在2周后即高于D组,但仍低于C组(均P<0.05);MNCV在4周后高于D组,但仍低于C组(均P<0.05)见表1。
1.2 指标测定
1.2.1 机械痛阈(mechanical withdrawal threshold,MWT) 将大鼠置于底带孔的有机玻璃笼中,分别于第2,4,6周采用Von Frey测痛仪(美国Stoelting公司)刺激大鼠后肢足底中部2 s,出现缩足反应时计数。
1.2.2 坐骨神经导速率(sciatic nerve conduction velocity,MNCV) 分别于第2,4,6周测定。将双针电极置于大鼠右侧坐骨切迹处,于同侧踝关节坐骨神经经过部位和大鼠足趾第一骨间肌肉处分别放置双针电极,测定大鼠MNCV。
1.2.3 病理结构观察 6周后每组取4只大鼠深麻醉下开胸,心尖部穿刺行主动脉灌流,4%多聚甲醛灌注固定,取L4-6脊髓节段行Nissl染色,光镜下(×400)观察腓肠神经病理学结果。取腓肠神经,2.5%戊二醛固定后再用1%四氧化锇固定,梯度丙酮脱水后,环氧树脂包埋,制成超薄切片,醋酸双氧铀及柠檬酸铅双重染色,透射电镜下观察腓肠神经超微结构。
1.2.4 相关蛋白表达水平检测 6周后每组余下4只大鼠处死后取L4-6脊髓,裂解液提取蛋白,测定蛋白浓度。电泳分离目的蛋白,转膜后,脱脂奶粉室温封闭。分别加入Nrf-2、HO-1抗体(1∶1000,美国CST公司),4℃孵育过夜。次日加二抗(1∶10000,美国LI-COR公司)孵育1 h后TBST清洗,扫膜后读取灰度值,Odessay软件进行分析。目的蛋白条带灰度值与内参条带灰度值的比值反映目的蛋白表达水平。
表1 3组大鼠MWT及MNCV比较(±s)

表1 3组大鼠MWT及MNCV比较(±s)
注:与C组比较,①P<0.05;与D组比较,②P<0.05
组别 只数MWT/g 2 w 4 w 6 w C组D组DT组88814.3±1.97.2±1.3①8.8±1.6①②13.3±2.05.2±1.2①8.2±1.4①②13.7±1.63.7±1.1①8.4±1.5①②组别C组D组DT组MNCV/(m/s)2 w 53.6±2.951.2±2.249.4±3.34 w 52.0±3.440.3±2.5①45.3±3.1①②6 w 52.2±3.535.2±2.8①44.6±3.2①②
脊髓Nissl染色显示:C组神经细胞排列较为均匀,细胞器结构清晰;D组神经细胞胞体缩小,排列松散,核周染色质溶解伴局部水肿;DT组部分神经细胞结构大致正常,部分神经细胞缩小,病理损伤较D组减轻,见图1。
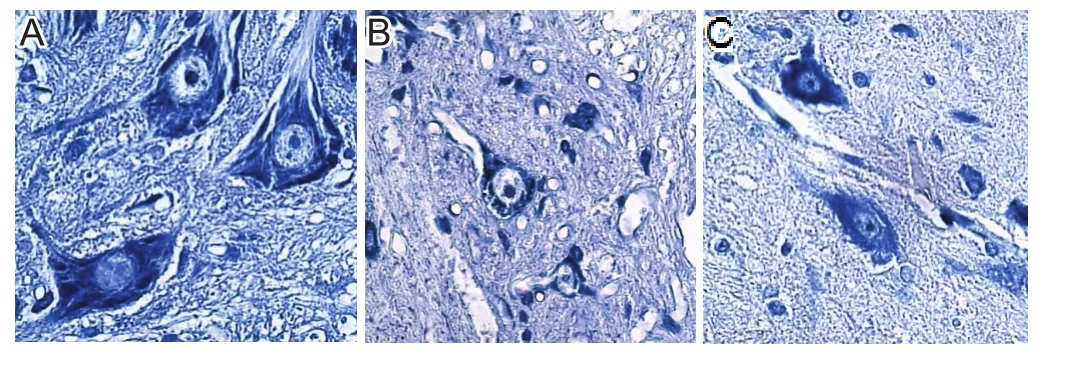
图1 3组大鼠脊髓细胞Nissl染色(光学显微镜,×400)
腓肠神经电镜显示:C组髓鞘排列均匀,轴突内可见正常形态的线粒体;D组部分脱髓鞘明显,排列局部紊乱,少部分轴突变性,Schwann细胞增生;DT组髓鞘排列均匀,局部排列紊乱,轴突内可见正常形态线粒体,脱髓鞘程度轻微,见图2。
1.3 统计学处理
采用SPSS 17.0软件处理数据。符合正态分布以及方差齐性的计量资料以(±s)表示,单因素方差分析;计数资料以率表示,组间比较采用χ2检验;P<0.05为差异有统计学意义。

图2 3组大鼠腓肠神经电镜结构
与C组比较,D组和DT组的Nrf-2、HO-1表达均降低(均P<0.05);与D组比较,DT组Nrf-2、HO-1表达升高(均P<0.05),见图3,表2。

图3 3组大鼠Nrf-2、HO-1蛋白western blot检测条带
表2 3组大鼠Nrf-2、HO-1蛋白表达水平比较(±s)
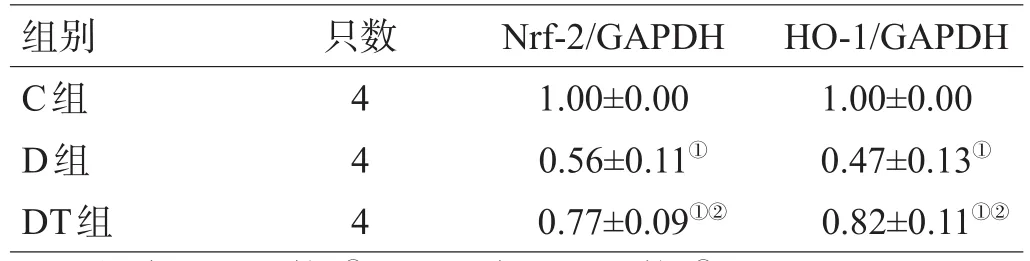
表2 3组大鼠Nrf-2、HO-1蛋白表达水平比较(±s)
注:与C组比较,①P<0.05;与D组比较,②P<0.05
组别C组D组DT组只数444 Nrf-2/GAPDH 1.00±0.000.56±0.11①0.77±0.09①②HO-1/GAPDH 1.00±0.000.47±0.13①0.82±0.11①②
3讨论
本研究采用腹腔注射链脲佐菌素的方法制备大鼠糖尿病模型,饲养2周后通过检测大鼠MWT确定糖尿病神经病理性痛模型制备成功。应用作为金标准的脊髓Nissl染色及腓肠神经电镜均从细胞结构进一步证实模型制备成功。
HO-1是重要的内源性抗氧化应激机制,激活HO-1对抗机体氧化损伤是目前的研究热点[7]。研究发现,应用HO-1激动剂可提高组织中HO-1活性,有效减轻糖尿病神经病理性痛。HO-1在糖尿病状态下呈不稳定状态,这可能与糖尿病状态下HO-1上级信号通路调控相关[8]。糖尿病可以激活机体内源性抗氧化应激蛋白Nrf-2的表达进而激活抗氧化反应元件,发挥抗氧化应激作用[9]。当遇到高血糖和氧自由基刺激时Nrf-2磷酸化,活化的Nrf-2进入细胞核,与小Maf蛋白(small Maf proteins,Maf)结合成异二聚体,调节下游抗氧化蛋白HO-1的表达,提高细胞抗氧化应激的能力[10]。因此,Nrf2/HO-1信号通路的激活对缓解糖尿病神经病理性痛起到了关键性作用。
本研究结果表明,糖尿病大鼠神经病理性痛脊神经中Nrf-2、HO-1表达降低,同时MWT、MNCV降低,病理损伤严重。当给予Nrf-2激动剂后,Nrf-2、HO-1表达升高,同时伴有MWT、MNCV升高,病理学损伤减轻。提示Nrf-2/HO-1通路的激活减轻了糖尿病神经病理性疼痛。
高血糖可引起脊髓胶质细胞活化,活化后的胶质细胞通过释放促炎症细胞因子引起神经性疼痛,导致大鼠MWT和MNCV的降低[11]。本研究结果表明,糖尿病大鼠MWT和MNCV降低,且随着糖尿病病程的进展,MWT和MNCV进一步降低。在给予Nrf-2激动剂后,大鼠痛阈值和运动神经传导速度升高。提示糖尿病大鼠神经病理性疼痛的机制可能与Nrf-2/HO-1通路的激活有关。
综上所述,Nrf-2/HO-1通路参与了糖尿病大鼠神经病理性疼痛的进展,激活Nrf-2的表达可能是减轻糖尿病大鼠神经病理性疼痛的有效方法之一。

