右美托咪定诱导的肌细胞钙浓度双相增加与能量代谢之间的相关性
许占宏,房丽华,李淑艳,董 冉
(1.哈尔滨医科大学附属第一医院 麻醉科,黑龙江 哈尔滨150010;2.哈尔滨市儿童医院)
右美托咪定(DEX)是目前被较广应用于围手术期以及重症监护室的高选择性的α2肾上腺素能受体激动药[1],在围手术期及重症监护室患者使用时能产生近似自然睡眠的稳定、镇静作用[2],有利于维持患者血流动力学上的稳定,具有保护患者的心、肝、脑等器官的功能特性[3,4],同时还具有一定的利尿、抗焦虑的作用,并且其对于呼吸的抑制作用也很轻微[5-7]。钙是人体中的主要常量元素之一, Ca2+做为第二信使会参与到细胞活动的调节中。胞内游离的钙离子浓度的变化,对于维持细胞质膜以及细胞器膜两侧的跨膜Ca2+梯度差、以及实现信息跨膜传导具有重要调节的作用[8-12]。目前关于右美托咪定诱导的肌细胞钙浓度双相增加与能量代谢之间的相关性研究较少,本实验将通过研究探讨右美托咪定的作用对肌细胞钙浓度增加与能量代谢之间关系。
1 材料与方法
1.1 研究对象
实验中选取出生5天后的雄性Wistar大鼠做为研究对象,实验大鼠采购自华中科技大学同济医学院实验动物中心,动物合格证号是:SCXX (鄂)2004-2007。共分为2大组:对照组以及右美托咪定处理组(低剂量0.1 μmol/L、高剂量1 μmol/L)。
1.2 方法
1.2.1肌细胞培养过程 将出生5天后的雄性Wister大鼠杀掉,先采用70%浓度的酒精进行浸泡30 min消毒,无菌纸擦干,于大鼠的肩关节、髋关节处进行解剖,用磷酸盐缓冲液冲洗数次后,剪掉大鼠的脂肪去除骨骼,剪碎成1 mm×1 mm×1 mm碎块备用,用0.1%的胰蛋白酶将组织多次消化得到单个的细胞悬浮液,离心分离后得到沉淀,用含20%小牛血清的DMEM悬浮分散大鼠细胞,培养接种于25 ml容量的培养瓶中,放在37℃的二氧化碳的孵箱内进行培养,每日更换培养液[13]。实验开始前可用无血清的DMEM培养24 h,使得细胞周期同步。其中对照组按正常培养肌细胞流程进行培养,不做任何其他处理;而右美托咪定组添加低剂量组(0.1 μmol/L)和高剂量组(1 μmol/L)浓度的DEX处理,其余不变。
1.2.2荧光蛋白钙指示剂测定肌细胞中钙离子含量 采用fura-2荧光钙离子指示剂测定肌细胞中钙离子的含量,测定原理为当肌细胞结合钙离子后,荧光的最大激发波长会从363 nm(末结合钙离子)变成335 nm(钙离子饱和),同时发射荧光的最大波长大约在510 nm左右,未发生变化。探针会在340 nm和380 nm波长光处被激发,通过使用与两种激发对应的荧光强度的比率,来计算大鼠肌细胞内的钙离子浓度[14]。当细胞经fura-2负载后,利用F4500荧光分光光度计进行荧光强度的测定,激发波长为340 nm,发射波长为510 nm。
1.2.3肌细胞中线粒体琥珀酸脱氢酶(MSDH)的测定 肌细胞线粒体中的琥珀酸脱氢酶会形成将外源性噻唑蓝还原成蓝紫色的结晶物的现象,从而产生沉淀,然而死细胞无法完成此还原的过程[15]。实验中将肌细胞采用二甲亚砜溶液溶解,于570 nm处酶标仪测定其吸光度(A)值,从而反映出线粒体的功能。
1.2.4肌细胞线粒体膜电位的测定 将处理后的肌细胞去掉其上清液,加入提前配置好的缓冲液 (氯化钠122 mmol/L,碳酸氢钠25 mmol/L,硫酸镁1.2 mmol/L,磷酸氢二钠0.4 mmol/L,氯化钠1.4 mmol/L,4-羟乙基哌嗪乙磺酸10 mmol/L,葡萄糖10 mmol/L),37℃条件下预温孵30 min,然后换成含有20 μmol/L Rh123的缓冲液在温孵120 min,用冰冷的缓冲液冲洗3次后,即终止孵育。1420Victor多标记免疫分析仪,激发波长为485 nm,发射波长为535 nm处测荧光强度,以荧光强度来表示肌细胞中线粒体膜电位的变化[16]。
1.2.5肌细胞中ATP,ADP,AMP含量变化的测定 将培养处理后的肌细胞培养液中加入0.1 mol/L的高氯酸1 ml,于4℃,15 000 g离心10 min, 取 上清液用0.5 mol/L碳酸钠溶液中和调整pH至6.5-7,再重复离心1次,取离心后的上清液做高效液相色谱分析[17]。
1.2.6肌细胞细胞凋亡测定 每组取6个孔板,0.125%胰酶消化并收集细胞。根据膜联蛋白V-异硫氰酸酯/碘化丙啶双标试剂盒说明,用双蒸水1∶4比例稀释结合缓冲液,PBS洗涤细胞后,以稀释的结合缓冲液重悬细胞,并调整细胞的密度为2×105/mL。取细胞悬液195 μl,加入AnnexinV-FITC5 μl和PI 10 μl混合均匀,室温下避光反应30 min,使用流式细胞仪检测[18]。
1.2.7肌细胞Ca2+-ATPase,Na+-K+-ATPase酶活性的测定 采用孔雀绿比色法[19]测定大鼠肌细胞中Ca2+-ATPase,Na+-K+-ATPase酶的活性。
1.2.8Western Blot检测大鼠Caspse3表达 制备不同处理组大鼠蛋白样品,-80℃低温处储存,待SDS-PAGE电泳凝胶制备完成后上样电泳分离,跑胶结束后转膜,免疫反应后进行显影、定影图像分析。
1.2.9PCR技术检测大鼠线粒体周围能量基因的表达情况 将生产5天后的不同处理组的(每组15只)大鼠取血,提取其RNA做PCR检测,取2 μg的mRNA使用superscript II和Random Primer Hexamers(Invitrogen)反转录合成并纯化cDNA。在PCR Array 的96孔板中各加入20 ng的cDNA,后设置循环数进行PCR,通过计算得到每个孔板中的Ct数及每组基因的表达的差异。
1.3 统计学处理分析
2 结果
2.1 肌细胞中钙离子含量变化
从表1可知,与对照组钙浓度241.4 nmol/L相比,右美托咪定处理组促使大鼠肌细胞中钙离子含量均增加,钙浓度分别增加了39.0 nmol/L、61.1 nmol/L,其中右美托咪定含量越高,促使肌细胞中钙浓度双向增加的越多,差异具有统计学意义(P<0.05)。
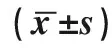
表1 不同处理条件下肌细胞钙离子含量
注:a与对照组比较,P<0.05;b与低剂量组相比较,P<0.05。
2.2 肌细胞中线粒体琥珀酸脱氢酶(MSDH)活性比较
由表2可知,右美托咪定诱导浓度越高,线粒体中琥珀酸脱氢酶酶活性增加越多,差异具统计学意义(P<0.05)。
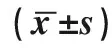
表2 不同处理条件下线粒体琥珀酸脱氢酶活性比较
注:a与对照组比较,P<0.05;b与低剂量组相比较,P<0.05。
2.3 肌细胞线粒体膜电位的变化
由表3可知,在右美托咪定的作用下,肌细胞线粒体膜电位较对照组增加,且右美托咪定诱导浓度越高,肌细胞中的线粒体膜电位增加越多,差异具统计学意义(P<0.05)。
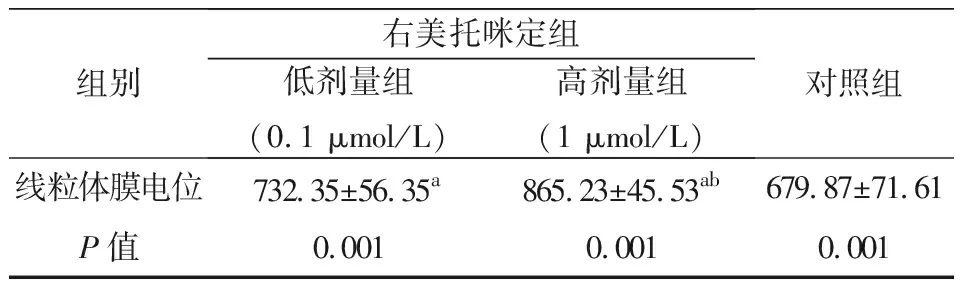
表3 不同处理条件下肌细胞线粒体膜电位
注:a与对照组比较,P<0.05;b与低剂量组相比较,P<0.05。
2.4 肌细胞中ATP,ADP,AMP含量变化的测定
由表4可知,当使用右美托咪定作用于大鼠的肌细胞后,大鼠肌细胞中的ATP、ADP以及AMP均出现增长,且高浓度的右美托咪定使得大鼠肌细胞ATP、ADP以及AMP增加更显著,数据差异有统计学意义(P<0.05)。
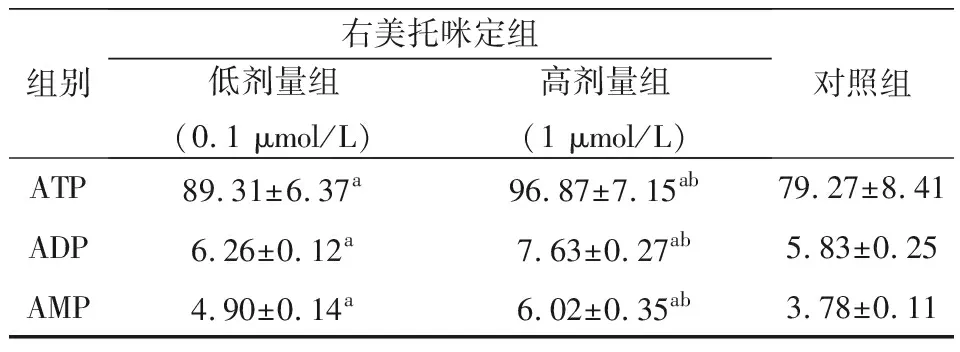
表4 不同处理条件下肌细胞中ATP、ADP、AMP含量
注:a与对照组比较,P<0.05;b与低剂量组相比较,P<0.05。
2.5 肌细胞细胞凋亡率变化
表5可知,不同处理条件下肌细胞细胞凋亡率变化情况。其中对照组细胞凋亡率正常情况下为4.58%,当使用右美托咪定作用于肌细胞后,其细胞凋亡率明显下降,低剂量组右美托咪定肌细胞较对照组细胞凋亡率下降了1.33%,高剂量右美托咪定肌细胞较对照组细胞凋亡率下降了2.46%,呈显著变化,数据差异有统计学意义(P<0.05)。

表5 不同处理条件下肌细胞细胞凋亡率
注:a与对照组比较,P<0.05;b与低剂量组相比较,P<0.05。
2.6 肌细胞中Ca2+-ATPase,Na+-K+-ATPase酶活性的测定
由表6可知,当使用右美托咪定诱导作用于肌细胞后其Ca2+-ATPase和Na+-K+-ATPase的酶活性均增加,且右美托咪定浓度越高,肌细胞的酶活性增加越高,肌细胞能量代谢相对较高,数据差异具有统计学意义(P<0.05)。

表6 不同处理条件下肌细胞中Ca2+-ATPase,Na+-K+-ATPase酶活性
注:a与对照组比较,P<0.05;b与低剂量组相比较,P<0.05。
2.7 Western Blot检测大鼠Caspse3表达
从图1可看出,各处理组Caspse3目标条带与β-action参比条带的灰度值,并通过软件测定计算得到与对照组相比,右美托咪定处理组大鼠Caspse3蛋白表达基因均明显下降。与对照组的Caspse3灰度值84.5%比,低剂量右美托咪定Caspse3灰度值为64.8%,高剂量右美托咪定Caspse3灰度值为23.4%,故右美托若定处理后细胞凋亡中Caspse3基因表达降低。
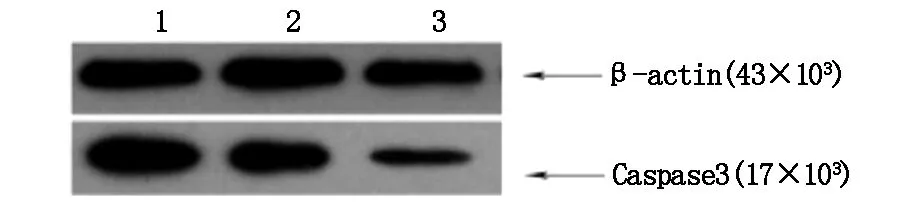
1:对照组 2:低剂量DEX组 3:高剂量DEX组
2.8 PCR技术检测大鼠线粒体周围能量基因的表达情况
由图2 可知在不同右美托咪定处理后,大鼠右美托咪定组与对照组处理前后基因表达情况,Ndufa1、Ndufab1、Ndufb2、Ndufs8、Sdha基因代码为线粒体产能的相关基因,可知在右美托咪定诱导处理后大鼠的Fold值均升高,且高剂量组Fold值高于低剂量组。

图2 不同处理情况下大鼠线粒体周围能量基因的表达
3 讨论
研究表明,右美托咪定对多种器官具有保护作用[20]。人体大脑缺血会导致脑组织细胞受损,神经元坏死凋亡,然而研究表明右美托咪定可促进抗凋亡基因的表达,抑制促凋亡基因的表达,从而减少神经元的凋亡,同时会降低儿茶酚胺的释放;在肺功能上,右美托咪定会产生抑制炎性反应抗氧化应激,活化AKt信号通路;对于心脏功能影响中,右美托咪定具有较好的保护作用。右美托咪定可直接作用于心肌细胞,降低心肌缺血再灌注导致去甲肾上腺素的释放,同时减轻凋亡和炎症反应等等[21]。
右美托咪定对于大脑、心脏、肝脏、肾功能、肠黏膜等均具有一定的保护作用,尤其在围手术期对心脏的保护作用上[22]。Ca2+在细胞内转运的过程需要Ca2+-Mg2+-ATP酶的磷酸化和ATP水解供能,同时将连接的2个Ca2+释放到胞浆,引起肌细胞代谢变化。已有研究表明[12],右美托咪定可抑制钙离子通道的开放,同时会激活外向型的钾离子通道的开放,降低细胞内钙离子浓度,并会改变人体内神经元线粒体膜电位的变化,然而目前关于右美托咪定对于肌细胞钙浓度增加与能量代谢之间关系的研究较少。右美托若定对脓毒症患者外周线粒体能量代谢的研究中发现,脓毒症患者会由于炎症反应使得人体线粒体功能受损,线粒体产能基因受阻导致能量代谢减少,而当在早期使用右美托咪定时,线粒体产能基因表达增强,从而使机体的代谢水平较未使用患者增加[23,24]。在本文的研究中发现右美托咪定促使肌细胞钙浓度双相增加,且右美托咪定诱导剂量越高,肌细胞中测定的钙离子含量越高,而钙离子参与到细胞活动的调节中,且在细胞内转运的过程需要Ca2+-Mg2+-ATP酶的磷酸化和ATP水解供能,同时将连接的2个Ca2+释放到胞浆,引起肌细胞代谢变化。本研究显示,右美托咪定处理组促使大鼠肌细胞中钙离子含量均增加,钙浓度分别增加了39.0 nmol/L、61.1 nmol/L;线粒体中琥珀酸脱氢酶明显增加,在低剂量组达到(1.36±0.12)、高剂量组达到(1.68±0.17);线粒体膜电位变化显著增加,线粒体周围能量基因的表达也升高,ATP、ADP、AMP以及Ca2+-ATPase,Na+-K+-ATPase酶的活性也均有所增加,使得肌细胞中能量代谢增加,细胞凋亡率下降,细胞凋亡中Caspse3基因表达也降低。
综上所述,右美托咪定诱导使肌细胞钙浓度双相增加,促使线粒体中琥珀酸脱氢酶,线粒体膜电位变化以及ATP、ADP、AMP以及Ca2+-ATPase,Na+-K+-ATPase酶的活性增加,细胞凋亡率下降等变化,共同促使肌细胞三羧酸循环加快,细胞产能增加,能量代谢增强,机体代谢水平增强。

