健脾清化方对AngⅡ刺激下大鼠系膜细胞NADPH/p38MAPK 氧化应激通路的影响
邹 赟,何立群∗
(1.上海中医药大学附属曙光医院肾病科,上海 201203;2.上海中医药大学中医肾病研究所,上海 201203;3.上海市中医临床重点实验室,上海 201203)
健脾清化方是由何立群教授根据李东垣脾胃学说中“火与元气不两立,一胜则一负,脾胃气虚则下流于肾,阴火得以乘土位”的主要学术理论所制,其补虚之外清热燥湿之功尤著,切中慢性肾衰与湿热密不可分的密切关系,在长期的临床应用中已被证明具有显著改善肾功能的作用[1]。在前期的体内实验中证实,健脾清化方干预可显著下调了AT1/NADPH/p38MAPK 氧化应激通路的活化状态,从而有效减少了炎症因子的分泌,为其显著的临床疗效提供了实验依据[2]。本研究从体外实验的角度培养大鼠系膜细胞(MCs),观察其在AngⅡ的刺激下NADPH/p38MAPK 信号转导通路的活化,活性氧标志物MDA、SOD 的表达,以及健脾清化方的干预作用,旨在进一步从细胞水平验证该方改善慢性肾衰大鼠氧化应激可能的作用途径。
1 材料
1.1 动物、细胞株 正常大鼠肾脏系膜细胞株(HBZY-1)购自上海复盟基因生物科技有限公司。健康成年雄性SD 大鼠(SPF 级),8 周龄,体质量(200±20)g,由上海西普尔-必凯实验有限公司提供[SCXX(沪)2013-0016],共12 只,分笼饲养于上海中医药大学实验动物中心,25 ℃、12 h 光照、45%相对湿度的环境中,自由饮水,喂以标准普通饲料。
1.2 试药 氯沙坦钾片,100 mg/片(杭州默沙东制药有限公司,批号100395)。胎牛血清(FBS)、MEM 细胞培养基(美国Gibco 公司);AngII、胰蛋白酶(美国Sigma 公司);Trizol 法总RNA 抽提试剂盒、cDNA 第一条链反转录试剂盒、SYBR real-time 试剂盒(瑞士Roche 公司);超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒(中国南京建成生物工程研究所);p-p38MAPK 多克隆抗体(美国CST 公司);β-actin、二抗羊抗兔IgG(美国Santa Cruse);ECL 化学发光试剂盒(美国密理博公司);乙二胺四乙酸EDTA(法国Biowest 公司)。
2 方法
2.1 健脾清化方水煎剂制备 组方药材党参15 g、生黄芪15 g、草果仁6 g、苍术10 g、黄连3 g、制大黄9 g,共计58 g,由上海中医药大学中药研究所提供,水煎浓缩为生药量0.58 g/mL。
2.2 含药血清的制备 12 只SD 大鼠随机分为正常组、健脾清化方组、氯沙坦组,每组4 只,氯沙坦钾片研成细粉,用生理盐水配成1 mg/mL 的混悬液。健脾清化方组按5.8 g/kg 灌胃,氯沙坦组按10 mg/kg 灌胃,用药剂量按人体(70 kg 体质量)每公斤体质量用药量6 倍进行换算,1 次/d,共3 d;正常组同体积生理盐水灌胃。末次给药后2 h 腹主动脉取血,冷冻离心机3 000 r/mim 离心10 min,0.22 μm 微孔滤膜过滤除菌,分装,放入-80 ℃低温冰箱冻存。
2.3 细胞分组及给药 大鼠肾小球系膜细胞株常规培养于含10%胎牛血清的MEM 培养基中,培养条件为温度37 ℃,饱和湿度5% CO2,每2~3 d 用含0.05% EDTA 的胰酶消化传代,传代后第3~5代的细胞用于实验。取对数生长期的系膜细胞,0.25%胰蛋白酶消化,含10%胎牛血清的MEM 培养液制成单细胞悬液,接种于6 孔无菌培养板,置于5% CO2、37 ℃饱和湿度下培养,待系膜细胞生长至80%融合,改用无血清培养液静置孵育24 h使细胞生长同步。细胞分组为①10%大鼠正常血清组,给予10%正常大鼠血清;②10%健脾清化方含药血清组,给予10%健脾清化方含药血清;③10%氯沙坦含药血清组,给予10% 氯沙坦含药血清;④10% 正常大鼠血清+Ang Ⅱ组,同时给予100 nmol/L AngⅡ和10%正常大鼠血清;⑤10%健脾清化方含药血清+AngⅡ组,同时给予100 nmol/L AngⅡ和10%健脾清化方含药血清;⑥10%氯沙坦含药血清+Ang Ⅱ组,同 时 给 予100 nmol/L Ang Ⅱ和10%氯沙坦含药血清,培养24 h。弃去培养基上清,用预冷的PBS 洗涤细胞1~2 次,用细胞刮刮下细胞,冰水浴超声裂解以充分破坏细胞,使其释放出细胞内成分,超声结束后离心收集上清,-70 ℃低温冰箱中保存。
2.4 检测不同时间点Ang Ⅱ刺激下系膜细胞p47phoxmRNA 表达 将系膜细胞传到培养板中,加入100 nmol/L Ang Ⅱ,分别处理不同时间(30 min、4 h、8 h、12 h、24 h)后收取细胞,Trizol 法提取大鼠肾小球系膜细胞总RNA,反转录成cDNA,采用RT-PCR 法检测系膜细胞在AngⅡ刺激下不同时间点p47phoxmRNA 表达,并在保证实验效果和稳定性的前提下,以表达量最高峰时对应的时间点作为后续各项指标的检测时间点。p47phoxmRNA 基因引物序列见表1。
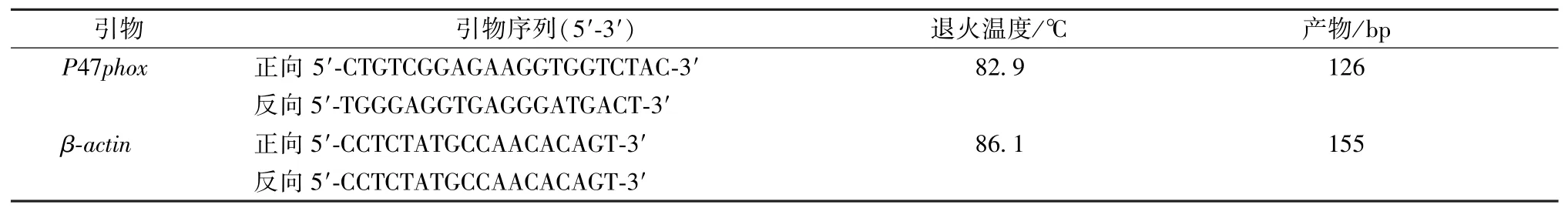
表1 引物信息Tab.1 Primer information
PCR 反应程序为95 ℃10 min,然后95 ℃15 s,60 ℃1 min,共40 个循环,计算p47phox和β-actin的Ct值(基因扩增到超过荧光最低检测水平的循环数),cDNA 的扩增倍数用β-actin作为校正基因,mRNA 表达的相对水平使用livak 法计算。每个样品做3 个复孔,取平均值。
2.5 检测各组含药血清对系膜细胞p47phoxmRNA表达的影响 采用RT-PCR 法。按“2.3”项下方法处理各组细胞,检测各组系膜细胞p47phoxmRNA 表达。每组均设3 个样品,每个样品测定2 次。
2.6 检测各组含药血清对系膜细胞MDA、SOD 水平的影响 采用化学发光法。按“2.3”项下方法处理各组细胞,根据试剂盒说明书步骤操作,计算MDA、SOD 水平。每组均设3 个样品,每个样品测定2 次。
2.7 检测各组含药血清对系膜细胞p-p38MAPK 水平的影响 采用Western blot 法。按“2.3”项下方法处理各组细胞,BCA 蛋白定量法测定各组蛋白质浓度。经8% SDS-PAGE 电泳分离蛋白质,将凝胶中的蛋白质转移至PVDF 膜上,膜用5%脱脂牛奶室温封闭1 h 后,TBS-T 洗膜3 次,5 min/次,然后加入一抗4 ℃孵育过夜,次日TBS-T 洗膜洗3次,5 min/次,辣根过氧化物酶标记的二抗室温孵育1 h,TBS-T 洗膜后加入化学发光试剂曝光,用凝胶图像分析系统扫描分析条带的面积和灰度,蛋白区带用积分灰度值表达,以β-actin 作为对照。每组均设3 个样品,每个样品测定2 次。
2.8 统计学分析 应用SPSS 15.0 软件进行处理,计量数据以(±s)表示,组间比较采用单因素方差分析。P<0.05 表示差异有统计学意义。
3 结果
3.1 AngⅡ刺激下系膜细胞不同时间点p47phoxmRNA 表达 100 nmol/L Ang Ⅱ分别于0 min、30 min、4 h、8 h、12 h、24 h 处理系膜细胞,发现p47phoxmRNA 表达呈时间依赖性升高,0 min时最低(1.00±0.17),24 h 时最高(4.75±0.40)。
3.2 各组含药血清对系膜细胞p47phoxmRNA 表达的影响 如表2 所示,与10%正常大鼠血清组比较,10%正常大鼠血清+AngⅡ组p47phoxmRNA 表达显著升高(P<0.01);与10% 正常大鼠血清+AngⅡ组比较,10%健脾清化方+AngⅡ组、10%氯沙坦+Ang Ⅱ组明显降低了p47phoxmRNA 表达(P<0.01)。
3.3 各组含药血清对系膜细胞MDA、SOD 水平的影响 如表3 所示,与10%大鼠正常血清组比较,10%大鼠正常血清+AngⅡ组SOD 水平显著降低,MDA 水平显著升高(P<0.01);与10%大鼠正常血清+AngⅡ组比较,10% 健脾清化方+AngⅡ组、10%氯沙坦+AngⅡ组能明显上调SOD 水平,下调MDA 水平(P<0.01)。
表2 各组含药血清对系膜细胞p47phox mRNA 表达的影响(±s, n=3)Tab.2 Effects of medicated serum on MCs p47phox mRNA expression of each group(±s, n=3)

表2 各组含药血清对系膜细胞p47phox mRNA 表达的影响(±s, n=3)Tab.2 Effects of medicated serum on MCs p47phox mRNA expression of each group(±s, n=3)
注:与10%大鼠正常血清组比较,∗∗P<0.01;与10%大鼠正常血清+AngⅡ组比较,##P<0.01
表3 各组含药血清对系膜细胞MDA、SOD 水平的影响(±s, n=3)Tab.3 Effects of medicated serum on MCs MDA,SOD levels of each group(±s, n=3)

表3 各组含药血清对系膜细胞MDA、SOD 水平的影响(±s, n=3)Tab.3 Effects of medicated serum on MCs MDA,SOD levels of each group(±s, n=3)
注:与10%大鼠正常血清组比较,∗∗P<0.01;与10%大鼠正常血清+AngⅡ组比较,##P<0.01
3.4 各组含药血清对系膜细胞p-p38MAPK 蛋白表达的影响 如图1、表4 所示,与10%大鼠正常血清组比较,10% 大鼠正常血清+Ang Ⅱ组p-P38MAPK 蛋白表达显著升高(P<0.01);与10%大鼠正常血清+AngⅡ组比较,10% 健脾清化方+AngⅡ组、10% 氯沙坦+AngⅡ组p-P38MAPK 蛋白表达显著降低(P<0.01)。

图1 各组含药血清对p-p38MAPK 蛋白表达的影响Fig.1 Effects of medicated serum on p-p38MAPK protein expression of each group
表4 各组含药血清对p-p38MAPK 蛋白表达的影响(±s, n=3)Tab.4 Effects of medicated serum on p-p38MAPK protein expression of each group(±s, n=3)
注:与10%大鼠正常血清组比较,∗∗P<0.01;与10%大鼠正常血清+AngⅡ组比较,##P<0.01
4 讨论
肾小球系膜细胞(MCs)是肾小球中最具有活性的固有细胞[3],体外实验已经证明其增殖和细胞外基质的增加几乎是所有呈慢性进行性发展的肾脏疾病一个最主要的组织学特征[4-5]。因此,这部分体外实验选取系膜细胞为研究对象,模拟慢性肾衰的共同病变过程-肾纤维化的病理变化过程进行研究。
AngⅡ是肾素-血管紧张素系统(RAS)的主要活性肽产物[6],有研究发现,它还与肾小球系膜细胞增殖肥大以及细胞外基质的产生有关,而这些均是导致肾小球硬化的关键因素[7],众多实验显示其机制可能与促炎性反应和氧化应激有关[8]。Lv 等[9]报道,AngⅡ介导了系膜细胞的凋亡和细胞内ROS 的产生,而AT1R 拮抗剂坎地沙坦可抑制这个过程,具有抗凋亡和抗氧化作用。作为NADH/NADPH 氧化酶重要的刺激因子[10],AngⅡ可以诱导血管平滑肌细胞、内皮细胞和肾小管上皮细胞等产生过多的ROS,启动氧化应激反应[11]。
体外实验显示,AngⅡ刺激后肾小球系膜细胞内NADPH 氧化酶亚基p47phoxmRNA 的表达与刺激时间呈正相关,至24 h 达峰值,且表达稳定,故在随后的指标观察中均选择24 h 这个时间点进行观察。10% 大鼠正常血清加入Ang Ⅱ刺激后p47phox表达显著升高,提示NADPH 介导的氧化应激途径由AngⅡ诱发而迅速活化,10%大鼠正常血清+AngⅡ组与10%健脾清化+AngⅡ组、10%氯沙坦+AngⅡ组的比较显示,健脾清化方和科素亚的干预能显著减少p47phoxmRNA 的表达。表2 说明,健脾清化方能有效调控肾小球MCs 氧化应激反应中重要环节NADPH 氧化酶亚基p47phoxmRNA 的表达,从而减轻氧化应激反应。ROS 是氧化应激反应的核心环节,通过检测SOD 和MDA 这2 种氧化应激标志物来反映ROS 的表达情况。由表3 可知,大鼠正常血清加入AngⅡ培养后系膜细胞内氧化与抗氧化平衡被打破,SOD 的显著下降显示存在抗氧化防御能力的代偿不足,最终导致了氧化应激发生,生物膜的脂质过氧化增加,使MDA大量生成,两者与正常血清组差异明显(P<0.01)并呈氧化应激状态;加入药物干预后,无论是健脾清化方还是氯沙坦,都能明显降低MDA 水平,提高SOD 水平,与前期的体内实验结果完全一致。
已有研究发现[12],在血管紧张素Ⅱ的刺激下,由NADPH 氧化酶介导的氧化应激产生过量ROS,后者又是诱导MAPKs 磷酸化、活化MAPK 信号通路的重要因素。此次研究也发现(表4),正常大鼠血清加入AngⅡ后p-p38MAPK 表达量显著升高,推测氧化应激可能与炎症因子相关,与p38 的信号通路激活也密不可分,与前期报道一致。健脾清化方和氯沙坦干预后,磷酸化p38 表达明显下降(P<0.01),说明两者均能明显抑制系膜细胞p38MAPK 信号转导通路的磷酸化。
本研究证实,AngⅡ可以上调肾小球系膜细胞NADPH 氧化酶亚基p47phox基因和刺激细胞内ROS 的生成,活化p38MAP 信号转导通路,健脾清化方和AT1R 拮抗剂氯沙坦干预后能够明显抑制上述氧化反应,并抑制继而发生的p38 信号转导通路磷酸化,进一步从细胞水平验证了氧化应激在慢性肾衰发病中的作用机制以及健脾清化方临床取效的作用途径,提示AngⅡ可能部分通过诱导细胞内NADPH 介导的ROS 产生,激活p38 信号转导通路,促进肾小球系膜细胞表达下游炎症因子,从而引起肾小球系膜基质增生和系膜区增宽,最终导致肾小球纤维化、肾功能衰竭,而健脾清化方治疗对于氧化应激的改善作用可能有助于延缓慢性肾衰的发生发展进程。鉴于中药多层次多靶点的治疗特色,今后可考虑从其他氧化应激通路和炎症信号转导通路,以及各信号通路之间的相互关系进行更为深入的研究。

