半夏泻心结肠靶向片的制备及其体外释放行为
余 巧,冯白茹,申 茹,李大炜,徐英辉,祁银德
(惠州卫生职业技术学院,广东 惠州 516025)
半夏泻心汤源自《伤寒论》,由半夏、黄芩、黄连、干姜、人参、炙甘草、大枣7 味药材组成,可辛开苦降、散结消痞,主治寒热错杂之痞证。大量研究表明[1-7],半夏泻心汤是现代疾病(如慢性胃炎、胃溃疡、慢性结肠炎、功能性消化不良,溃疡性结肠炎等)临床常用的基础方,但存在煎煮耗时、服用麻烦、不易携带和长时间贮存的缺点;保留灌肠治疗时,药液又受体位因素影响而难以充分接触所有受损肠黏膜,而且操作麻烦,患者舒适度差。因此,本实验将半夏泻心汤开发成结肠靶向片,不仅能避免汤剂、灌肠剂的缺点,还可直接将药物运送到病灶部位来发挥疗效,为临床治疗肠道疾病提供了新剂型。
1 材料
1.1 仪器 Agilent 1260 高效液相色谱仪(美国安捷伦科技公司);RE-3000A 旋转蒸发器(上海越众仪器设备有限公司);B00Y 高速多功能粉碎机(永康市铂欧五金制品有限公司);JA3003 电子天平(上海舜宇恒平科学仪器有限公司);TDP-6 单冲式压片机(吉首市中诚制药机械厂);BZF-50 真空干燥箱(上海博迅实业有限公司);BPG-9240A鼓风干燥箱(上海百典仪器设备有限公司);BY300 A 小型包衣机(上海黄海药检仪器有限公司);RC-6D 溶出度测试仪(天津市新天光分析仪器技术有限公司)。
1.2 试药 黄芩苷(批号BWB50476 170421)、盐酸小檗碱(批号BWB50137 170113)对照品(北京世纪奥科生物技术有限公司,含有量≥98%)。甲基丙烯酸-甲基丙烯酸甲酯共聚物(Eudragit S100,德国Evonik Rohm GmbH 公司,批号B170105202)。半夏、黄芩、黄连、干姜、人参、炙甘草、大枣均购于北京同仁堂惠州药店有限责任公司,经惠州卫生职业技术学院中药教研室祁银德副教授鉴定为正品。药用微晶纤维素(SH-CG1,安徽山河药用辅料股份有限公司,批号171103);交联聚维酮(ISP XL,合肥巴斯夫生物科技有限公司,批号BSF180610);滑石粉(郑州宏升滑石制品有限公司);邻苯二甲酸二乙酯(上海麦克林生化科技有限公司)。甲醇、乙腈为色谱纯;其余试剂均为分析纯;水为超纯水。
2 方法与结果
2.1 药材提取
2.1.1 煎煮法 称取处方量(法半夏12 g、黄连3 g、黄芩9 g、干姜9 g、人参9 g、炙甘草9 g、大枣3 枚)药材粗粉,第1 次以8 倍量纯化水煎煮1 h,第2 次以6 倍量纯化水煎煮1 h,滤过,合并滤液,定容至500 mL 备用。
2.1.2 浸渍法 称取处方量药材粗粉,加14 倍量70%乙醇浸渍72 h,滤过,滤液定容至500 mL备用。
2.1.3 回流法 称取处方量药材粗粉,第1 次加8 倍量70% 乙醇回流提取1 h,第2 次加6 倍量70%乙醇回流提取1 h,滤过,合并滤液,定容至500 mL 备用。
2.1.4 渗漉法 称取处方量药材粗粉,加2 倍量70%乙醇拌匀,润湿,装筒,浸渍24 h,再以12倍量70%乙醇渗漉,速度3 mL/(min·kg),渗漉液定容至500 ml,备用。
2.1.5 结果分析 将“2.1.1”~“2.1.4”项下滤液进样测定,按下式计算黄芩苷、盐酸小檗碱含有量;前期实验显示,黄芩苷提取率较高,故评分时设定其权重为0.75,而盐酸小檗碱为0.25,计算综合评分,结果见表1。最终,选择渗漉法进行提取。


表1 提取方法考察结果Tab.1 Results of extraction method investigation
2.2 正交试验 以粉碎度(A)、乙醇体积分数(B)、乙醇用量(C)、渗漉速度(D)为影响因素,采用L9(34)正交表设计试验,因素水平见表2,结果见表3,方差分析见表4。

表2 因素水平Tab.2 Factors and levels

表3 试验设计与结果Tab.3 Design and results of tests
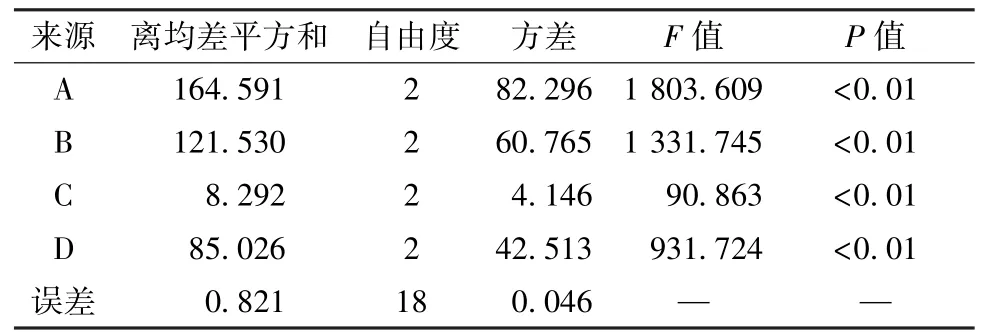
表4 方差分析Tab.4 Analysis of variance
由此可知,各因素对综合评分都有显著影响(P<0.01),程度依次为A >B >D >C,即粉碎度、乙醇体积分数影响较大,渗漉速度次之,乙醇用量最小。最终,确定最优提取工艺为A2B2C2D1,即药材粉碎成粗粉后加10 倍量70% 乙醇,以2~3 mL/(min·kg)速度进行渗漉。
然后,将处方量药材放大10 倍,按优化工艺进行渗漉提取,进行3 批验证试验,结果见表5,可知工艺稳定可行。
2.3 结肠靶向片制备
2.3.1 片芯 取处方药材粗粉(法半夏120 g、黄连30 g、黄芩90 g、干姜90 g、人参90 g、炙甘草90 g、大枣30 枚),按优化工艺渗漉,渗漉液回收乙醇后浓缩成浸膏(相对密度1.35,黄芩苷、盐酸小檗碱含有量分别为74.18、12.55 mg/g)。取浸膏200 g,加入辅料(微晶纤维素∶淀粉=3∶1)100 g,60 ℃下干燥,粉碎,加入适量95%乙醇,14目筛湿法制粒,湿颗粒于60 ℃下干燥后用14 目筛整粒,再加入总颗粒量3%交联聚维酮、1%微晶纤维素、1%滑石粉,压片,片重(0.80±0.04)g,黄芩苷、盐酸小檗碱含有量分别为48.5、8.6 mg/g。

表5 验证试验结果(Ⅰ, n=3)Tab.5 Results of verification tests(Ⅰ, n=3)
2.3.2 包衣液 将Eudragit S100 分散于95%乙醇中形成均匀胶体溶液,加入邻苯二甲酸二乙酯、滑石粉,再加95%乙醇至100 mL,搅拌混匀。将片芯置包衣锅中(倾角45°),转速30~35 r/min,鼓入热风(温度40~50 ℃),预热,包衣,即得。
2.4 黄芩苷含有量测定
2.4.1 色谱条件 LiChrospher C18色谱柱(4.0 mm×250 mm,5 μm);流动相甲醇-0.1% 磷酸(47∶53);检测波长280 nm;柱温25 ℃;体积流量0.8 mL/min;进样量10 μL。
2.4.2 对照品溶液制备 精密称取黄芩苷对照品适量,甲醇溶解,制成每1 mL 含1.10 mg 该成分的溶液,即得。
2.4.3 供试品溶液制备 结肠靶向片除去包衣,研细,精密称取约0.2 g,置于具塞锥形瓶中,加入20 mL 甲醇,超声(功率250 W、频率30 kHz)30 min,放冷,甲醇定容于25 mL 量瓶,摇匀,滤过,取续滤液,即得。
2.4.4 阴性样品溶液制备 取除黄芩以外的药材制成结肠靶向片,按“2.4.3”项下方法制备,即得。
2.4.5 专属性考察 取对照品、供试品、阴性样品溶液,在“2.4.1”项色谱条件下各进样10 μL测定,结果见图1。由图可知,供试品、对照品均能得到较好的分离,阴性无干扰。

图1 黄芩苷HPLC 色谱图Fig.1 HPLC chromatogram of baicalin
2.4.6 线性关系考察 对照品溶液依次稀释至11、22、55、110、220、550 μg/mL,在“2.4.1”项色谱条件下进样10 μL 测定。以黄芩苷质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,得方程Y=41.887X-113.37(r=0.999 9),在11~550 μg/mL 范围内线性关系良好。
2.4.7 稳定性试验 取同一供试品溶液,于0、2、4、8、12、24 h 在“2.4.1”项色谱条件下进样测定,测得黄芩苷含有量RSD 为1.40%,表明溶液在24 h 内稳定性良好。
2.4.8 精密度试验 精密吸取对照品溶液10 μL,在“2.4.1”项色谱条件下进样测定6 次,测得黄芩苷峰面积RSD 为1.36%,表明仪器精密度良好。
2.4.9 重复性试验 取同一批样品6 份,按“2.4.3”项下方法制备供试品溶液,在“2.4.1”项色谱条件下进样测定,测得黄芩苷含有量RSD为1.50%,表明该方法重复性良好。
2.4.10 加样回收率试验 取含有量已知的样品9份,加入低、中、高3 个水平的对照品溶液,按“2.4.3”项下方法制备供试品溶液,在“2.4.1”项色谱条件下进样10 μL 测定,测得黄芩苷平均加样回收率分别为100.69%、101.70%、100.17%,RSD 分别为2.38%、2.45%、1.26%。
2.5 盐酸小檗碱含有量测定
2.5.1 色谱条件 LiChrospher C18色谱柱(4.0 mm×250 mm,5 μm);流动相乙腈-0.05 mol/L磷酸二氢钾(30∶70,磷酸调节pH 至3.0);检测波长345 nm;柱温25 ℃;体积流量1.0 mL/min;进样量10 μL。
2.5.2 对照品溶液制备 精密称取盐酸小檗碱对照品适量,甲醇溶解,制成每1 mL 含0.4 mg 该成分的溶液,即得。
2.5.3 供试品溶液制备 同“2.4.3”项。
2.5.4 阴性样品溶液制备 取除黄连以外的药材制成结肠靶向片,按“2.5.3”项下方法制备,即得。
2.5.5 专属性考察 取对照品、供试品、阴性样品溶液,在“2.5.1”项色谱条件下各进样10 μL测定,色谱图见图2。由图可知,供试品、对照品均能得到较好的分离,阴性无干扰。

图2 盐酸小檗碱HPLC 色谱图Fig.2 HPLC chromatogram of berberine hydrochloride
2.5.6 线性关系考察 盐酸小檗碱对照品溶液依次稀释至2、8、20、40、80、160 μg/mL,在“2.5.1”项色谱条件下进样10 μL 测定。以盐酸小檗碱质量浓度为横坐标(X),峰面积为纵坐标(Y),得方程Y=24.428X-51.774(r=0.999 9),在2~160 μg/mL 范围内线性关系良好。
2.5.7 稳定性试验 取同一供试品溶液,于0、2、4、8、12、24 h 在“2.5.1”项色谱条件下进样测定,测得盐酸小檗碱含有量RSD 为1.44%,表明溶液在24 h 内稳定性良好。
2.5.8 精密度试验 精密吸取对照品溶液10 μL,在“2.5.1”项色谱条件下进样测定6 次,测得盐酸小檗碱峰面积RSD 为1.74%,表明仪器精密度良好。
2.5.9 重复性试验 取同一批样品6 份,按“2.5.3”项下方法制备供试品溶液,在“2.5.1”项色谱条件下进样测定,测得盐酸小檗碱含有量RSD 为1.61%,表明该方法重复性良好。
2.5.10 加样回收率试验 取含有量已知的样品9份,加入低、中、高3 个水平的对照品溶液,按“2.5.3”项下方法制备供试品溶液,在“2.5.1”项色谱条件下各进样10 μL 测定,测得盐酸小檗碱平均加样回收率分别为102.85%、101.73%、100.90%,RSD 分别为1.17%、2.22%、2.63%。
2.6 体外释放度评价及包衣处方筛选
2.6.1 体外释放度 按2015 年版《中国药典》四部0931 溶出度与释放度测定法中第三法(即小杯法)[8],转速70 r/min,温度(37±0.5)℃,溶出液体积150 mL,测定介质和时间分别为0.1 mol/L盐酸2 h、pH 6.8 磷酸盐缓冲液[9]4 h、pH 7.8~8.0 磷酸盐缓冲液[9]1 h。在介质转换时间点将前一介质倾出,然后加入温度(37±0.5)℃的后一种介质,继续进行释放实验,不同溶出介质更换应于5 min 内完成[10]。每个时间点各取样1 mL,过0.45 μm 微孔滤膜,同时补充同温同体积新鲜介质,HPLC 法测定黄芩苷、盐酸小檗碱含有量,计算累积释放度。
2.6.2 增塑剂用量 选择邻苯二甲酸二乙酯作为增塑剂,按表6 处方配制包衣液,使片芯增重8%,测定体外释放度,结果见表7。由表可知,当邻苯二甲酸二乙酯用量为0.4%时(处方1),药片在人工小肠液中4 h 后衣膜出现裂缝,黄芩苷、盐酸小檗碱体外累积释放率分别为10.1%、9.2%,泄漏较多;为0.6%、0.8%(处方2、3)时,包衣片在小肠液中衣膜完整无裂缝,药物泄露较少。因此,选择处方2,即邻苯二甲酸二乙酯用量为0.6%。

表6 包衣处方Tab.6 Coating formulations

表7 增塑剂用量对各成分体外释放度的影响(%)Tab.7 Effects of plasticizer consumption on the in vitro release rates of various constituents(%)
2.6.3 包衣增重 按表6 中的处方2 称取适量Eudragit S100、邻苯二甲酸二乙酯、滑石粉,制备包衣液,使片芯分别增重6%、8%、10%,测定体外释放度,结果见表8。由表可知,在人工胃液中释放2 h 后包衣片均无药物释放;包衣增重为8%时,包衣片在人工小肠液中4 h 后泄露不明显,而在人工结肠液中1 h 后黄芩苷、盐酸小檗碱累积释放率明显高于包衣增重10%,分别达到89.1%、86.4%。因此,选择包衣增重为8%。2.6.4 验证试验 按“2.3”项下工艺制备3 批结肠靶向片,测定体外释放度,结果见表9,可知样品均具有结肠定位释药性能,而且基本稳定。

表8 包衣增重对各成分体外释放度的影响(%)Tab.8 Effects of coating weight gain on the in vitro release rates of various constituents(%)

表9 验证试验结果(Ⅱ, n=3,%)Tab.9 Results of verification tests(Ⅱ, n=3,%)
3 讨论
本实验采用渗漉法作为半夏泻心结肠靶向片最佳提取工艺,并且发现药材粉碎成中粉时,很容易堵塞孔隙而妨碍溶剂通过,渗漉液不能顺利流出,导致操作困难,提取率也很低,故选择粉碎度为粗粉。
口服结肠靶向给药是指通过药物传输系统口服给药后,药物不在上消化道释放,而是到达人体回盲部后才开始崩解或溶出[11-13]。目前,pH 依赖型结肠包衣常用的材料为丙烯酸树脂类,其中Eudragit S100 在pH>7.0 时包衣层开始溶解,可达到结肠释药的目的,故选择其作为包衣材料进行结肠包衣[14-15]。
包衣液浓度、增塑剂用量、包衣增重等是达到理想包衣效果的关键因素,其中包衣液浓度不能太大,否则在包衣过程中容易出现黏连现象,可适当添加滑石粉;添加增塑剂可提高包衣膜柔韧性,但其用量过大也会影响指标成分在人工结肠液中的释放;包衣增重过少,包衣层不能完全覆盖片芯,导致药物提前释放,而过多时包衣层太厚,导致溶解缓慢,药物难以释放出来。
本实验发现,所制备的半夏泻心结肠靶向片在人工胃液中无释放,人工肠液中黄芩苷、盐酸小檗碱累积溶出度均小于5%,人工结肠液中1 h 后两者均达85% 以上,符合结肠靶向片要求。同时,验证试验也印证了提取方法和包衣工艺稳定可行,可为后期中药新剂型研发提供理论依据。

