新辅助化疗联合手术治疗骨肉瘤的长期效果分析
陈辉 陈嵩 陈培生 陈顺有 林建华
【摘要】 目的:通過平均10年随访分析新辅助化疗联合手术治疗骨肉瘤(osteosarcoma,OS)的临床预后。方法:收集2005年1月-2010年4月在福建医科大学附属第一医院被诊断为OS的患者资料,包括性别、年龄、外科分期、病理分型、影像学资料等。纳入病理确诊骨肉瘤,采用多柔比星(ADM)、顺铂(DDP)和异环磷酰胺(IFO)联合化疗(术前1+术后6疗程),随访资料完整的患者。结果:纳入44例患者,男25例,女19例,年龄12~74岁,中位年龄18岁,平均(23.68±12.82)岁。目前随访时间97~162个月,平均(121.36±15.46)个月,超过10年。总的来说,生存率为43.19%(19/44),中位生存期为27个月,平均生存期为(64.07±52.36)个月(6~162个月)。总体死亡25例,发生在初诊1、3、5、10年内的分别占44%(11/25)、88%(22/25)、96%(24/25)和100%(25/25)。病程中发生转移高达65.91%(29/44),发生在初诊即刻、1、3、5、10年内的分别为13.79%(4/29)、75.86%(22/29)、96.55%(28/29)、100%(29/29)和100%(29/29)。转移型和非转移型患者10年生存率分别为31.03%(9/29)和66.7%(10/15),差异有统计学意义(P<0.000)。结论:采用新辅助化疗联合手术治疗后,OS患者平均随访10年生存率较短期随访显著降低,而转移率无明显变化;转移和死亡的发生主要集中在初诊的3年内,转移型患者的死亡率显著高于非转移型患者。
【关键词】 骨肉瘤; 新辅助化疗; 长期疗效
doi:10.14033/j.cnki.cfmr.2019.23.002 文献标识码 A 文章编号 1674-6805(2019)23-000-04
【Abstract】 Objective:To analyze the clinical prognosis of osteosarcoma(OS) after treatment with neoadjuvant chemotherapy combined surgery through 10 years follow-up.Method:The data of patients diagnosed with OS in The First Affiliated Hospital of Fujian Medical University from January 2005 to April 2010 were collected,including gender,age,surgical staging,pathological classification and imaging material.Inclusion criteria:pathological diagnosis as osteosarcoma,had been treated with chemotherapy(ADM,CP and IFO) a period before surgery and 6 period after,and follow-up data integrity.Result:Forty-four patients included in this study,25 male and 19 female,median age 18 years,rang 12-74 years,average (23.68±12.82)years.The follow-up time average more than 10 years,average (121.36±121.36)months,rang 97-162 month.The overall survival rate was 43.19%(19/44),the median survival time was 27 months,and the average survival time was (64.07±52.36)months,rang 6-162 month.25 cases have been dead,the deaths occur in 1,3,5,10 years after diagnosed were 44%(11/25),88%(22/25),96%(24/25) and 100%(25/25) respectively.The general metastatic rate as high as 65.91%(29/44) through the course of disease,metastasis happened in the immediate,1,3,5,10 years after diagnosed were 13.79%(4/29),75.86%(22/29) and 96.55%(28/29),100%(29/29) and 100%(29/29) respectively.The 10 years survival rate of patients with or without metastasis was 31.03%(9/29) and 66.7%(10/15) respectively(P<0.000).Conclusion:The survival rate is obviously decreased but the metastatic rate slightly changes after a average 10 years follow-up compared with the results of short-term follow-up.The occurrence of metastasis and death is mainly concentrated in the first three years of disease,the mortality rate is significantly higher in patients with metastasis than who without.
【Key words】 Osteosarcoma; Neoadjuvant chemotherapy; Long-term efficacy
First-authors address:Fuzhou Second Hospital Affiliated to Xiamen University,Fuzhou 350007,China.
骨肉瘤(osteosarcoma,OS)是最常见的青少年原发性恶性骨肿瘤,男性多于女性[1]。目前OS患者的5年生存率仍然徘徊在50%~70%[2],超过1/4患者死于本病,给社会和家庭带来了沉重的影响。过去的观点认为,截肢是OS患者的主要治疗方法。然而,10余年来,随着新辅助化疗药物的发展,术前辅助化疗不仅可缩小病灶范围,而且可用于手术预后的评估及远处转移的预防,明显降低患者的截肢率,同时也使得OS总体生存率明显提高。新辅助化疗联合手术治疗OS的临床预后研究是近年来的热点。但目前多数为短期随访研究,少有临床长期随访报道,本文通过平均超过10年的随访,分析新辅助化疗联合手术治疗OS的长期疗效。
1 资料与方法
1.1 一般资料
选取2005年1月-2010年4月在福建医科大学附属第一医院被诊断为OS的患者。纳入标准:病理确诊骨肉瘤,采用多柔比星(ADM)、顺铂(DDP)和异环磷酰胺(IFO)联合化疗(术前1+术后6疗程),随访资料完整。总共纳入44例患者,男25例,女19例;年龄12~74岁,中位年龄18岁,平均(23.68±12.82)岁。按Enneking分期:ⅡA期7例,ⅡB期37例;按生长部位:股骨20例,胫骨14例,其他部位10例;按组织学类型:小细胞型2例,毛细血管扩张型3例,普通型(包括成骨细胞型、成软骨细胞型、成纤维细胞型等)39例。
1.2 方法
本课题组对存活的患者每年定期进行随访,针对原发病灶和肺部进行定期CT扫描。截至2018年6月,随访时间97~162个月,平均(121.36±15.46)个月。本课题组成员分别在2011年[3]和2012年[4]对这批OS患者进行了预后分析,分别报道了KISS1和GPR54蛋白的表达与OS患者预后的关系,发现短期随访结果生存率为54.5%,发生远处转移率为61.4%。但是,当年平均随访时间仅为29.19个月(6~55个月),由于随访时间较短,结果可能不够准确。现在将平均超过10年的随访结果报道出来。
1.3 统计学处理
应用SPSS 20.0统计软件,OS病例的中位生存分析和中位转移分析采用Kaplan-Meier检验法;计量资料采用(x±s)表示,其他临床资料的比较采用字2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结果
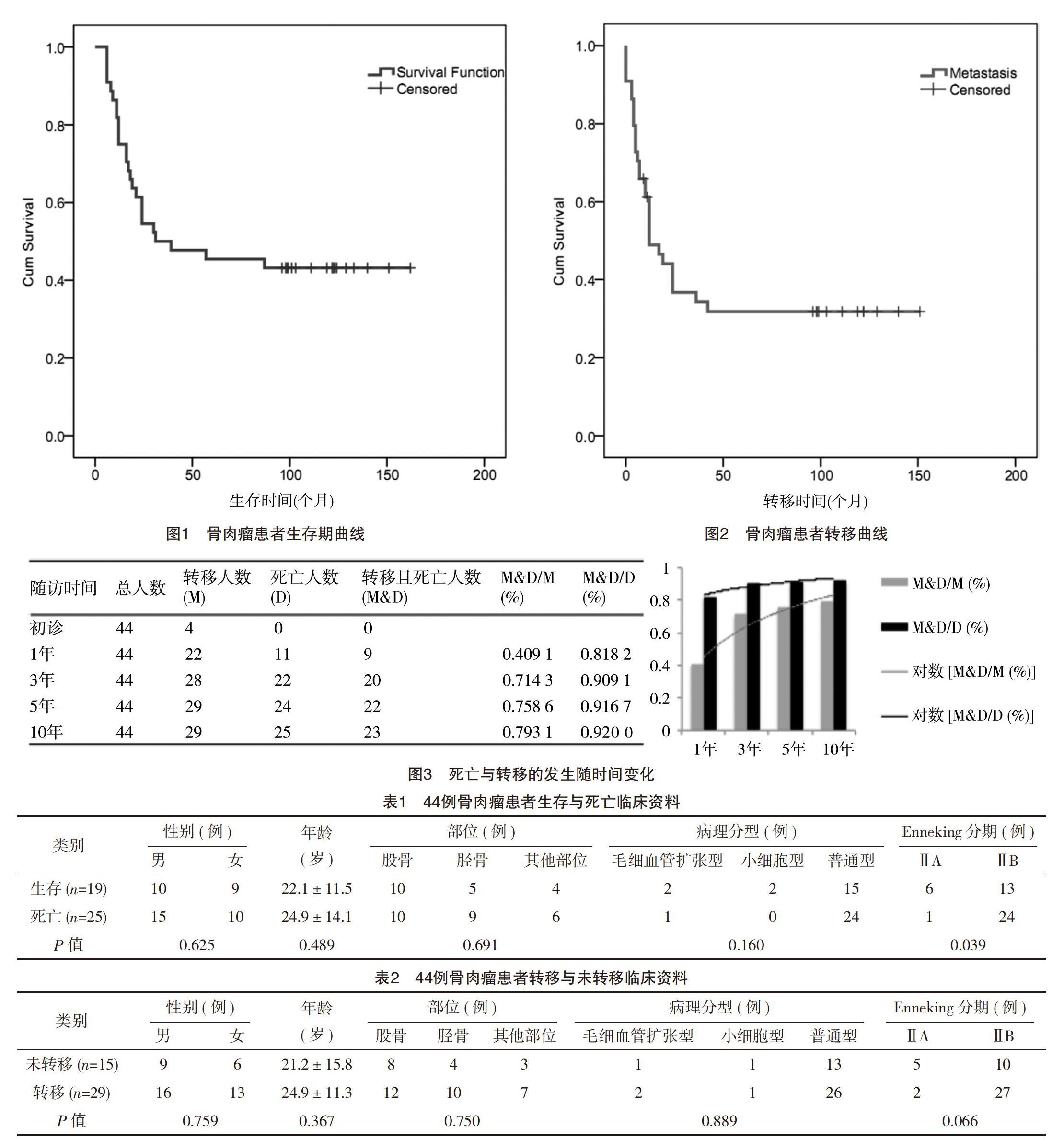
至2018年6月,随访时间97~162个月,平均(121.36±15.46)个月,总体生存率为43.2%(19/44),通过Recurrence free survival分析,中位生存期为27个月,平均生存期为(64.07±52.36)个月(6~162个月),见图1;整个病程中发生转移率高达65.9%(29/44),中位转移时间为7个月,平均转移时间为(11.00±10.56)个月(0~42个月),见图2;而在早期随访时(8年前),总体生存率和转移率分别为54.5%(24/44)、61.4%(27/44),长期随访的生存率显著低(P=0.000),而转移率无明显变化。
随访末期总的死亡人数为25例,死亡发生在初诊后1年内、3年内、5年内、10年内的分别占44%(11/25)、88%(22/25)、96%(24/25)和100%(25/25);可见,确诊1年内死亡的人数将近到达总体死亡人数的一半,并且大部分的患者死亡发生在确诊的3年内,见图1。
发病过程中发生转移总体人数为29例,肺部转移占绝对多数(25例)。分析后发现转移发生在初诊后即刻、1、3、5、10年内的分别为13.79%(4/29)、75.86%(22/29)、96.55%(28/29)、100%(29/29)和100%(29/29)。可见初诊时转移人数较少,但是在初診后1年内转移发生率迅速上升,3年后再发生转移的人数同样很少,5年后转移人数没有增加,因此5年和10年的转移率相同,因此,大部分的患者转移同样是发生在确诊的3年内,见图2。
进一步分析发现,病程中发生转移的患者(转移型患者)死亡率在1、3、5、10年内的分别为40.91%(9/22)、71.43%(20/28)、75.86%(22/29)和79.31%(23/29)。而非转移型患者的死亡率1、3、5、10年内的分别为9.09%(2/22)、12.5%(2/16)、13.33%(2/15)和13.33%(2/15)。转移型患者死亡率显著高于非转移型患者,见图3。
此外,外科分级ⅡB期的患者比ⅡA期的患者的患者死亡率显著升高(P=0.039),但是转移率无显著差别(P=0.066)。而生存率和转移率与年龄、性别、发生部位、病理分型无显著相关性,见表1、表2。
3 讨论
OS在年龄低于20岁的青少年人群中每年发病率约为8.7/1 000 000,约占儿童各种肿瘤的6%,死亡率极高[5-6]。研究表明,年龄、性别、身高、高骨代谢疾病、辐射环境和遗传都是OS发生的危险因素[7-10]。
影响OS预后的因素也有很多,包括肿瘤的部位、范围大小、发病年龄、是否伴发转移、对化疗的反应、手术方式等[11-19]。最近的一篇大样本Meta分析结果显示,性别也与预后相关[16]。笔者的研究发现,男性发病率比女性高(25∶19),但是性别对预后的影响并无统计学意义。另外,笔者的研究结果显示,发生转移后仍然存活的患者6例,这些患者化疗后转移病灶均消失,推断这些患者OS组织对化疗的反应良好,并且与预后相关,这与其他文献[16]报道的结果类似。关于病理分型是否能影响OS预后,目前并没有明确的证据,本研究中病理分型与转移及死亡并无显著相关性,因此病理分型可能并不是独立影响预后的因素,而应该同时应考虑Enneking分期的影响(本研究中3例毛细血管扩张型和2例小细胞型都是ⅡA期)。
虽然OS的治疗取得了一些进展,但目前仍然存在很多难题,OS患者远期存活率的改善仍然有限。尤其是转移型患者的预后仍然很差,而很多患者往往早期已发生转移,死于转移并發症的患者超过50%[20-21]。据统计,初诊时无转移的患者5年存活率可达65%~70%,而其中仅有10%~20%患者需行截肢手术[22-23]。但初诊时已有转移表现的患者预后仍不容乐观,伴有肺转移的患者5年生存率仅为20%[24]。本研究中转移型患者生存率在3、5、10年内的分别只有28.57%(8/28)、24.14%(7/29)和20.69%(6/29),5年生存率较文献报告的稍高,但是无统计学意义。
不足之处,本文纳入病例数较少,有些数据比较来自其他文献的报道,但是本文作为一项平均超过10年的长期随访结果,对于OS患者远期预后分析有一定的临床意义。
综上所述,笔者认为在OS患者中,转移和死亡的发生主要集中在初诊的3年内。无论是转移型患者还是非转移型的患者中,通过新辅助化疗联合手术治疗可以提高的生存率。影响OS转移及发展的机制非常复杂,课题组前期的研究已经发现KISS-1/GPR54基因系统等在OS的转移和预后中起了重要作用[3-4],因此笔者将在此分子机制方面进一步探索,寻找改善OS患者预后的新靶点、新方法。
参考文献
[1] Weber K L.Whats new in musculoskeletal oncology[J].J Bone Joint Surg Am,2005,87(6):1400-1410.
[2] ODay K,Gorlick R.Novel therapeutic agents for osteosarcoma[J].Expert Rev Anticancer Ther,2009,9(4):511-523.
[3]Wang F S,Chen H,Wu Z Y,et al.KISS1 expression in osteosarcoma:high in chinese clinical cases, but lower in cell lines[J].Asian Pac J Cancer Prev,2011,12(12):3229-3234.
[4]陈辉,吴朝阳,林建华,等.G蛋白偶联受体 54 基因在骨肉瘤中的表达及其临床意义[J].中国肿瘤生物治疗杂志,2012(19):289-293.
[5] Goguet-Surmenian E,Richard-Fiardo P,Guillemot E,et al.CXCR7-mediated progression of osteosarcoma in the lungs[J].Br J Cancer,2013,109(6):1579-1585.
[6] Mirabello L,Troisi R J,Savage S A.Osteosarcoma incidence and survival rates from 1973 to 2004:Data from the surveillance,epidemiology,and end results program[J].Cancer,2009,115(7):1531-1543.
[7] Gorlick R,Khanna C.Osteosarcoma[J].J Bone Miner Res,2010,25(4):683-691.
[8] Arora R S,Kontopantelis E,Alston R D,et al.Relationship between height at diagnosis and bone tumours in young people:a meta-analysis[J].Cancer Causes Control,2011,22(5):681-688.
[9] Kim J,Mori T,Chen S L,et al.Chemokine receptor CXCR4 expression in patients with melanoma and colorectal cancer liver metastases and the association with disease outcome[J].Ann Surg,2006,244(1):113-120.
[10] Yang S C,Wu C H,Tu Y K,et al.Exposure to 2,3,7,8-tetrachlorodibenzo-p-dioxin increases the activation of aryl hydrocarbon receptor and is associated with the aggressiveness of osteosarcoma MG-63 osteoblast-like cells[J].Oncol Lett,2018,16(3):3849-3857.
[11] Davis A M,Bell R S,Goodwin P J.Prognostic factors in osteosarcoma: a critical review[J].J Clin Oncol,1994,12(2):423-431.
[12] Ferrari S,Bertoni F,Mercuri M,et al.Predictive factors of disease-free survival for non-metastatic osteosarcoma of the extremity: an analysis of 300 patients treated at the Rizzoli Institute[J].Ann Oncol,2001,12(8):1145-1150.
[13] Bielack S S,Kempf-Bielack B,Delling G,et al.Prognostic factors in high-grade osteosarcoma of the extremities or trunk: an analysis of 1,702 patients treated on neoadjuvant cooperative osteosarcoma study group protocols[J].J Clin Oncol,2002,20(3):776-790.
[14] Bacci G,Longhi A,Ferrari S,et al.Prognostic significance of serum lactate dehydrogenase in osteosarcoma of the extremity:experience at Rizzoli on 1421 patients treated over the last 30 years[J].Tumori,2004,90(5):478-484.
[15] Bacci G,Longhi A,Versari M,et al.Prognostic factors for osteosarcoma of the extremity treated with neoadjuvant chemotherapy:15-year experience in 789 patients treated at a single institution[J].Cancer,2006,106(5):1154-1161.
[16] Whelan J S,Jinks R C,McTiernan A,et al.Survival from high-grade localised extremity osteosarcoma:combined results and prognostic factors from three European Osteosarcoma Intergroup randomised controlled trials[J].Ann Oncol,2012,23(6):1607-1616.
[17] Ogura K,Fujiwara T,Yasunaga H,et al.Development and external validation of nomograms predicting distant metastases and overall survival after neoadjuvant chemotherapy and surgery for patients with nonmetastatic osteosarcoma:A multi-institutional study[J].Cancer,2015,121(21):3844-3852.
[18] Bertrand T E,Cruz A,Binitie O,et al.Do surgical margins affect local recurrence and survival in extremity,nonmetastatic,high-grade osteosarcoma?[J].Clin Orthop Relat Res,2016,474(3):677-683.
[19] Lee R J,Arshi A,Schwartz H C,et al.Characteristics and prognostic factors of osteosarcoma of the jaws:a retrospective cohort study[J].JAMA Otolaryngol Head Neck Surg,2015,141(5):470-477.
[20] Goguet-Surmenian E,Richard-Fiardo P,Guillemot E,et al.CXCR7-mediated progression of osteosarcoma in the lungs[J].Br J Cancer,2013,109(6):1579-1585.
[21] Ferrari S,Serra M.An update on chemotherapy for osteosarcoma[J].Expert Opin Pharmacother,2015,16(18):2727-2736.
[22] Bacci G,Balladelli A,Palmerini E,et al.Neoadjuvant chemotherapy for osteosarcoma of the extremities in preadolescent patients: the Rizzoli Institute experience[J].J Pediatr Hematol Oncol,2008,30(12):908-912.
[23] Bacci G,Ferrari S,Lari S,et al.Osteosarcoma of the limb.Amputation or limb salvage in patients treated by neoadjuvant chemotherapy[J].J Bone Joint Surg Br,2002,84(1):88-92.
[24] Mialou V,Philip T,Kalifa C,et al.Metastatic osteosarcoma at diagnosis: prognostic factors and long-term outcome-the French pediatric experience[J].Cancer,2005,104(5):1100-1109.
(收稿日期:2019-03-13) (本文編辑:何玉勤)

