系统性轻链型淀粉样变性累及肝脏的临床表现及预后
赵 亮 任贵生 郭锦洲 陈文萃 陈轻获 刘志红 黄湘华
系统性轻链型淀粉样变性(AL淀粉样变性)是临床上最常见的一种系统性淀粉样变性,是由于异常增殖的单克隆浆细胞产生的免疫球蛋白轻链或轻链片段聚合形成具有β片层状结构的不可溶性纤维丝,沉积于细胞外,导致的组织结构破坏和器官功能障碍,其常见的受累器官包括肾脏、心脏、肝脏和外周神经等[1]。尸检研究发现,多达70%的AL淀粉样变性患者存在肝脏受累[2]。然而,由于多数患者缺乏典型的症状和体征,仅20%~30%患者可观察到肝脏受累的临床表现,容易误诊、漏诊而贻误治疗[3-4]。 肝脏AL淀粉样变性患者预后不佳,中位生存期仅为8.5~9.0个月,5年生存率13.0~16.9%,10年生存率1.0%~6.6%[5-6]。目前,国内关于肝脏AL淀粉样变性研究的文献少,多数为小样本研究或个案报道,且缺乏关于预后影响因素的研究。因此,本研究回顾性分析81例肝脏AL淀粉样变性患者的临床特点和预后情况,探讨影响预后的相关因素。
对象和方法
研究对象回顾性分析2004年6月至2018年5月在东部战区总医院国家肾脏疾病临床医学研究中心确诊的81例肝脏AL淀粉样变性患者的临床资料、治疗和预后情况。所有患者均经活检诊断,至少包括以下活检部位之一:肾脏、皮肤脂肪、直肠黏膜、骨髓和肝脏。AL淀粉样变性的诊断标准:刚果红染色阳性,偏振光显微镜下呈苹果绿双折光,免疫荧光检出单克隆κ或λ轻链;排除继发性、局灶性、遗传性淀粉样变性。诊断肝脏AL淀粉样变性需满足以下条件之一:(1)肝活检证实的肝脏AL淀粉样变性;(2)其他部位活检证实AL淀粉样变性,同时:无心力衰竭时肝脏上下径>15 cm或血清碱性磷酸酶≥1.5倍正常参考范围上限[7]。
观察指标收集患者年龄、性别、血压、临床症状、活检部位、受累器官,确诊时的血清碱性磷酸酶、总胆红素、γ谷氨酰转肽酶、丙氨酸氨基转移酶、门冬氨酸氨基转移酶、肌酐、尿酸、白蛋白、血白细胞、血红蛋白、血小板、免疫固定电泳、单特异游离轻链、N端前脑钠肽、肌钙蛋白T、24h尿蛋白定量、肝脏右肋下最大斜径、心脏室间隔厚度、左室射血分数、骨髓浆细胞比例等指标。
相关定义心脏、肾脏等其他器官受累的定义参考国际标准[8]。肝脏缓解定义:血清碱性磷酸酶下降50%以上或者肝脏上下径减小至少2 cm。治疗后血液学和其他器官缓解的评估参考2012年修订的国际标准[9]。血生化采用瑞利7810型号生化分析仪器,使用比色法进行碱性磷酸酶检测,参考范围为50~172 U/L。
生存时间的计算起点为确诊为肝脏AL淀粉样变性的时间,终点事件定义为患者死亡。总体生存期定义为从确诊到死亡的时间,随访结束时仍然存活的患者以最近一次的临床随访时间作为删失时间。随访截止时间为2018年8月。
统计学方法采用《SPSS 18.0》统计学软件和《GraphPad Prism5》作图软件。正态分布的计量资料采用均数±标准差描述,非正态分布的计量资料采用中位数(四分位间距)描述,分类变量以绝对数(率)表示。利用Kaplan-Meier法计算患者的生存时间,组间对比采用Log-rank检验,采用单因素COX回归模型计算各个因素的风险比值(HR),选择单因素分析中P<0.1的变量纳入多因素COX回归模型分析。所有检验均为双侧检验,P<0.05为差异有统计学意义。
结 果
临床特征81例患者中位年龄55(47~63)岁,男女比例2.9∶ 1。初诊时最常见的临床表现是水肿(72例,88.9%);55例(67.9%)有消化系统症状(39例纳差、24例腹胀、11例腹泻、8例恶心、呕吐);47例(58.0%)有体重下降,平均体重下降7.2 kg;46例(56.8%)有乏力;11例(13.6%)有充血性心力衰竭;40例(49.4%)有肝脏肿大,肝脏右肋下最大斜径的中位值为138(122~161) mm;11例(13.6%)有脾脏肿大,脾门厚度的中位值为31(29.5~36) mm;46例(56.8%)有腹水。27例(33.3%)有低血压。
所有患者均经活检诊断(39例行肾活检,39例均为阳性;55例行皮肤脂肪活检,49例阳性;35例行直肠黏膜活检,32例阳性;37例行骨髓活检,13例阳性;2例行肝活检,2例均为阳性),有4例(4.9%)患者合并多发性骨髓瘤。在活检组织中,65例检出λ单克隆轻链,16例检出κ单克隆轻链。血液学指标方面,血清受累轻链和非受累轻链差值(difference between involved and uninvolved free light chains,dFLC)的中位值为95.7(35.1~140.2)mg/L,58例(71.6%)κ /λ比值异常。61例进行了血免疫固定电泳检查,34例为阴性,26例检出单克隆条带,其中,8例λ型IgG、11例λ型IgA、2例κ型IgG、4例游离λ轻链、1例游离κ轻链,另外,还有1例检出κ型IgG和λ型IgA双克隆条带。62例(76.5%)患者合并心脏受累,按照Mayo2012分期标准:Ⅰ期13例,Ⅱ期22例,Ⅲ期20例,Ⅳ期8例。患者诊断时的器官受累情况及主要检查结果见表1。

表1 81例肝脏系统性轻链型淀粉样变性患者基线临床资料
ECOG-评分:体力状况平分
治疗效果有51例患者接受了大剂量马法兰联合自体造血干细胞移植(high dose melphalan and autologous stem cell transplantation,HDM/ASCT)或化疗,14例接受 HDM/ASCT,18例接受以硼替佐米为基础的化疗方案,其余19例接受其他化疗方案(包括马法兰、沙利度胺为基础的化疗方案)。34例患者可进行疗效评估:19例(55.9%)取得血液学缓解,其中14例(41.2%)取得完全缓解,中位缓解时间1个月,4例(11.8%)取得非常好的部分缓解,中位缓解时间1个月,1例(2.9%)患者取得部分缓解,缓解时间为1个月。接受HDM/ASCT治疗的14例患者中,有13例(92.9%)取得血液学缓解,其中9例(64.3%)取得完全缓解。34例患者中15例(44.1%)取得肾脏缓解,中位缓解时间7个月,12例(35.3%)取得肝脏缓解,中位缓解时间7.5个月;34例患者中,26例存在心脏受累,治疗后10例(38.5%)取得心脏缓解。患者治疗情况详见图1。

图1 患者治疗情况表
预后及危险因素分析患者中位随访时间为8(2~14.5)个月,64例患者在随访期间死亡,13例死亡原因可寻,其中8例死于多器官功能衰竭、2例死于肝功能衰竭、2例死于心源性休克、1例死于呼吸心跳骤停;余51例经电话随访获得死亡结局,具体死因不明确。K-M曲线估计中位生存期为9(2~16)个月,1年、3年、5年生存率分别为31.0%,17.8%和10.7%(图2A)。取得血液学缓解患者的1年和5年生存率分别为61.8%和42.3%,未取得血液学缓解患者的死亡风险是血液学缓解患者的6.6倍,其中位生存期分别为8个月和55个月(P<0.001)(图2C)。K-M曲线显示总胆红素≥34.2 μmol/L组较总胆红素<34.2 μmol/L组预后差(P=0.013)(图2B),N端前脑钠肽≥1 800 pg/ml组较N端前脑钠肽<1 800 pg/ml组预后差(P=0.001 7)(图2D)。COX回归模型中碱性磷酸酶、总胆红素、血小板计数截取值参考文献报道[5]、肌钙蛋白T、N端前脑钠肽和dFLC的截断值选择参考Mayo 2004[10]和Mayo 2012[11]分期标准,其他指标采用中位值作为截断值。主要指标的COX回归分析结果见表2。经过单因素回归分析筛选年龄≥55岁、总胆红素≥34.2 μmol/L、碱性磷酸酶≥500 U/L、N端前脑钠肽≥1 800 pg/ml、肌钙蛋白T≥0.035 ng/ml和低血压等6个指标纳入多因素回归。多因素分析表明基线N端前脑钠肽≥1 800 pg/ml是预后独立危险因素。
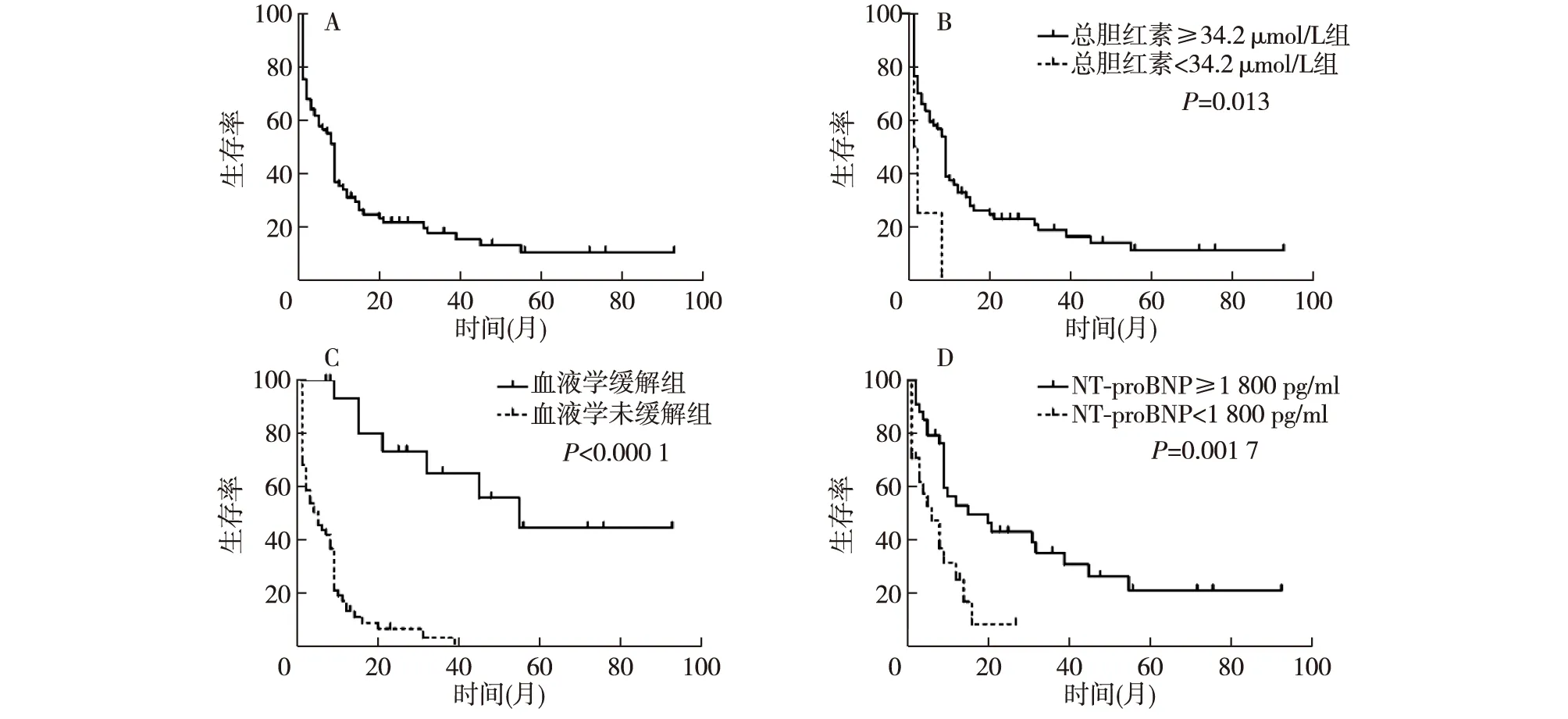
图2 肝脏淀粉样变性患者生存预后曲线

表2 患者预后危险因素分析
dFLC:血清受累轻链和非受累轻链差值;低血压:收缩压<90 mmHg和或舒张压<60 mmHg;*截取值参考Mayo 2004分期标准;#:截取值参考Mayo 2012分期标准
讨 论
肝脏是AL淀粉样变性的常见受累器官,国外文献报道20%~30%患者临床合并肝脏受累[2-3],本中心曾报道231例AL淀粉样变性,所有患者中位存活时间为33个月,31例(12.6%)有肝脏受累,可能因为本中心为肾脏病中心,肝脏受累比例低于国外文献报道[12]。关于肝脏AL淀粉样变性的研究较少,国外最大的一项研究共纳入98例患者[5],但该研究未评估HDM/ASCT和以硼替佐米为基础的化疗等新型治疗方案对预后的影响,以及N端前脑钠肽、肌钙蛋白T和血游离轻链等新的生物标志物与预后的关系。本研究共纳入81例患者,总结了这类患者的主要临床表现,分析了基线临床资料,包括一些新型生物标志物与预后的关系,并且评估了新型治疗方案对预后的影响,是目前所知国内针对肝脏AL淀粉样变性最大样本的研究。
肝脏AL淀粉样变性的临床表现多样,国外报道的主要临床表现为体重减轻(平均下降10.4 kg)、乏力、腹部疼痛、水肿、厌食等[5,13],黄疸罕见,但预后极差[14-16]。由于本中心多数患者因肾病综合征就诊,所以本组患者更多表现为水肿。体重下降也是本组患者的主要临床表现,可能由于低蛋白血症和水钠潴留等原因的影响,本组患者体重下降的绝对值低于国外文献报道。消化系统症状、乏力、心力衰竭等临床表现的发生率与国外文献报道相当。肝脏肿大也是常见临床表现,有研究报道81%的患者会出现肝脏肿大,但也有研究认为肝脏肿大的比例低于该水平[3,17],通过影像学检查,本研究发现40例(49.4%)患者有肝脏肿大,此外有11例(13.6%)患者合并脾脏肿大。
确诊肝脏AL淀粉样变性的金标准是肝穿刺活检,病理可见淀粉样物质沉积于肝脏汇管区及肝窦,压迫并导致正常肝组织萎缩及梗阻性黄疸[18]。肝穿刺有出血风险,其发生率文献报道不一,多数研究报道约为4%[5-6],出血原因尚不清楚,凝血时间延长并不能作为其预测指标。虽然大多数研究表明肝穿刺的安全性较高,但目前国内外肝脏AL淀粉样变性的诊断多采用临床标准[7],因此,本研究所纳入的大多数患者均采用了临床标准进行诊断。
本研究共51例患者接受治疗,由于部分患者在治疗开始的3个月内死亡,最终有34例患者可进行疗效评估,19例(55.9%)取得血液学缓解,血液学缓解率最高的治疗方案是HDM/ASCT,14例接受HDM/ASCT治疗的患者中,有13例(92.9%)取得血液学缓解,9例(64.3%)取得完全缓解。在一项对69例接受HDM/ASCT治疗的肝脏AL淀粉样变性患者的研究中[19],58例(84%)在1年内取得血液学缓解,31例(53%)取得完全缓解。本研究的血液学缓解率高于上述研究,可能与部分患者在接受HDM/ASCT治疗前还接受了硼替佐米化疗有关。本研究还发现,未取得血液学缓解患者的死亡风险是血液学缓解患者的6.6倍,后者的中位生存期达到55个月,表明无论接受哪种治疗方案,取得血液学缓解的患者将长期获益。
国外文献报道肝脏AL淀粉样变性患者的中位生存期为8.5~9.0个月[5-6]。本研究患者的中位生存期为9.0个月,与国外报道一致。有研究表明高胆红素血症和黄疸提示预后极差[14,20]。总胆红素>1.5 mg/dl的患者,中位生存期仅1.8个月[6]。Park等[5]报道总胆红素>34.2 μmol/L、血小板计数>500×109/L和充血性心力衰竭是预后独立危险因素,虽然该研究是目前国外的最大样本研究,但该研究未纳入心肌标志物和血游离轻链。本研究中,仅5例患者基线血小板计数>500×109/L,单因素分析显示其与预后不相关。仅4例患者总胆红素高于34.2 μmol/L,虽然单因素分析和KM曲线均显示基线总胆红素≥34.2 μmol/L与预后相关,但是在多因素分析中,总胆红素≥34.2 μmol/L不再是预后独立危险因素,而NT-ProBNP≥1 800 pg/ml成为预后独立危险因素。N端前脑钠肽是反映心力衰竭严重程度的客观指标,并被用于建立AL淀粉样变性的危险分层系统和判断治疗后的心脏反应[9,11,21]。与Park等[5]研究提示充血性心力衰竭是预后独立危险因素的结果一致,本研究表明心功能显著下降是影响患者预后的重要因素。
本研究为单中心回顾性研究,样本量较小,研究结果可能存在偏倚;由于部分患者生存期极短,使得适用于疗效评估的病例较少。因此,本研究结果仍有待于大样本多中心前瞻性研究进一步验证。
小结:肝脏AL淀粉样变性临床表现多样且不典型,容易被忽视。临床上应重视患者的胃肠道症状和腹部体格检查,及早发现可疑患者并行活检、碱性磷酸酶和影像学检查确诊。该病预后差,早期诊断并及时选择合适的化疗方案或HDM/ASCT治疗能够改善患者预后,治疗目标是获得血液学缓解及随后的器官缓解。

