慢性肾脏病合并社区获得性肺炎的特征和危险因素
陈 亮 韩秀迪 李艳丽 张春晓 邢西迁
社区获得性肺炎(CAP)是一种常见的感染性疾病,据估计,美国年发病率约为15~18/1 000,欧洲1.6~9/1 000[1-3]。尽管随着医疗技术的进步和经济的发展,CAP仍保持很高的病死率。WHO报道,世界范围内,CAP是导致死亡的第四位原因,是感性疾病导致死亡的首位原因[4]。慢性肾脏病(CKD)指经肾活检或检测肾损伤标志物证实的肾脏损伤或肾小球滤过率(GFR)持续<60 ml/(min·1.73m2)≥3个月。肾损伤的指标阳性包括血、尿成分异常或影像学检查异常[5]。据估计,CKD全球发病率约为8%~16%;我国约为10%[5-7]。研究显示,CKD患者发生肺炎的风险增高,因此CKD是CAP患者常见的伴随基础疾病,发生率约为3%~8%[8]。既往的研究多局限于透析相关肺炎(HDAP)[9-10],而缺乏描述整体CKD患者发生CAP(CKD-CAP)后临床特征和结局的资料。本研究旨在全面了解CKD-CAP住院患者的临床特征,以及CKD对CAP临床结局的影响;并探讨影响CKD-CAP患者30d病死率的危险因素。
对象与方法
研究对象本研究为多中心、回顾性研究。研究单位包括北京积水潭医院、北京朝阳医院、北京回民医院、青岛市立医院和昆明延安医院。检索上述五家医院2013-01-01~2015-12-31出院诊断包含“肺炎”或“肺部感染”的病例,按照《中国成人社区获得性肺炎诊断和治疗指南(2016年版)》[11]CAP入选标准和排除标准筛选出影像学确诊的、14周岁以上CAP病例。收集患者年龄、性别、基础疾病、肺炎严重性指数(pneumonia illness index,PSI)/CURB-65评分(意识障碍、血尿素氮>7.14 mmol/L、呼吸频率≥30次/min、收缩压<90 mmHg和年龄≥65岁)[11]、入院当天的血常规、生化检查和影像学资料(若有多次检查,取最异常值)、以及病原学诊断和临床结局。CKD患者收集病历记录发病前6个月内估算的肾小球滤过(eGFR);若无eGFR记录,则收集发病前基线血肌酐值,根据慢性肾脏病流行病学合作研究公式(CKD-EPI)换算[12]。
相关定义CKD分期标准参照KDIGO指南标准[13]。心血管病包括冠心病、慢性心功能不全、心肌病。脑血管病包括短暂性脑缺血发作、脑梗塞、脑出血、蛛网膜下腔出血。糖尿病包括1型糖尿病、2型糖尿病、妊娠期糖尿病和特殊类型糖尿病。但不包括糖耐量异常和空腹血糖受损这两类糖尿病前期状态。慢性阻塞性肺病定义为持续的呼吸症状(如咳嗽咳痰或伴喘息)和气流受限,使用支气管扩张剂后FEV1/FVC<70%。
统计学方法使用《SPSS 19.0》软件进行统计分析。计量数据先进性正态性检验(Kolmogorov-Smirnov检验),呈正态分布的计量资料以均数±标准差表示;差异比较采用t检验。非正态分布的计量资料以中位数表示,应用 Mann-Whitney 检验。计数资料以例数表示,组间进行χ2检验或Fisher确切检验法。经过年龄、性别、基础病、PSI分级和CURB-65评分矫正的Logistic回归模型,探讨CKD对CAP患者30d病死率和ICU住院率的影响。根据住院30d是否死亡,把CKD-CAP患者分为生存组和死亡组。单因素回归分析法比较两组差异,P<0.05的变量引入Logistic回归方程,探讨与CKD-CAP患者30d死亡相关的独立危险因素。双侧P<0.05为差异有统计学意义。
结 果
筛选流程和入组患者一般情况
对8 799例患者进行筛选,共有3 561例合格的CAP患者纳入最后分析(图1)。男性占59.9%(2 132/3 561),中位年龄64.0岁(四分位距62.0~77.0岁)。CKD-CAP患者占4.8%(170/3 561)。CKD 1期的占5.3%(9/170),2期占8.2%(14/170),3期占19.4%(33/170),4期占30.6%(52/170),5期占36.5%(62/170),其中48例为维持性透析治疗患者。
人口学特征和病情比较与非CKD-CAP患者相比,CKD-CAP患者年龄较大,常合并心血管病、脑血管病和糖尿病;近30d内接受静脉抗生素和近1年内有CAP病史者比例高;CURB-65评分≥2分和PSI分级≥Ⅲ级者比例也更高(P>0.05)(表1)。
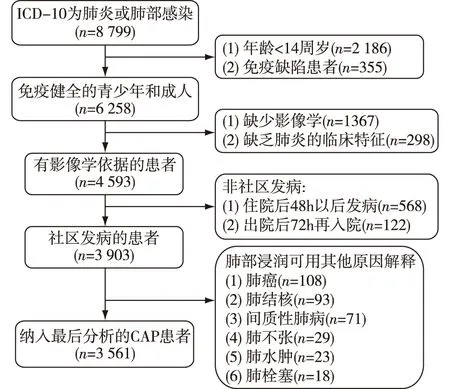
图1 CAP住院患者筛选流程
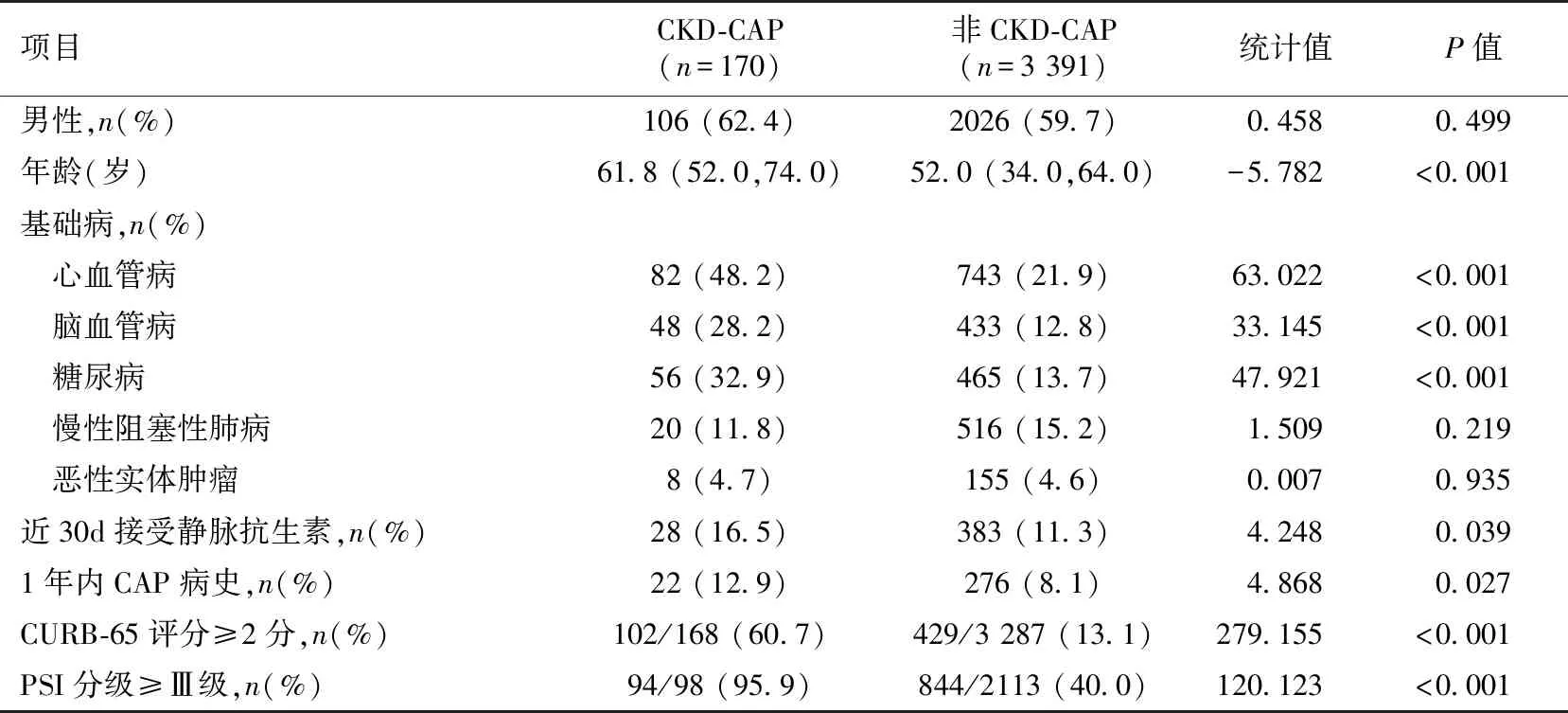
表1 两组患者人口学特征和病情严重性比较
PSI:肺炎严重性指数;CKD:慢性肾脏病;CAP:社区获得性肺炎;CURB-65:意识障碍、血尿素氮>7.14 mmol/L、呼吸频率≥30次/min、收缩压<90 mmHg和年龄≥65岁
临床和影像学特征与非CKD-CAP患者相比,CKD-CAP患者出现呼吸频率≥30次/min、意识改变、影像学多肺叶浸润和胸水的比例高;外周血白细胞、血尿素氮、血清肌酐、血糖和血降钙素原水平更高;而血红蛋白和白蛋白和eGFR水平低(P<0.05)(表2)。
病原学各有21.2%(36/170)的CKD-CAP患者和10.8%(365/3391)的非CKD-CAP患者获得病原学诊断。肺炎克雷伯杆菌36.1%(13/36)、金葡菌19.4%(7/36)、肺炎链球菌13.9%(5/36)和铜绿假单胞菌13.9%(5/36)是CKD-CAP患者分离率最高的前三位致病菌。肺炎链球菌20.8%(76/365)、甲型流感病毒14.5%(53/365)和肺炎克雷伯菌14.0%(51/365)是非CKD-CAP患者分离率最高的前三位致病菌。与非CKD-CAP患者相比,金葡菌(19.4%vs7.1%,P=0.025)和肺炎克雷伯菌(36.1%vs14.0%,P=0.001)在CKD-CAP患者检出率更高,差异有统计学意义;其他病原体两组分布差异无统计学意义。
支持治疗和临床结局与非CKD-CAP患者相比,CKD-CAP患者 使用无创机械通气、有创机械通气、需要使用血管活性药物、并发呼吸衰竭、心力衰竭、脓毒休克的比例高;ICU住院率和30d病死率更高;住院时间也更长(P<0.05)。差异有统计学意义。

表2 两组患者临床和影像学特征
PCT:降钙素原;eGFR:估算的肾小球滤过率;CKD:慢性肾脏病;CAP:社区获得性肺炎

表3 两组患者临床结局的比较
ICU:重症监护病房;CKD:慢性肾脏病;CAP:社区获得性肺炎
CKD对CAP住院患者ICU住院率和30d病死率的影响经过性别、年龄、基础病、CURB-65评分和PSI分级矫正,Logistic多因素回归分析显示,合并CKD可增加CAP住院患者入住ICU和30d死亡的风险(表4)。
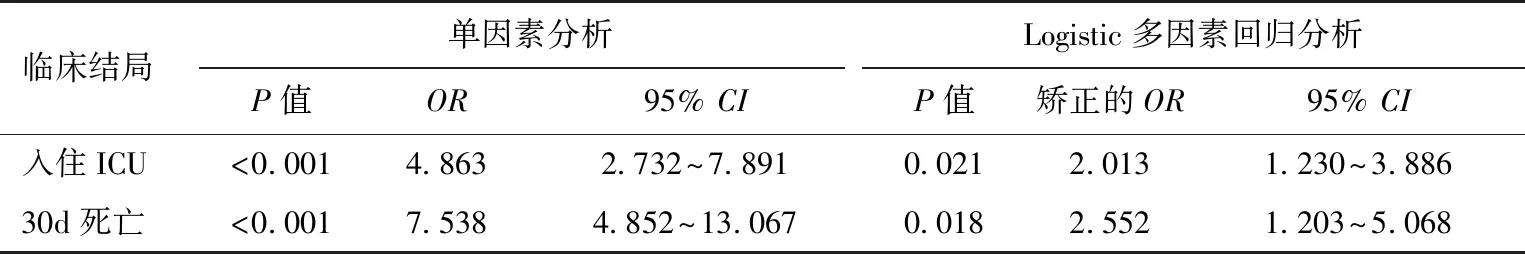
表4 CKD对CAP住院患者ICU住院率和30d病死率的影响
OR:比值比;CI:可信区间;ICU:重症监护病房;CKD:慢性肾脏病;CAP:社区获得性肺炎
影响CKD-CAP住院患者30d病死率危险因素Logistic多因素回归分析证实:PSI分级(OR 5.361,95%CI 1.641~12.036,P=0.036)、血降钙素原≥2 ng/ml(OR 5.102,95%CI 1.324~9.217,P=0.042)和肾小球滤过率≤30 ml/(min·1.73m2)(OR 4.183,95%CI 1.442~6.201,P=0.018)是CKD-CAP患者30天死亡的独立危险因素(表5和图2)。
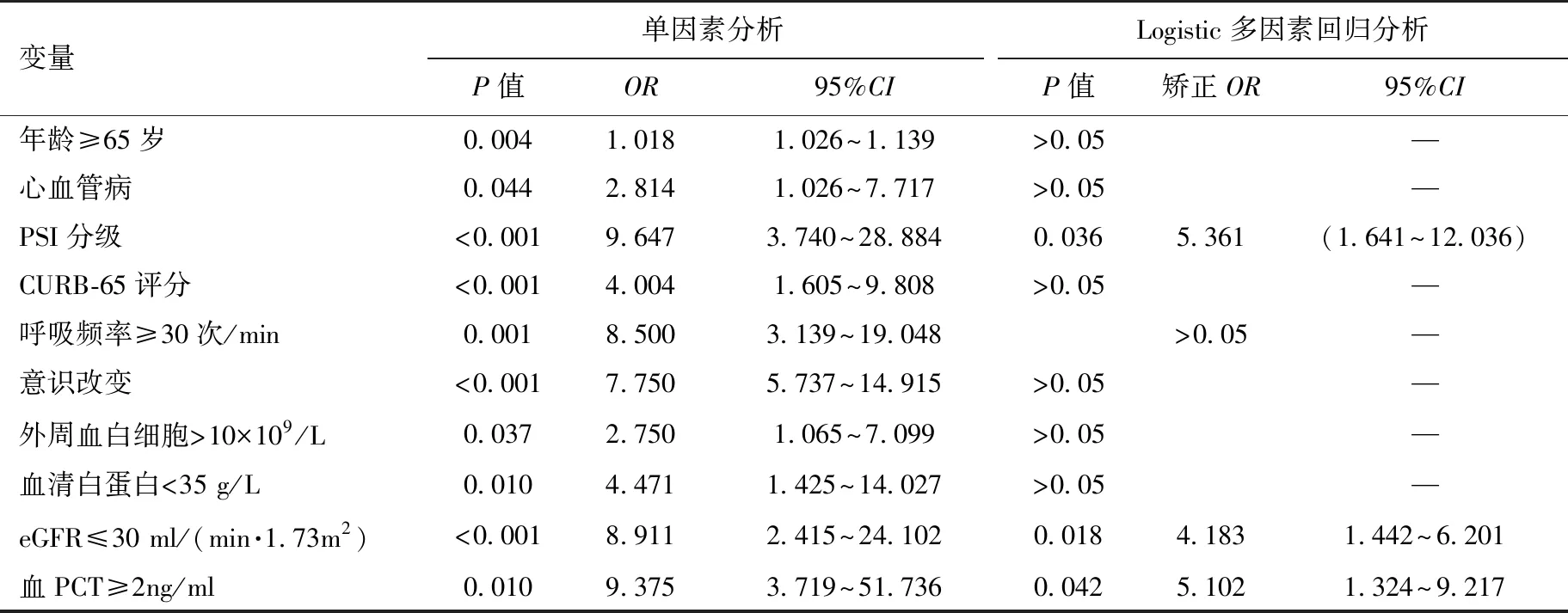
表5 影响CKD-CAP住院患者30d病死率危险因素的单因素和Logistic多因素回归分析
OR:比值比;CI:可信区间;PSI:肺炎严重性指数;CURB-65:意识障碍、血尿素氮>7.14 mmol/L、呼吸频率≥30次/min、收缩压<90mmHg和年龄≥65岁;eGFR:估算的肾小球滤过率;PCT:降钙素原

图2 CKD-CAP住院患者30d病死率相关独立危险因素的森林图
讨 论
本研究中CKD-CAP占4.8%,与既往报道一致[14-16]。James等[14]基于社区的大样本回顾性调查表明,eGFR越低,CKD患者因为肺炎住院的风险越大,这种相关性在各个年龄组都存在。研究表明,CKD患者存在固有免疫和适应性免疫功低下,并且随着肾功能降低,免疫低下的程度也越严重[17-18]。因此,包括肺炎在内的各种感染相关并发症发生的风险大大提高。这可以部分解释,除了高龄和基础病的影响之外,为什么在本研究里,合并CKD的患者一年内常有多次CAP的病史,以及属于CKD 4期和5期的比例更高。
我们发现CKD-CAP患者年龄较大,多合并心脑血管病和糖尿病。这是因为,在我国高血压和糖尿病是导致CKD常见的病因[19-20],除肾脏外,心、脑血管也是高血压和糖尿病最常受累的靶器官。CKD患者,由于大量的尿蛋白丢失、进食和胃肠道吸收障碍,营养状况差,多出现贫血和低蛋白血症。同时,由于免疫力低下,发生肺炎后感染不易局限,炎症反应的程度更剧烈、范围更广,表现为外周血白细胞和PCT水平更高,影像学多肺叶浸润和胸水也更常见。与此相匹配,反映肺炎病情严重性的CURB-65评分和PSI分级也更高。
虽然仅有21.2%的CKD-CAP患者和10.8%的非CKD-CAP患者获得病原学诊断,但我们发现两组的病原学分布并不一样。金葡菌和肺炎克雷伯杆菌在CKD-CAP患者的检出率明显高于非CKD-CAP患者。Su等[21]在广东地区开展的多中心观察性研究表明,CKD的患者易发生多重耐药菌感染,其中耐甲氧西林的金葡菌(MRSA)是最常见的革兰阳性菌,肺炎克雷伯杆菌是第二位革兰氏阴性菌。还有研究表明,金葡菌和肺炎克雷伯菌是终末期肾病肺炎患者最常见的两种病原体[22-23]。金葡菌广泛定植于人体皮肤、呼吸道以及医疗环境中;肺炎克雷伯菌在东南亚地区CAP的检出率明显高于欧美地区,特别是在老年和有基础病的患者[3,24-25]。除了免疫功能低下,CKD患者因为透析、穿刺等医疗操作,以及频繁的与医疗场所接触和抗感染药物的暴露,均增加了金葡菌和肺炎克雷伯菌等革兰氏阴性菌感染的几率。我们的研究结果提示,在治疗CKD-CAP患者时,经验性抗感染方案应当充分覆盖上述两类细菌。
本研究中CKD-CAP患者30d病死率高达11.8%,显著高于非CKD-CAP患者。由于免疫功能损伤、营养状况和机体稳态调节能力的降低、多重耐药菌和高毒力病原体感染的风险增高等一系列综合因素的作用,CKD成为增加 CAP患者30d病死率的危险因素,这种相关性不依赖性别、年龄、伴随的基础病和肺炎病情评分。
本研究证实,除了PSI分级,血PCT≥2 ng/ml和eGFR≤30 ml/(min·1.73m2)也是影响CKD-CAP患者30d病死率的独立危险因素。PCT是降钙素的前体蛋白,生理条件下甲状腺C细胞和肺的神经内分泌细胞可分泌微量的PCT,但在炎症时多种组织细胞均可释放PCT。血浆PCT水平与细菌负荷和感染严重程度呈正相关[26]。Siljan等[27]的前瞻性研究纳入267例CAP患者,分析发现血PCT独立于CURB-65评分,与CAP患者30d病死率相关。一项包含21个研究的Meta分析表明,血PCT增高是CAP和呼吸机相关肺炎(VAP)患者病死率增高的独立危险因素(RR 4.18,95%CI 3.19~5.48)[28]。发生肺炎前的肾功能状况也是影响CAP预后的重要因素。eGFR≤30 ml/(min·1.73m2)是CKD的严重阶段,这个时期的患者不仅营养状况和免疫功能极差,还常常伴有水电解质和血流动力学紊乱;虽然感染多重耐药菌和高毒力病原体的风险大大增加,但是因为肾功能严重降低,抗感染药物使用受限,最终导致病死率急剧升高。血浆PCT和eGFR是CAP患者就诊时非常容易取得的两个指标,既是对PSI评分系统的补充,也有利于临床医师早期识别那些高死亡风险的CKD-CAP患者,因此临床价值很高。
本研究存在一些缺陷:(1)虽然样本量较大,但依然具有回顾性研究的天然缺陷;(2)研究对象全部为住院患者,所得结论不能直接推广到门急诊人群;(3)由于现实世界里,中国临床实践中病原学诊断技术手段有限,病原学诊断率不高[9],因此本研究所得病原学不能代表真实的CAP病原学分布;(4)由于是回顾性研究,不排除有少部分合并急性肾损伤的CKD患者,因此可能会对结论产生影响。
总之,本研究发现,合并CKD的CAP患者临床症状加重,临床结局恶化;独立于性别、年龄、基础病和肺炎病情评分,CKD增加CAP患者30d死亡的风险。PSI分级、血PCT升高和eGFR较低是与CKD-CAP患者30d病死率相关的独立危险因素,有助于临床医师早期识别高死亡风险的患者。

