钙神经蛋白抑制剂致移植后糖尿病的分子机制
童 玲 综述 余爱荣 审校
移植后糖尿病(PTDM)是器官移植后常见的严重并发症之一,可使移植物功能减退甚至丧失,增加术后感染及排斥反应的风险,还可引发移植术后心血管相关并发症,不仅增加治疗成本,还严重影响患者的生活质量和长期生存率[1]。《中国移植后糖尿病诊疗技术规范(2019版)》中指出PTDM的发病机制主要为β细胞功能衰竭和胰岛素敏感度降低,而免疫抑制剂是导致PTDM发病的重要因素,尤其是钙神经蛋白抑制剂(CNIs)、糖皮质激素等。目前认为CNIs主要从以下几个方面导致PTDM:直接的胰岛β细胞毒性;减少葡萄糖的利用;抑制胰岛素分泌;增加胰岛素抵抗[2]。但具体机制尚未得到明确的阐述。近年来,越来越多的学者对CNIs致PTDM的药物基因组学进行了研究,同时探讨了CNIs在导致糖尿病的各靶器官中可能的作用。本文将从上述两方面进行总结、分析,深入了解CNIs致PTDM可能的机制,以期为预防和治疗PTDM提供更多的思路与策略。
CNIs主要包括如环孢素A和他克莫司,它们分别与亲环蛋白A和FKBP12.6形成复合物,并抑制钙调神经磷酸酶(CaN)的活性。CaN是一种双亚基结构,经钙离子调节可发挥去磷酸化的作用,同时对T细胞活化具有重要的作用。CNIs主要通过抑制T细胞和其他免疫细胞中活化T细胞核因子(NFAT)转录因子的去磷酸化,进而阻止去磷酸化NFAT易位到细胞核中同时抑制导致T细胞活化的细胞因子基因表达的启动,从而发挥免疫抑制作用。Sharif等[3]进行的一项荟萃分析发现不含CNIs的治疗方案与PTDM的发生减少相关。多数研究报道,与环孢素A相比,他克莫司导致PTDM的发病率更高[4-5]。李智涛等[6]研究认为,他克莫司致PTDM的风险高于环孢素,主要是由于他克莫司对CaN的抑制作用更强以及β细胞中亲免蛋白FKBP12.6的富集性。多数研究结果显示CNIs对葡萄糖代谢的影响呈剂量依赖性[7-8]。
CNIs致PTDM相关的药物基因组学
近十年来,越来越多的研究报道了基因多态性与CNIs致PTDM之间的相关性。钙蛋白酶10(CAPN10)可编码一种表达于胰腺胰岛中的非溶酶体半胱氨酸蛋白酶,在维持葡萄糖稳态的调节中起重要作用。本课题组研究发现该基因SNP-19的1等位基因和SNP-43 GG基因型是PTDM发生的独立危险因素[9]。
电压门控钾通道亚家族Q成员1(KCNQ1)和电压门控钾通道亚家族J成员11(KCNJ11)可影响β细胞对胰岛素的释放,进而导致2型糖尿病的发生。Tavira等[10]研究发现,在使用他克莫司治疗的患者中KCNQ1 rs2237895编码外显子中CC基因型与PTDM的发生风险显著相关(P=0.008)。此外,Tavira等[11]测定了使用他克莫司治疗后出现PTDM的115例移植受者和未出现PTDM的205例移植受者KCNJ11 rs5219的基因型,结果发现携带A等位基因(AA + AG)与他克莫司诱导的PTDM的发生风险显著相关(P=0.004)。
Ling等[12]研究显示,在中国汉族肝移植患者中供者转录因子7类似物2(TCF7L2) rs290487 CC基因型可预测发生PTDM更高的可能性(>40%)。本课题组对398例肾移植受者的TCF7L2 rs290487基因型进行检测,在校正相关危险因素后,结果发现CC基因型携带者发生PTDM的风险是TT基因型携带者的2.3倍,而CC+CT基因型携带者是TT基因型携带者的1.935倍[13]。
Shi等[14]研究发现,在肾移植受者中葡萄糖激酶(GCK) G-30A GG基因型与他克莫司诱导的PTDM显著相关(P<0.05)。GCK G-30A主要通过损害胰岛β细胞的功能从而导致2型糖尿病的发生,而他克莫司可降低胰腺胰岛细胞中GCK的活性,进而抑制葡萄糖诱导的胰岛素释放。
细胞质活化T细胞核因子4(NFATc4)基因表达于胰腺胰岛细胞。NFAT家族转录因子可同时调节免疫活化和胰岛素的产生。而CNIs可靶向激活NFAT。Chen等[15]研究发现NFATc4 rs10141896 T等位基因与PTDM较低的累积发生率相关(P=0.02)。携带NFATc4 T-T-T-T-G单倍型且使用CNIs治疗的受者发生PTDM的风险降低;而携带C-C-C-G-G单倍型的患者发生PTDM的风险增加。
环磷腺苷效应元件结合蛋白(CREB)调节转录共刺激因子2(CRTC2)可调节葡萄糖的代谢。Quteineh等[16]研究发现在使用他克莫司治疗的实体器官移植受者中可观察到CRTC2 rs8450-AA基因型对PTDM的影响(P=0.02)。
CNIs致PTDM相关的基因还包括脂联素(ADIPOQ)、瘦素(LEP)、趋化因子配体2(CCL2)、白细胞介素6(IL-6)、基质金属蛋白酶2(MMP-2)、过氧化物酶体增殖物激活受体α(PPARα)、P450氧化还原酶(POR)、内皮一氧化氮合成酶(eNOS)内含子4和锌转运体8(ZnT-8)等(表1)。
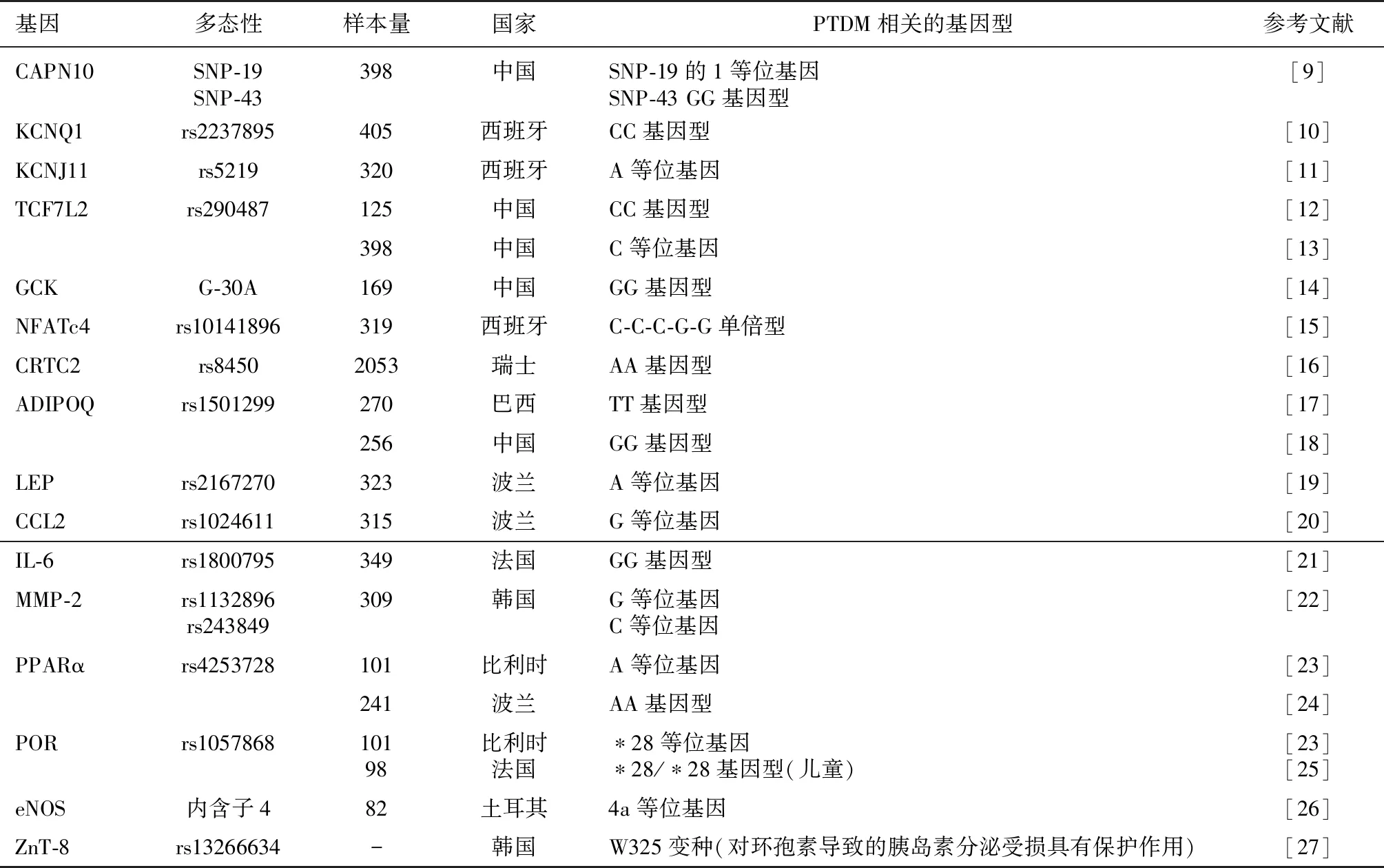
表1 CNIs致PTDM相关的基因
CNIs:钙神经蛋白抑制剂;PTDM:移植后糖尿病;IL-6:白细胞介素6;CAPN10:钙蛋白酶10;KCNQ1:钾通道亚家族Q成员1;KCNJ11:钾通道亚家族丁成员11;GCK:葡萄糖激酶;NFATc4:细胞质活化T细胞核因子4;eNOS:内皮一氧化氮合成酶;ZnT-8:锌转运体8;TCF7L2:转录因子7类似物2;CRTC2:环磷腺苷效应元件结合蛋白调节转录共刺激因子;ADIPQ:脂联素;LEP:瘦素;CCL2:趋化因子配体2;MMP-2:基质金属蛋白酶2;PPARα:过氧化物酶体增殖物激活受体α;POR:P4So氧化还原酶
CNIs导致糖尿病的靶器官效应
维持正常的血糖平衡或稳态依赖于多个不同的组织中一些同时进行的过程,这些组织包括胰腺、肠道、肝脏、骨骼肌、脂肪细胞和大脑。CaN广泛分布于胰腺的胰岛细胞、骨骼肌、心脏、神经元和脂肪细胞等。Chakkera等[28]指出CNIs主要通过两种方式发挥致糖尿病效应:(1)导致β细胞功能障碍,从而抑制胰岛素分泌;(2)在增加骨骼肌和脂肪组织中胰岛素抵抗的同时减少葡萄糖的利用。下面将依次探讨CNIs在各组织中通过影响胰岛素分泌和胰岛素抵抗而导致葡萄糖代谢障碍和糖尿病的药理学机制。
CNIs对胰腺的影响CaN在分泌胰岛素的胰腺β细胞中表达,而在β细胞中存在两个与CaN关系紧密的分子靶标,即NFAT家族转录因子和CREB转录共刺激因子。CaN-NFAT信号通路可调节胰腺β细胞生长和脂肪因子基因转录。CREB介导胰腺中胰高血糖素样肽的增殖和葡萄糖信号通路。胰岛中CREB多肽表达阴性的转基因小鼠可因CREB的直接靶标胰岛素受体底物2(IRS2)的表达减少而出现糖尿病,并伴有胰岛β细胞的凋亡。小鼠中IRS2的破坏表明外周胰岛素信号传导和胰腺β细胞功能均受损。啮齿动物模型证明IRS2是对CaN活化有响应的下游基因,其启动子以CaN敏感的方式与NFAT结合。另外,CNIs可减少小鼠和人胰岛中Akt底物的磷酸化,提示CNIs可通过PI3K/Akt途径调节胰岛β细胞的复制和存活[29]。这些可能是间接效应,因为IRS-2的敲除本身也会由于小鼠β细胞凋亡和功能障碍而产生糖尿病。此外,Speckmann等[30]研究发现神经元PAS结构域蛋白4(Npas4)的过表达可降低他克莫司对胰腺β细胞的毒性作用,提示Npas4可能对他克莫司致PTDM具有改善作用。
CNIs对肠道的影响Li等[31]在动物体内实验研究中发现,他克莫司通过增强钠-葡萄糖共转运体(SGLT1)的活性和表达以诱导胰岛素抵抗并增加肠道葡萄糖的吸收。而SGLT1是葡萄糖从肠腔转运至肠上皮细胞的主要途径。
CNIs对骨骼肌的影响骨骼肌负责大部分胰岛素介导的葡萄糖处置。骨骼肌中Ⅰ型肌纤维具有较高的胰岛素敏感性。胰岛素通过影响葡萄糖转运蛋白4(GLUT4)从内膜向细胞表面的移动或转运来刺激葡萄糖摄取进入脂肪和肌肉组织。多种信号传导通路在影响骨骼肌重塑的基因转录事件调节中起作用,主要包括(1)肌细胞增强因子(MEF2)及与Ⅱ型组蛋白去乙酰化酶偶联以调节骨骼肌发育的碱性螺旋-环-螺旋转录因子家族,其中MEF2的敲除可导致胰岛素敏感的肌纤维缺失;(2)参与Ⅰ型纤维形成的PPARγ共激活因子1(PGC-1)(α和β)通路:在胰岛素抵抗的骨骼肌中可观察到PGC-1表达减少;(3)CNI/NFAT通路:激活的CaN使NFAT去磷酸化,NFAT易位至细胞核并激活参与肌肉再生和重塑的基因。这并不是一个简单的通路,因为不同的NFAT亚型表现出不同的功能[29]。目前已假设骨骼肌中CaN/NFAT途径的抑制可促进胰岛素抵抗肌球蛋白快速纤维的转录,从而导致胰岛素抵抗的发生。此外,激活的NFAT可导致其他转录因子如MEF2和PGC-1水平的变化。Okuyama等[32]研究证实基质细胞蛋白Fibulin-5可作为胰腺胰岛细胞中GCK介导的CNI/NFAT信号通路中的一种靶标分子。
CNIs对脂肪细胞的影响虽然骨骼肌是葡萄糖摄取的主要器官,但脂肪细胞在由胰岛素刺激并经GLUT4介导的葡萄糖处置和摄取中也具有关键作用。此外,脂肪细胞衍生的细胞因子即ADIPOQ、LEP、生长素释放肽和抵抗素均具有重要的代谢功能调节作用。其中LEP和ADIPOQ可调节胰岛素分泌、葡萄糖和脂质代谢。LEP受体下调和ADIPOQ水平降低所导致的LEP水平升高与胰岛素抵抗有关。生长素释放肽与下丘脑中的血清素2c受体是刺激胰岛素分泌的强效下丘脑介质,对于任何给定的葡萄糖浓度均可增加胰岛素水平并诱导白色脂肪的形成。它们在破坏葡萄糖体内平衡的炎性细胞因子的最终产生中起作用,而这些因子可增强CNIs致代谢异常。如前所述,ADIPOQ rs1501299以及LEP rs2167270的基因多态性与PTDM显著相关。因此,CNIs对生长素释放肽的影响或者它们是否调节血清素2c受体可能是未来研究的方向。Pereira等[33]研究发现,即使是低于治疗浓度的CNIs也可抑制人类皮下和网膜脂肪细胞中葡萄糖的摄取。而治疗浓度的环孢素A和他克莫司可通过增加胞吞作用的速率移除人脂肪细胞表面的GLUT4从而抑制葡萄糖的摄取,与胰岛素信号传导无关。这些机制可导致免疫抑制治疗相关的胰岛素抵抗和糖尿病。
CNIs对中枢神经系统的影响下丘脑物质对能量稳态、食物摄入和体重有很大影响。生长素释放肽及血清素2c受体的阻断可增加食物摄入并减少能量消耗。LEP是一种在脂肪组织中合成且与食欲减少和体重减轻相关的食欲减退肽,可通过与下丘脑中的受体相互作用而在维持体重平衡和生殖中起作用。ADIPOQ似乎主要通过增加能量消耗使体重减轻,还能减少胰岛素抵抗。如前所述,CNIs参与其中一些介质的调节过程中。
小结:本文中总结的基因多态性主要涉及在影响CNIs致PTDM的过程的不同信号传导通路中具有功能的基因。目前的结果必须在未来的研究中进行复制,同时需整合其他临床协变量和遗传变异,从而更好地将临床和遗传变量的风险评估转化为临床实践,以改善移植受者的生活及生存质量。此外,维持体内葡萄糖稳态是一个复杂的过程,涉及多个器官、多个过程和多种介质。除了抑制CaN,CNIs还可能通过多种机制影响这一复杂过程中的多个步骤进而调节葡萄糖的体内平衡。本文总结了CNIs导致葡萄糖调节障碍的部分机制。未来需要进一步的研究来阐明对这一重要临床问题的完整理解,从而为PTDM的预防和治疗提供更多更好的策略。

