以血栓性微血管病为特征的系统性红斑狼疮肾损害
——附20例临床病理及预后分析
陈文萃 梁少姗 左 科 杨 柳 曾彩虹 刘志红 胡伟新
系统性红斑狼疮(SLE)的肾脏损伤主要由免疫复合物(IC)沉积引起肾小球固有细胞增生、基膜破坏和炎症细胞浸润所导致,即经典的狼疮性肾炎(LN)。此外,SLE还可通过非IC途径损伤内皮细胞导致肾脏血栓性微血管病(TMA)[1],或损伤足细胞导致狼疮足细胞病[2]。绝大多数文献报道SLE导致的肾脏TMA与IC介导的LN(尤其Ⅳ型、Ⅳ+Ⅴ型)并存[3-5],仅少数个案报道SLE肾损伤组织学上仅见TMA而无LN(本文称之为SLE-肾脏TMA)[6-8]。肾脏TMA与LN并存的患者肾损伤更重,而SLE导致TMA的机制不明,缺乏有效治疗,缓解率低,远期肾脏预后不良[5,9,10]。因此,在LN病理分型时强调识别TMA[11],但国际上尚未把TMA作为独立的肾损伤病理类型[12]。此外,TMA与LN两种病变并存时,难以研究TMA肾损伤的临床表现、病程转归及其发生机制。
本文利用LN肾活检队列,筛选出以肾脏TMA为主要病变的病例,分析其流行病学、临床及病理特征,治疗反应和远期预后。
对象和方法
研究对象2005年1月至2016年12月在东部战区总医院国家肾脏疾病临床医学研究中心首次住院肾活检的SLE患者,满足以下条件:(1)符合1997年美国风湿病协会SLE诊断标准;(2)有肾损害临床表现,肾活检病理示:①肾小球和/或间质血管TMA病变,排除Ⅲ型、Ⅳ型、Ⅴ型LN;②免疫荧光:肾小球无或仅系膜区IC沉积;③电镜检查:肾小球内皮下、上皮侧无电子致密物(ED),可有系膜区ED;(3)临床、病理及实验室资料完整;(4)排除恶性高血压、药物、妊娠等其他因素导致的TMA。
临床指标记录患者性别、发病年龄、入院时SLE及肾脏病程、SLE活动指数(SLE-DAI)、肾脏和肾外表现、治疗方案及预后。TMA三联征指外周血破碎红细胞比例>1%、血小板减少及血乳酸脱氢酶升高[1]。急性肾损伤(AKI)指48h内血清肌酐(SCr)升高至基线值的1.5倍或≥0.3 mg/dl;肾病综合征(NS)指尿蛋白定量(UPro)≥3.5 g/24h且血清白蛋白(Alb)<30 g/L。
实验室指标记录患者肾活检时的UPro、尿沉渣红细胞计数、血常规、血生化、外周血破碎红细胞比例;抗核抗体(ANA)、抗双链DNA抗体(抗ds-DNA)、补体(C3、C4)、抗磷脂抗体(抗心磷脂抗体、狼疮抗凝样物质、抗β2糖蛋白1抗体)、血管性血友病因子裂解酶13(ADAMTS13)活性。
肾组织病理肾组织行光镜、免疫荧光及电镜检查。光镜下要求肾组织标本肾小球数≥10个,间质小动脉数≥8条。免疫荧光染色观察Ig(s)、C3、C1q和Fibrin的沉积强度和部位。电镜观察肾小球ED沉积部位及数量、内皮下疏松和足突融合范围占肾小球血管袢面积的百分比。LN病理类型及小管间质急慢性病变分级参照国际肾脏病学会/肾脏病理分会(ISN/RPS)2018年修订共识[12]。
TMA诊断:肾小球TMA光镜下表现为肾小球内皮细胞增生肿胀、袢腔微血栓、系膜溶解;电镜可见内皮细胞剥脱、内皮下疏松。急性血管TMA表现为管腔内血栓/变形红细胞、管壁纤维素样坏死、内皮细胞增生肿胀及内皮下疏松。慢性血管TMA表现为动脉“洋葱皮”样改变、内膜黏液样增厚。
指标及定义完全缓解(CR)指 UPro<0.5 g/24h,Alb≥35.0 g/L,SCr正常或升高<10%基线值;部分缓解(PR)指UPro较基线下降>50%且<3.5 g/24h,Alb≥30 g/L,SCr正常或升高≤25%基线值。缓解包括CR和PR,且无肾外狼疮活动证据。
复发包括肾脏复发及肾外复发。肾脏复发指(1)蛋白尿复发:CR患者UPro≥1.0 g/24h,PR患者Upro增加≥2.0 g/24h伴或不伴血尿;(2)SCr升高:SCr增加≥50%(基线SCr正常的患者)或SCr增加≥30%(基线SCr异常的患者)。肾外复发指新出现肾外表现,SLE-DAI评分≥4分。
随访终点为死亡或终末期肾病(ESRD)[估算的肾小球滤过率(eGFR)<15.0 ml/(min·1.73m2)或维持性血液透析治疗>3个月],随访截止至2019年2月。
统计学分析采用《SPSS 17.0》统计软件进行数据处理。正态分布连续性变量以均数±标准差表示,组间比较采用t检验;非参数变量以中位数(四分位间距)表示,组间比较采用Mann-Whitney检验。分类变量以率表示,组间比较采用卡方检验。正态分布的变量相关分析采用Pearson检验,非正态分布变量相关分析采用Spearman检验。P<0.05为差异有统计学意义。
结 果
一般临床资料2005年1月至2016年12月共有3 109例SLE患者因肾损伤首次住院肾活检,除外肾小球和/或血管数不足、电镜标本无或仅有硬化肾小球等情况,共2 332例符合要求,用于筛查肾脏TMA。
在2 332例患者中,257(11.0%)例有肾脏TMA,其中237例TMA病变与LN并存,仅20例(0.9%)符合SLE-肾脏TMA,占有肾脏TMA的7.8%。
20例SLE-肾脏TMA患者,女∶ 男为18∶ 2,平均年龄(25±10)岁,中位SLE病程3.0(1.0,6.0)月,肾脏病程0.8(0.5,1.9)月。19例起病即表现为TMA,1例确诊SLE 3年后因SLE复发并发TMA。
临床和实验室表现临床及病理表现见表1。20例患者均有AKI,SCr平均344.76±189.18 μmol/L,其中11例(55.0%)需要肾脏替代治疗(RRT)。其他临床表现包括肾病综合征12例(60.0%),肉眼血尿7例(35.0%),高血压16例(80.0%)。

表1 患者的临床及病理资料
SLE:系统性红斑狼疮;HB:血红蛋白;PLT:血小板;MAHA:微血管病性溶血性贫血;UPro:尿蛋白定量;SCr:血清肌酐;Alb:血清白蛋白;抗ds-DNA:抗双链DNA抗体;C3/C4:补体C3/C4;SLEDAI:SLE活动指数;APA抗磷脂抗体;TMA:血栓性微血管病;IC:免疫复合物
20例均有血液系统异常,17例(85.0%)表现为微血管病性溶血性贫血,14例(70.0%)有血小板减少。13例(65.0%)符合TMA三联征。
肾外脏器损伤包括中枢神经系统症状3例(15.0%),肺动脉高压10例(50.0%)和心力衰竭6例(30.0%)。
自身抗体检查ANA均阳性,抗ds-DNA阳性10例(50.0%),抗磷脂抗体阳性8例(40.0%)。12例检测了ADAMTS13活性,3例下降,但ADAMTS13活性均>5.0%。
肾脏病理改变19例(95.0%)有肾小球TMA,其中17例伴血管TMA。2例仅有肾小球TMA,1例仅有血管TMA。
肾小球病变:15例内皮细胞增生肿胀,3例见袢内血栓,1例系膜溶解。8例免疫荧光检查阴性,12例系膜区有Ig(s)和补体沉积伴系膜增生,6例血管袢Fibrin染色阳性。电镜检查肾小球内皮下及上皮侧均无ED,12例系膜区有ED沉积。5例内皮下疏松范围>50%,11例足突融合范围≥50%(图1)。

图1 肾小球血栓性微血管病的形态学改变
间质血管病变:12例见血栓形成,9例内膜黏液样增厚水肿,10例见小动脉“洋葱皮”样改变。Fibirn染色2例间质血管阳性,1例血管袢及间质血管均阳性。
5例小管间质急性病变重度,小管萎缩/间质纤维化均为轻-中度。
病理指标与临床的联系需RRT患者小管间质急性病变较不需RRT患者严重(43.6%±24.9%vs21.7%±20.1%,P=0.047)。足突融合范围与蛋白尿正相关(r2=0.347,P=0.006)(图2),NS的患者足突融合范围显著高于非NS患者(55.8%±23.9%vs36.3%±16.0%,P=0.042)。内皮下疏松范围与SCr、UPro及足突融合范围无相关。系膜区有IC沉积组与无IC沉积组比较,SCr、蛋白尿、内皮下疏松及足突融合范围均无差异。

图2 尿蛋白定量与足突融合比例的相关性
治疗及预后治疗及随访结局见表2。患者均接受大剂量激素冲击治疗,接受血浆置换(包括双重血浆置换)和丙球治疗的分别为4例和3例。11例入院即需RRT患者均摆脱透析,摆脱透析的中位时间为16.0(9.0,30.0)d。随访中共15例获得CR,获得CR中位时间为10.0(4.0,15.0)月,4例获得PR,1例未缓解。诱导期3例并发严重肺部感染,2例出现带状疱疹。中位随访58.0(36.0,92.3)月,6例(30%)复发(表2),人肾均存活。
讨 论
本研究纳入的20例患者,组织学以肾小球TMA和/或血管TMA为特征,不伴增生性或膜性LN,虽然半数以上病例系膜区见IC沉积,但其与肾小球内皮细胞及足细胞损伤无相关。在狼疮足细胞病的研究中,也发现肾小球系膜区IC沉积与足突融合范围及蛋白尿无关[13-14]。这些系膜区沉积的IC,并不参与肾小球内皮细胞或足细胞的损伤,可能是SLE肾损伤的一种标记。因此,本组病例均考虑为SLE直接导致的肾脏TMA,是SLE导致的特殊肾损伤类型,作者认为可称之为狼疮TMA或TMA型LN。本研究结果表明,在2 332例SLE肾活检标本中,11.0%存在肾脏TMA病变,狼疮TMA约占1%。
本组狼疮TMA的肾小球病变光镜下主要表现为内皮细胞增生肿胀,基膜分层,易被误认为增生性肾小球肾炎而诊断为Ⅳ型LN。ISN/RPS的LN病理分型2018修订共识[12]指出,单纯内皮细胞肿胀但无炎细胞浸润和IC沉积,超微病理表现为内皮细胞剥脱、内皮下疏松,内皮下或上皮侧无ED沉积时,应考虑TMA。因此,狼疮TMA的诊断单凭光镜和荧光检查尚不够,需结合电镜检查。本组狼疮TMA临床表现特殊,均有AKI和血液系统损伤,多数伴高血压和大量蛋白尿,65%有TMA三联征,因此,SLE患者有上述临床特征时应排除狼疮TMA。如无禁忌,应通过肾活检明确狼疮TMA或狼疮TMA伴LN的诊断。
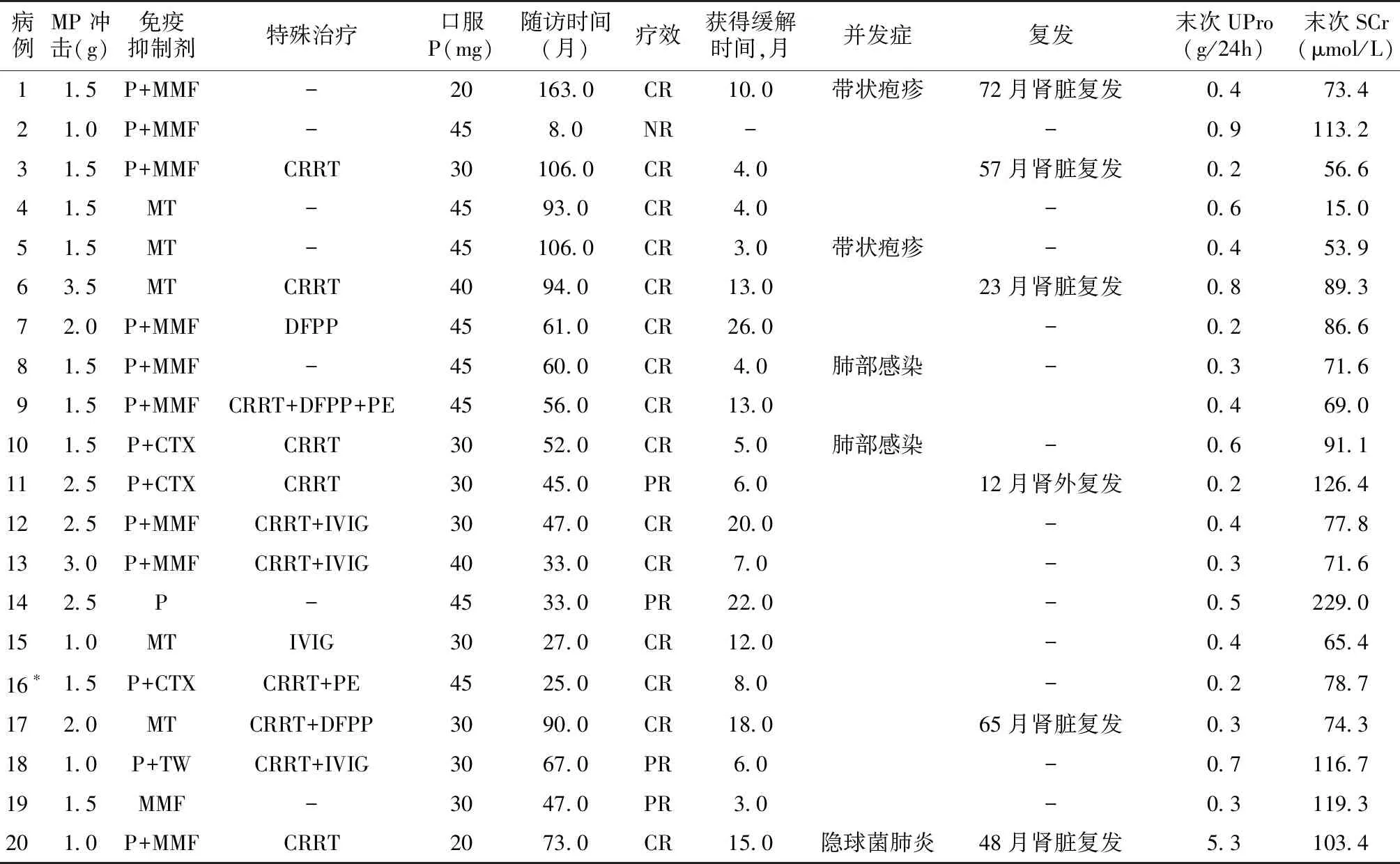
表2 患者的治疗及随访结局
CRRT:持续肾脏替代治疗;PE:血浆置换;DFPP:双重血浆滤过;IVIG:静脉丙种球蛋白;MMF:吗替麦考酚酯;MT:泼尼松+他克莫司+MMF;CTX:环磷酰胺;TW:雷公藤多苷;MP:甲泼尼龙;P:泼尼松;CR:完全缓解;PR:部分缓解;NR:未缓解;UPro:尿蛋白定量;SCr:血清肌酐;*:例16因急性左心衰需要CRRT治疗
本组狼疮TMA患者肾功能损伤严重,均表现有AKI,且半数以上需要RRT。肾小球及血管TMA病变是造成AKI的病理基础。肾小球TMA导致内皮细胞增生肿胀、内皮下疏松,引起肾小球滤过面积减少;血管TMA则引起管腔狭窄及血栓,导致肾小球缺血和肾小管急性损伤[1]。本组病例需RRT患者的急性肾小管损伤程度明显重于不需RRT患者,表明肾小管急性损伤在狼疮TMA患者AKI发生中起重要作用。
除AKI高发外,本组半数以上患者存在大量蛋白尿,Upro与足突融合范围呈正相关,表明狼疮TMA同时存在足细胞损伤,但机制不明。本文未发现内皮下疏松范围与足细胞损伤之间的相关性,需进一步寻找除内皮下疏松范围外,内皮细胞损伤的其他标记;并研究TMA时内皮细胞是否可通过旁分泌信号分子及其受体影响足细胞功能[15-17]。
本组患者尽管入院时肾功能损伤重,但治疗后75.0%获得CR,随访近5年,人肾均存活,预后优于TMA伴LN患者。尤其11例需要RRT的患者治疗后均摆脱透析,而TMA合并LN患者,摆脱透析的比例不足50%[5,8,18]。本组狼疮TMA患者预后好,分析有以下原因:(1)起病急,病程短,且均为初发,而文献报道的TMA伴LN病例,病程均较长,多数在LN复发后并发肾脏TMA。(2)本组病例肾脏病变活动,慢性病变轻。(3)积极的免疫抑制治疗及血浆置换或大剂量丙球冲击治疗。此外,是否与治疗前肾小球及血管TMA未发生内皮细胞-间充质细胞转分化或治疗后逆转有关,有待深入研究。因此,SLE-肾脏TMA需要早期诊断、积极治疗。但本组中3例并发严重肺部感染,可能与严重肾功能不全、强化免疫抑制治疗、营养不良等因素有关。治疗前需要综合评估感染风险,优化治疗方案,加强感染预防。
小结:SLE仅表现为肾小球和血管TMA的肾损伤类型发生率低,肾功能损伤严重,临床和肾活检病理应早期辨别。积极免疫抑制治疗缓解率和肾脏存活率高。以TMA为特征性病变的肾损伤应作为SLE肾损伤的独立类型,其发病机制,尤其与LN并存时肾脏损伤的机制需要进一步研究。

