姜黄素对人椎间盘髓核细胞自噬和退变的影响
万俊锋 阳 波 郑佳状 冉茂波 宋昭君
四川省遂宁市中心医院骨科,四川遂宁 629000
细胞外基质蛋白合成的减少以及降解的增加是椎间盘退变的主要特征,这种分解代谢平衡的破坏进一步引起椎间盘组织结构的变化,最终导致椎间盘无法承受生理载荷,失去应有的稳定性,从而导致患者发生脊柱退行性改变[1-3]。因此找到合适的治疗方式抑制髓核细胞外基质的降解,从而延缓椎间盘退变已成为目前的研究热点。
姜黄素(Curcumin)是一种在我国种植的草本植物,许多研究[4-7]表明,姜黄素具有抗炎、抗凋亡和抗氧化应激等作用。研究发现姜黄素可以通过激活ERK通路促进软骨细胞的自噬从而抑制其凋亡[8],以及姜黄素可以通过抑制NF-κB 通路从而提高软骨细胞外基质Ⅱ型胶原的合成和降低基质金属蛋白酶-13(MMP-13)的表达[9]。但是姜黄素在椎间盘中的作用目前还很少研究,因此本实验初步探讨姜黄素对人椎间盘髓核细胞退变和自噬的相关研究。
1 材料与方法
1.1 实验材料
人椎间盘髓核组织取自遂宁市中心医院(以下简称“我院”)骨科收治的椎间盘突出的7 例患者,男4 例,年龄56~78 岁,女3 例,年龄61~76 岁。与患者及家属签订知情同意书,并获得我院医学伦理委员会批准。按照Pfirrmann 等[10]的分级标准对所获得的椎间盘组织进行分级,为Ⅳ~Ⅴ级。排除恶性肿瘤和神经系统病史,术后病理检查结果均为退变的椎间盘组织。四甲基偶氮唑盐比色法(MTT)试剂盒购自南京凯基生物科技发展有限公司;姜黄素、微管相关蛋白3(LC3)B抗体和Beclin 1 抗体均购自美国Sigma 公司;GFPLC3 腺病毒购自上海汉恒生物科技有限公司;MMP-3和MMP-13 抗体购自美国Cell Signaling Technology公司;聚集蛋白聚糖(aggrecan)抗体、β-actin 抗体和二抗均购自武汉博士德公司;胶原蛋白(Collagen)Ⅱ抗体购自美国SAB 公司。
1.2 实验方法
1.2.1 髓核细胞的提取和培养 将获得的椎间盘组织用无菌PBS 液反复清洗数次,用剪刀把髓核组织剪成小的组织粒,置于含0.25%胰酶的离心管中消化1 h,然后离心取沉淀,置于含Ⅱ型胶原酶的离心管中消化4 h,用200 目滤网过滤,收集的细胞置于含20%胎牛血清的F12:DMEM 培养瓶中,放入37℃5%CO2的培养箱中培养,每3~4 天更换培养液,1∶2 传代。
1.2.2 MTT 检测 选择在对数期生长的髓核细胞,用0.25%胰蛋白酶消化,调整细胞浓度为1×105/mL,接种于96 孔板中,每孔100 μL,继续培养待细胞长到80%左右进行药物处理。对照组只加培养基,白细胞介素-1β(IL-1β)组给予10 ng/mL 处理,而不同浓度的姜黄素处理组给予10、20、40、80、100、150 μmol/L的姜黄素处理,每组设3 个复孔。细胞继续培养24 h后,加入MTT 20 μL 后放入37℃5% CO2培养箱继续培养4 h 后,每孔加入DMSO 100 μL,最后在酶标仪490 nm 检测每孔光度值。
1.2.3 GFP-LC3 转染观察 各组细胞更换培养基,用PBS 清洗,向每个培养皿中加入1 mL 培养基和1.5 μL GFP-LC3 腺病毒,继续培养24 h,然后弃掉培养基,分别给予各实验组对应的药物处理,作用24 h 后,吸尽培养液,PBS 清洗,固定液固定15 min,PBS 液清洗,加入DAPI,37 ℃染色10 min,激光共聚焦显微镜下观察。
1.2.4 Western blot 检测 向各细胞瓶内加入一定量的裂解液,置于冰上裂解30 min 后用细胞刮收集细胞蛋白,用BCA 蛋白定量试剂盒检测蛋白浓度,加入buffer 后加热10 min 变性,配胶进行SDS-PAGE电泳2 h,然后在250 mA 恒定电流条件下进行转膜,5%脱脂奶粉封闭,加入稀释的一抗,放入4℃过夜,加入稀释的二抗,室温摇床上2 h,ECL 化学发光。所有实验均独立重复3 次。
1.2.5 RT-PCR 检测 各组细胞处理后分别进行RNA提取,用Trizol 对各组细胞裂解提取总RNA,取2 μL总RNA 按照逆转录试剂盒说明合成cDNA 并进行扩增。MMP-3 引物序列:上游5′-ATTCCATGGAGCCAGGCTTTC-3′,下游5′-CATTTGG-GTCAAACTCCAACTGTG-3′;MMP-13 引物序列:上游5′-TTGATGATGATGAAACCTGGACAAG-3′,下游5′-TTGCCGGTGTAGGTGTAGATAGGAA-3′;Collagen Ⅱ引物序列:上游5′-CAGGTGAACCTGGACGAGAG-3′,下游5′-CCCACAGCACCAGTCTCAC-3′;Aggrecan 引物序列:上游5′-CTACCAGTGGATCGGCCTGAA-3′,下游5′-CGTGCCAGATCATCACCACA-3′;GAPDH 引物序列:上游5′-GCAC-CGTCAAGGCTGAGAAC-3′,下游5′-TGG-TGAAGACGCCAGTGGA-3′。PCR 反应体系为50 μL,PCR 反应条件:95℃30 s,60℃30 s,共循环40 次,95℃10 s,65℃5 s 进行溶解分析。以GAPDH 为内参照标化各组cDNA 模板,目的基因的表达值采用2-ΔΔCt法计算。所有实验均独立重复3 次。
1.3 统计学方法
采用SPSS 18.0 软件进行统计学分析。计量资料采用均数±标准差(±s)表示,各组间比较采用单因素方差分析,组间两两比较采用LSD-t 检验,以P <0.05 为差异有统计学意义。
2 结果
2.1 MTT 检测姜黄素对髓核细胞活性的影响
MTT 检测结果发现当姜黄素浓度为100、150、200 μmol/L 时,能够显著的抑制髓核细胞的活性(P <0.05),而姜黄素浓度为10、20、40、80 μmol/L 时对髓核细胞的生长活性没有显著影响(P >0.05)。因此考虑到以不影响髓核细胞活性的情况下尽可能地发挥姜黄素的作用,选择姜黄素浓度为80 μmol/L 进行后续的实验。见图1。

图1 MTT 检测姜黄素对髓核细胞活性的影响
2.2 RT-PCR 检测姜黄素对髓核细胞退变mRNA 水平的影响
RT-PCR 检测发现与对照组比较,IL-1β 显著降低Collagen Ⅱ和aggrecan mRNA 的表达,增加MMP-3和MMP-13 mRNA 的表达(P <0.05)。而与IL-1β 组比较,姜黄素处理后明显地提高Collagen Ⅱ和aggrecan mRNA 的表达,降低MMP-3 和MMP-13 mRNA 的表达(P <0.05)。见图2。

图2 RT-PCR 检测姜黄素对髓核细胞退变mRNA 水平的影响
2.3 Western blot 检测姜黄素对髓核细胞退变蛋白水平的影响
Western blot 检测发现与对照组比较,IL-1β 显著降低Collagen Ⅱ和aggrecan 蛋白的表达,增加MMP-3和MMP-13 蛋白的表达(P <0.05)。而与IL-1β 组比较,姜黄素处理后明显提高了Collagen Ⅱ和aggrecan蛋白的表达,降低MMP-3 和MMP-13 蛋白的表达(P <0.05)。见图3。
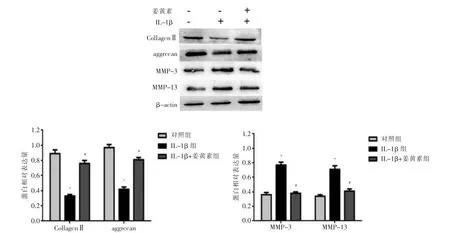
图3 Western blot 检测姜黄素对髓核细胞退变蛋白水平的影响
2.4 姜黄素促进GFP-LC3 腺病毒转染的髓核细胞自噬颗粒的增多
通过GFP-LC3 腺病毒转染髓核细胞后,观察发现对照组和IL-1β 组髓核细胞内自噬颗粒数很少,而姜黄素处理后髓核细胞内的自噬颗粒数明显增多。见图4(封三)。

图4 GFP-LC3 腺病毒转染后观察髓核细胞内自噬情况(800×)(见内文第13 页)
2.5 姜黄素能明显促进髓核细胞自噬蛋白的表达
Western blot 结果显示对照组和IL-1β 处理组髓核细胞内自噬蛋白LC3Ⅱ和Beclin 1 水平较低,而姜黄素处理后髓核细胞内的自噬蛋白LC3Ⅱ和Beclin 1水平明显增加(P <0.05)。见图5。
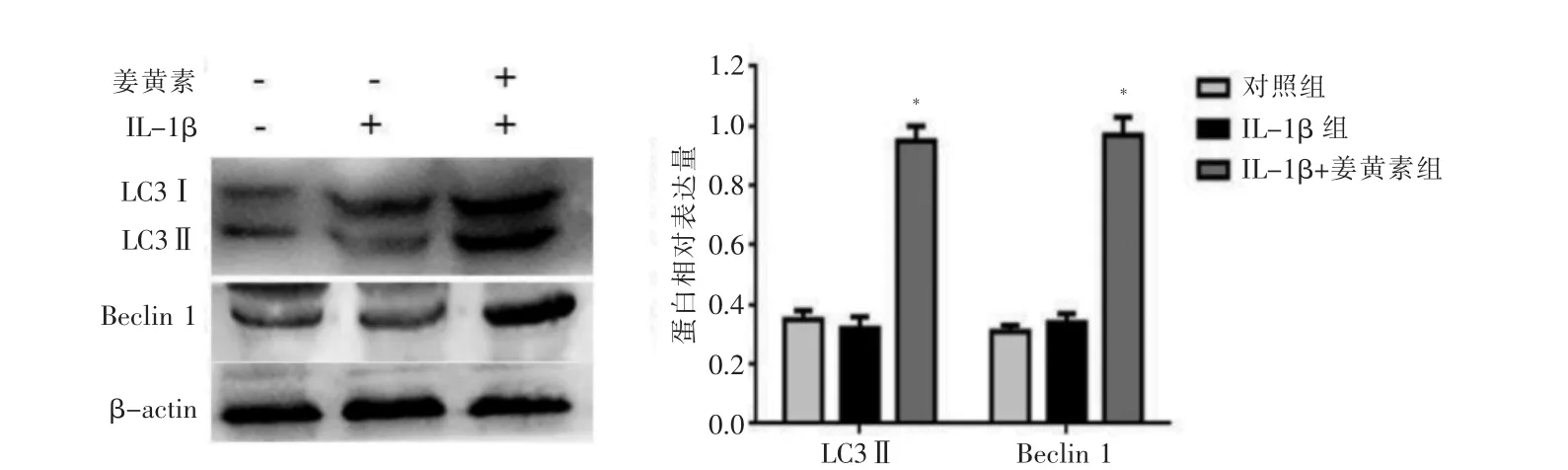
图5 Western blot 检测姜黄素对髓核细胞自噬蛋白的表达
3 讨论
髓核细胞外基质的改变被认为是椎间盘退行性改变的主要问题。细胞外基质的主要成分是Ⅱ型胶原蛋白和蛋白多糖,在退变椎间盘中表达下降。同时细胞外基质中分解代谢蛋白酶如基质金属蛋白酶在椎间盘退变中上调,这是椎间盘退变中细胞外基质降解的主要原因[11-13]。研究[14]表明,IL-1β 能直接抑制椎间盘细胞外基质的合成和增加MMP 的表达,同时本研究也提示IL-1β 处理髓核细胞后能够抑制aggrecan 和CollagenⅡ的表达和MMP-3 和MMP-13 的表达,所以使用IL-1β 处理髓核细胞。
姜黄素在治疗许多疾病包括阿尔茨海默病,骨关节炎等方面有一定疗效[15-16]。研究[17]报道,姜黄素能够抑制软骨细胞基质的降解和促进其合成。但在椎间盘中的报道却很少,本研究发现当用姜黄素处理IL-1β诱导的髓核细胞后,髓核中Collagen Ⅱ和aggrecan的表达明显增多,而MMP-3 和MMP-13 表达明显下降,表明姜黄素能够减缓椎间盘的退变,但是其具体分子机制还不是很清楚。
自噬是一种自我保护的方式,通过将细胞受损蛋白质和细胞器降解,以维持细胞内环境稳定,在人类退行性疾病中被广泛研究[18-19]。研究[20]表明自噬对软骨细胞和椎间盘的退行性过程有保护作用。姜黄素能通过促进自噬抑制软骨细胞的凋亡[8]。但是姜黄素对椎间盘的保护作用是否与自噬相关还不是很清楚,本研究结果提示,当给予姜黄素处理IL-1β 诱导的髓核细胞后自噬蛋白LC3Ⅱ和Beclin 1 水平明显增加,同时GFP-LC3 腺病毒转染后也发现姜黄素处理后髓核细胞内的自噬颗粒数明显增多。
综上所述,姜黄素能够减缓椎间盘的退变,其可能的机制是姜黄素促进髓核细胞的自噬,但是其进一步的分子机制还有待继续研究。

