双菌株联合发酵提高鹰嘴豆纳豆激酶活力的研究
郭晨 汪晓鸽 孔少华 尚紫博 樊一 吕成状 黄裔翔 张俊杰

摘要:以鹰嘴豆为原料,选取两株不同来源的纳豆芽孢杆菌F\|2\|4和S\|15,分别通过单接种和混合接种的方式,制备鹰嘴豆纳豆,并测定其纳豆激酶活力,結果表明:通过混合接种方式制备的鹰嘴豆纳豆的纳豆激酶活力明显高于单接种方式,当F\|2\|4与S\|15接种体积比为1GA6FA1,且接种量为4%时,鹰嘴豆纳豆的纳豆激酶活力达到最高值6 287.16 UI/g.
Abstract:With chickpea as material,two Bacillus subtilisnatto strains (F\|2\|4 and S\|15) isolated from different sources were selected and were inoculated into chickpea to prepare chickpea natto products by single\|inoculation and co\|inoculation,then nattokinase activity of chickpea natto was determined.Results showed that nattokinase activity was improved significantly by co\|inoculation.When the inoculative volume ratio of F\|2\|4 and S\|15 was 1GA6FA1,and inoculation amount was 4%,the nattokinase activity of chickpea natto reached the maximum 6 287.16 UI/g.
关键词:双菌发酵;鹰嘴豆;纳豆芽孢杆菌;纳豆激酶
Key words:two strains fermenta\|tion;chickpea;Bacillus subtilisnatto;nattokinase
中图分类号:TS214.9文献标识码:ADOI:10.3969/j.issn.2096-1553.2019.04.003
文章编号:2096-1553(2019)04-0015-06
0 引言
传统纳豆是以大豆为原料,接种纳豆芽孢杆菌(Bacillus subtilisnatto)后,在一定条件下通过发酵而制成的一种豆类食品[1].成熟的纳豆呈深黄色,有光泽,口感松软,表面黏液明显,用筷子挑起可以拉起很长的黏液丝状物质,口感微甜,有淡淡氨臭味[2].纳豆营养价值很高,具有抗血栓、降血压、抗肿瘤等多种生理功能,长期食用可预防或治疗多种亚健康疾病[3].纳豆激酶是一种具有强大溶栓活性的丝氨酸蛋白酶[4],与临床一线溶栓药物(尿激酶和链激酶) 相比,纳豆激酶具有安全性好、成本低、半衰期长、可口服等优点,因此作为溶栓药物或保健食品备受关注[5].
尽管纳豆是一种成本低、营养价值高的健康食品,但因其具有特殊氨臭味,不易被广大消费者接受[6].
鹰嘴豆是仅次于大豆的世界第二大种植豆类[7],所含氨基酸种类齐全,且包含了人体必需的8种氨基酸[8].
金爽等[9]研究发现,鹰嘴豆经纳豆芽孢杆菌发酵后,具有比传统纳豆氨臭味轻、拉丝现象少、口感好、纳豆激酶活性高等优点.
因此,用鹰嘴豆发酵制作纳豆具有广阔的开发前景.
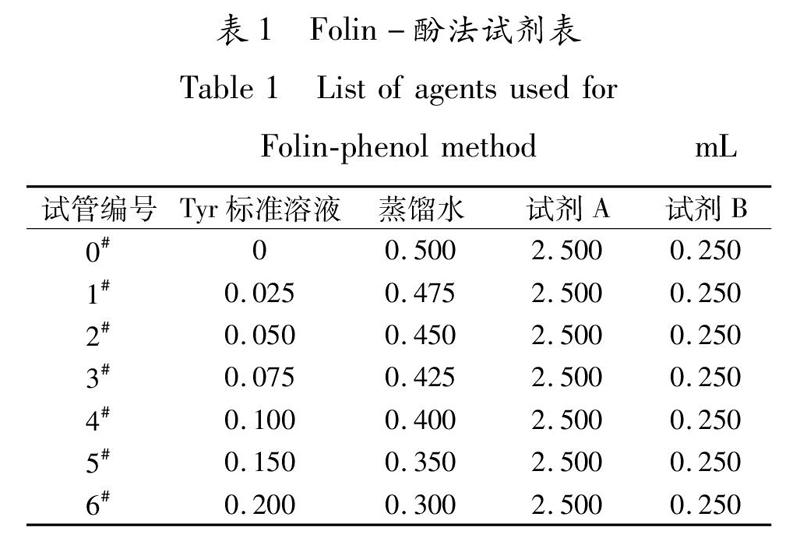
纳豆芽孢杆菌是可应用于食品的安全益生菌,具有改善人体肠道菌群,助消化,增强肌体免疫力等功能[10].将纳豆芽孢杆菌接种到鹰嘴豆上进行发酵,可制成富含纳豆激酶的鹰嘴豆纳豆.纳豆激酶活力是评价纳豆品质和营养价值的重要指标,其评价方法很多,主要包括纤维蛋白平板法、纤维蛋白块溶解时间法、四肽底物法、酶联免疫吸附法、血清板法和Folin-酚法等[11].其中,Folin-酚法简单易行、成本低,可以同时测定多个样品,且采用此法测得的纳豆激酶活力与纤溶活力之间存在一定的相关性[12].
张俊杰等[13]分别从市购纳豆和土壤中分离出纳豆芽孢杆菌,用其发酵制备鹰嘴豆纳豆,并采用Folin-酚法测定了鹰嘴豆纳豆的纳豆激酶活力.高瑞雄等[10]用分离自市购纳豆中的纳豆芽孢杆菌
菌株发酵得到的纳豆中,纳豆激酶活力更高;从土壤中分离出的纳豆芽孢杆菌菌株,在发酵鹰嘴豆纳豆产纳豆激酶方面也有着接近于市购纳豆中分离出的纳豆芽孢杆菌菌株的优良性能.此外,接种方式和接种量对纳豆芽孢杆菌的生长状态具有重要影响,进而影响其发酵过程[14].王瑞珍等[15]用纳豆芽孢杆菌与戴尔凯氏有孢圆酵母混合接种发酵核桃粕,纳豆激酶活力提高了70.42%.孙军德等[16]采用沼泽红假单胞菌和纳豆芽孢杆菌混合固态发酵淀粉豆,纳豆激酶活力提高了53.74%.
张超凤等[17]在运用响应面法优化纳豆激酶液态发酵条件时发现,随着纳豆芽孢杆菌接种量的增加,纳豆激酶活力也在提高,当纳豆芽孢杆菌接种量为2%时,纳豆激酶活力最高,而当纳豆芽孢杆菌接种量超过2%时,纳豆激酶活力急剧下降.
基于此,本研究拟以鹰嘴豆为原料,从分离自市购纳豆和土壤的纳豆芽孢杆菌中各挑选一株高产纳豆激酶菌株,同时设置不同的接种量梯度,并分别采用单接种和混合接种两种方式制备鹰嘴豆纳豆,以纳豆激酶活力为响应指标,研究最佳接种量和接种体积比,以期制得具有高纳豆激酶活力的鹰嘴豆纳豆.
1 材料与方法
1.1 材料
1.1.1 原料 鹰嘴豆,购自云南文山自治州丘北县;纳豆芽孢杆菌菌株F|2|4和S|15,分别分离自市购纳豆和土壤,现保存于郑州轻工业大学423实验室菌库(WYCCWF).
1.1.2 主要培养基与试剂 LB固体培养基和胰蛋白胨(生化试剂),北京奥博星生物技术有限责任公司产;Folin-酚试剂(分析纯),北京索莱宝科技有限公司產;酵母浸粉(生化试剂),北京双旋微生物培养基制造厂产;L-酪氨酸(分析纯),合肥博美生物科技责任有限公司产;HCl,NaCl,Na2HPO4,KH2PO4,Na2CO3,MgSO4等化学试剂(分析纯),天津市永大化学试剂有限公司产.
1.1.3 主要仪器与设备 DH-600A型电热恒温培养箱、
101型电热鼓风干燥箱,北京中兴伟业仪器有限公司产;SW-CJ-2D型超净工作台,苏州净化设备有限公司产;DMEX30型生物显微镜,宁波舜宇仪器有限公司产;BCD-221TMBA型冰箱,青岛海尔股份有限公司产;FORMA-86C型超低温冰箱,郑州金友宁仪器有限公司产;ZWY-100H型摇床,上海智城分析仪器制造有限公司产;AE224型分析天平,北京赛多利斯天平有限公司产;TGL-16G型离心机,上海安亭科学仪器厂产;SC-15型恒温水浴锅和SCIENTZ-10N型真空冷冻干燥机,宁波新芝生物科技有限公司产;T6型紫外可见光分光光度计,北京普析通用仪器有限责任公司产.
1.2 实验方法
1.2.1 菌株的活化
从-80 ℃冰箱中取出筛选保存的供试纳豆芽孢杆菌菌株F|2|4和S|15甘油管,
待甘油管在室温下融化后,在超净工作台内吸取100 μL菌液,采用划线平板法均匀涂在LB平板上,于37 ℃条件下倒置培养.待菌落长出后,挑取单菌落接种于50 mL液体培养基中,于37 ℃条件下振荡培养24 h,备用.
1.2.2 鹰嘴豆纳豆的制备 鹰嘴豆纳豆的制备工艺流程为:
原料预处理→蒸煮→接种→发酵→后熟.具体制作步骤如下.
1)原料预处理:挑选颗粒饱满、大小均匀的鹰嘴豆,清水淋洗去除鹰嘴豆中的杂质,于室温下清水浸泡24 h.
2)蒸煮:将浸泡后的鹰嘴豆在0.13 MPa压力下蒸煮20 min.
3)接种:于无菌条件下按设定的接种量和接种体积比接种纳豆芽孢杆菌.接种后轻轻晃动三角瓶,使鹰嘴豆与菌液充分接触.
4)发酵:于37 ℃恒温恒湿培养箱中发酵培养24 h.
5)后熟:发酵结束后,置于4 ℃条件下后熟24 h[13],即得鹰嘴豆纳豆.
1.2.3 单接种实验
将F|2|4和S|15两株菌的菌液分别以V(单菌株)GA6FAm(鹰嘴豆)=2%,4%,6%,8%,10%的接种量接种到灭菌蒸熟的鹰嘴豆中,采用1.2.2中的发酵条件制备鹰嘴豆纳豆,然后测定各样品纳豆激酶活力.
1.2.4 混合接种实验
将F|2|4和S|15两株菌的菌液分别以1GA6FA3,1GA6FA2,1GA6FA1,2GA6FA1,3GA6FA1 的体积比混合后,以V(混合菌株)GA6FAm(鹰嘴豆)=2%,4%,6%,8%,10%的接种量分别接种到灭菌蒸熟的鹰嘴豆中,采用1.2.2中的发酵条件制备鹰嘴豆纳豆,同时测定各样品纳豆激酶活力.
1.2.5 纳豆激酶粗酶液的制备
将发酵好的新鲜纳豆送入预冷室冷冻至-35~-40 ℃,然后进行冷冻干燥,最后用粉碎机粉碎即得含纳豆激酶的纳豆样品粉末.在每g纳豆样品粉末中加入5 mL质量分数为0.9%的生理盐水,于4 ℃条件下浸提4 h,再于4 ℃条件下 4500 r/min 离心20 min,所得上清液即为纳豆激酶粗酶液[17].
1.2.6 酪氨酸标准曲线的绘制
按照表1所示Folin-酚法试剂表依次加入Tyr标准溶液、蒸馏水和试剂A,混匀,室温放置10 min,再加入试剂B,立即混匀,室温放置30 min,以0#管作为空白对照调0,于 680 nm波长处测定其他各管OD值,然后以酪氨酸(Tyr)标准溶液质量浓度/(μg·mL-1)为横坐标,OD值为纵坐标,绘制酪氨酸标准曲线.
1.2.7 纳豆激酶粗酶液OD值的测定
参考标准SB/T 10317—1999[18]的方法,在1.5 mL离心管中加入300 μL纳豆激酶粗酶液,再加入300 μL质量分数为1%的酪蛋白溶液,混匀,40 ℃ 水浴加热10 min,再加入300 μL质量分数为10%的三氯乙酸溶液终止反应.于室温条件下4500 r/min离心10 min.取上清滤液 20 μL,用上述Folin-酚法测定680 nm波长处的纳豆激酶粗酶液OD值.
1.2.8 纳豆激酶活力计算方法
在40 ℃条件下,每g样品每min水解酪蛋白产生1 μg酪氨酸,即被定义为1个蛋白酶活力单位.样品纳豆激酶活力计算公式如下.
样品纳豆激酶活力=A10M×45N
式中:A为由样品测得的OD值,带入标准曲线得相应的酪氨酸质量/μg;10表示反应时间 10 min;M为样品质量/g;45表示从900 μL反应液中取出20 μL进行测定,即45倍;N为酶液稀释的倍数.
1.3 数据处理
使用Origin 9.1进行数据处理.
2 结果与分析
2.1 酪氨酸标准曲线的绘制与分析
图1为用Folin-酚法绘制的酪氨酸标准曲线,得到的标准曲线回归方程为y=0.056 5x+0.003,相关系数R2=0.999 1,表明两者之间线性关系良好,能够用于样品纳豆激酶活力的测定.
2.2 单接种对纳豆激酶活力的影响
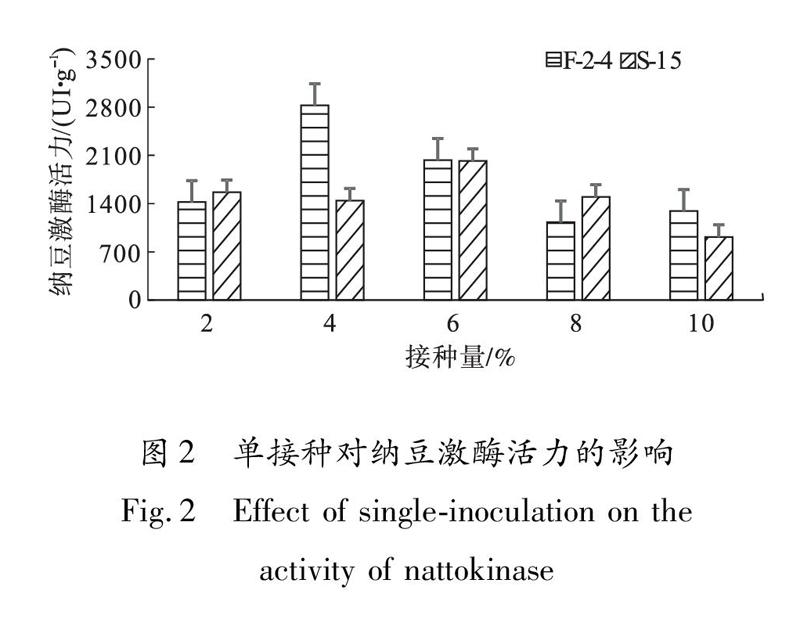
图2为单接种对纳豆激酶活力的影响结果.从图2可以看出,采用单一菌株发酵制备的鹰嘴豆纳豆的纳豆激酶活力较低,均在3000 UI/g以下,且纳豆激酶活力均呈现出随着接种量的增加先升高后降低的趋势.其中,F|2|4 菌株在接种量为4%时纳豆激酶活力最高,达2 827.09 UI/g,显著高于S|15菌株的1 443.99 UI/g;而S|15菌株在接种量为6%时纳豆激酶活力最高,为2 017.78 UI/g,与接种F|2|4菌株的2 032.79 UI/g无显著差异.这可能是因为随着接种量增加,纳豆芽孢杆菌在发酵过程中产生的大量代谢产物抑制了其自身生长,从而使发酵后期的纳豆激酶活力有所降低.
2.3 混合接种对纳豆激酶活力的影响
图3为混合接种对纳豆激酶活力的影响结果.从图3可以看出,经混合接种发酵后,纳豆激酶活力显著提升,均高于5000 UI/g,显著高于单接种时的纳豆激酶活力.当F|2|4菌株与S|15菌株的接种体积比为1GA6FA3,1GA6FA2和3GA6FA1时,在接种量为6%时达到最大值,分别为6 157.16 UI/g,5 793.12 UI/g和5 906.88 UI/g;
且当F|2|4菌株与S|15菌株的接种体积比为1GA6FA3时,纳豆激酶活力随着接种量的增加呈现出先增加后减少的趋势,而当F|2|4菌株与S|15菌株的接种体积比为1GA6FA2和3GA6FA1时,纳豆激酶活力在接种量为6%时达到最高值后随着接种量的增加呈现出一定的波动.当F|2|4菌株与S|15菌株
的接种体积比为1GA6FA1和2GA6FA1时,在接种量为4%时达到最大值,分别为6 287.16 UI/g 和5 626.78 UI/g.而在相同的接种量下,纳豆激酶活力均在两株菌接种体积比为1GA6FA1时达到最高.当接种体积比为1GA6FA1,接种量为4%时,纳豆激酶活力为所有接种组合中的最高值,为6 287.16 UI/g.因此,确定当菌株F|2|4与S|15的混合接种体积比为1GA6FA1,接种量为4%时,为两菌珠混合接种的最优接种参数.
3 结论
本研究采用两株分离自市售纳豆和土壤的纳豆芽孢杆菌F|2|4和S|15,分别采用单接种和混合接种两种方式发酵鹰嘴豆,制备鹰嘴豆纳豆.结果表明,与单接种相比,F|2|4菌株和 S|15菌株混合接种后,鹰嘴豆纳豆的纳豆激酶活力从不到3000 UI/g增加到5000 UI/g以上,有了显著的提升.当两菌株接种体积比为1GA6FA1,接種量为4%时,鹰嘴豆纳豆中纳豆激酶活力最高,达6 287.16 UI/g.这说明在混合接种条件下,两菌协同生长可以更好地促进纳豆激酶的产生.
该研究的结果已证明混合接种相较于单接种对提高纳豆激酶活力有着明显的优势,而影响鹰嘴豆纳豆的纳豆激酶活力的因素还有很多,比如发酵时间、发酵温度等.
接下来拟进一步研究混合接种其他因素对鹰嘴豆纳豆感官品质的影响,以便为鹰嘴豆纳豆的开发和推广提供参考.
参考文献:
[1] 赵倩楠.四种豆子纳豆发酵工艺条件的研究及产品开发[D].西安:陕西科技大学,2014.
[2] 祁红兵,宋军霞.黄豆不同处理形态发酵纳豆的品质比较[J].大豆科学,2018,37(5):126.
[3] 黄婷,刘良忠,曹宇翔,等.纳豆固态发酵工艺优化[J].中国酿造,2016,35(1):141.
[4] 吴燕,梁向峰,刘会洲,等.纳豆激酶分批补料发酵的研究[J].食品与发酵工业,2018,44(1):126.
[5] 李淑英,赵仲麟,聂莹,等.纳豆激酶研究进展[J].中国农业科技导报,2013,15(4):139.
[6] 王琳,高辰哲,刘丹怡,等.响应面法优化红豆纳豆的发酵工艺[J].中国酿造,2018,37(1):190.
[7] ZHANG J J,YANG X,GUO C,et al.Mesorhizobium muleiense and Mesorhizobium gsp.nov.are symbionts of Cicer arietinum L.in alkaline soils of Gansu,Northwest China[J].Plant and Soil,2017,410(1/2):103.
[8] ARCHAK S,TYAGI R K,HARER P N,et al.Characterization of chickpeagermplasm conserved in the Indian National Genebank and development of acoreset using qualitative and quantitative traitdata[J].The Crop Journal,2016,4(5):417.
[9] 金爽,谭金燕,白秀云,等.固载纳豆菌发酵鹰嘴豆产品的感官评价[J].粮油食品科技,2016,24(4):86.
[10]高瑞雄,闫巧珍,邢颖,等.冷榨核桃粕固态发酵制备纳豆激酶[J].中国食品学报,2018,18(3):103.
[11]杨明俊,杨晓彤,冯慧琴,等.两种纳豆激酶活性测定方法对比及相关性分析[J].食品研究与开发,2008,29(2):137.
[12]朱宇刚.一株高产纳豆激酶的纳豆枯草芽孢杆菌的研究[D].合肥:安徽农业大学,2011.
[13]张俊杰,郭晨,刘毅飞,等.鹰嘴豆纳豆优良发酵菌株的筛选与鉴定[J].中国酿造,2018,37(7):88.
[14]赵红霞,刘超.高产纳豆菌液体发酵条件研究[J].食品研究与开发,2011,32(1):109.
[15]王瑞珍,蔡天娇,徐亚飞,等.双菌株联合固态发酵冷榨核桃粕提高产品纳豆激酶活性的研究[J].食品工业科技,2017(16):118.
[16]孙军德,陈思,杨璐,等.双菌株混合发酵纳豆的条件优化[J].沈阳农业大学学报,2016,47(1) :35.
[17]张超凤,严美婷,杜霞,等.响应面优化纳豆激酶液态发酵条件[J].中国生物制品学杂志,2017(6):658.
[18]古亚楠.纳豆激酶发酵工艺条件优化及其在消化液中的活性研究[D].郑州:河南工业大学,2012.
[19]上海市酿造科学研究所.蛋白酶活力测定法:SB/T 10317—1999[S].上海:国家国内贸易局,1999.

