同时检测茶叶中5种儿茶素和咖啡因的QuEChERS-HPLC方法研究
严开芹 曾小平 向君毅
摘 要:建立了一种同时测定茶叶中5种儿茶素儿茶素(C)、表儿茶素(EC)、表没食子儿茶素(EGC)、表没食子儿茶素没食子酸酯(EGCG)以及表儿茶素没食子酸酯(ECG)和咖啡因的QuEChERS-HPLC方法。茶叶样品用70%甲醇水在70 ℃条件下水浴提取,混合使用25 mg乙二胺-N-丙基硅烷(PSA)、200 mg十八烷基硅烷(C18)作为吸附剂,净化2 min;净化液过膜后采用Thermo Fisher Syncronis C18色谱柱(250 mm×4.6 mm,5 μm)分离。以甲醇-1.25%乙酸水溶液为流动相,梯度洗脱,流速为1 mL/min,测定波长278 nm。结果表明,5种儿茶素和咖啡因在各自相应的浓度范围内具有良好的线性关系(相关系数0.999 0~0.999 8),样品加标回收率为93.87%~107.37%,相对标准偏差为1.45%~11.85%。该方法操作简便、快速、准确,可满足茶叶中儿茶素和咖啡因的分析要求。
关键词:QuEChERS;高效液相色谱法;儿茶素;咖啡因
1 引言
茶多酚和生物碱是茶叶中重要的活性成分,儿茶素是茶多酚的主要成分,占茶多酚含量的60%~80%,也是主要的药理活性物质,具有抗氧化、抗肿瘤、降血糖等作用[1-4],其中儿茶素(C)、表儿茶素(EC)、表没食子儿茶素(EGC)、表没食子儿茶素没食子酸酯(EGCG)与表儿茶素没食子酸酯(ECG)是影响茶叶品质和质量的重要指标,国家标准[5]对绿茶中以上5种儿茶素的含量进行了规定。咖啡因是生物碱的主要组成成分,是茶叶重要的风味物质和生理活性成分,具有消除疲劳、兴奋神经的作用[6],但人体过量摄入会产生不良影响[7],同时,咖啡因也是影响茶叶品质的重要指标,因而建立一种快速测定茶叶中儿茶素类和咖啡因的检测方法很有必要。
目前,国家标准和文献报道的儿茶素类和咖啡因的检测方法主要为高效液相色谱法(HPLC)[8-12],但国家标准和一些文献报道的方法存在流动相复杂[13]、分析时间长和缺少样品净化步骤[14-15]等问题。而茶叶样品基质复杂,除茶多酚和生物碱外,还含有色素、蜡质等成分,这些成分不仅影响儿茶素类和咖啡因的检测效果,还容易在色谱柱上残留,造成柱压升高、色谱柱污染、柱效降低等问题,影响仪器的后续使用;有些文献报道了基于固相萃取的前处理净化方法[16],但该前处理方法存在商品化小柱价格昂贵、处理时间长、不能批量处理等缺点。而QuEChERS作为一种较新的前处理方法,具有快速、简单、便宜、有效、可靠和安全的特点,其原理是利用吸附剂与基质中的杂质的相互作用,吸附杂质从而达到除杂净化的目的。本文针对国家标准和文献中检测儿茶素和咖啡因方法存在的缺陷,首次采用QuEChERS方法结合HPLC,建立了茶叶中儿茶素类和咖啡因的检测方法,此方法具有操作简单、准确性高、流动相系统简单与分析时间短的优点,并能满足分析的要求,能够为茶叶的等级评价和质量控制提供更准确的科学数据。
2 材料与方法
2.1 材料与仪器
兒茶素(C)、表儿茶素(EC)、表没食子儿茶素(EGC)、表没食子儿茶素没 食子酸酯(EGCG)、表儿茶素没食子酸酯(ECG)与咖啡碱(CAF)购于中国广州分析测试中心(规格均为20 mg/盒);甲醇(色谱纯),迪马公司;乙二胺-N-丙基硅氧烷(PSA)、十八烷基硅烷(C18)、氧化铝(Al2O3)、石墨化炭黑(GCB),Agela Technologies公司;其他试剂均为分析纯。
高效液相色谱仪(配有PDA检测器)、Syncronis C18色谱柱(4.6 mm
×250 mm,5 μm),赛默飞公司;恒温水浴锅,上海精宏;离心机,长沙湘智。
2.2 实验方法
2.2.1 样品前处理
称取0.2 g(精确到0.000 1 g)均匀磨碎的茶叶样品试样于50 mL离心管中,加入70 ℃下预热过的70%甲醇溶液5 mL,用玻璃棒充分搅拌均匀湿润,立即移入70 ℃水浴中浸提10 min(隔5 min搅拌一次),浸提后冷却至室温,转入离心机,在3 500 r/min转速下离心10 min[17],将上清液转移至50 mL容量瓶中。残渣用5 mL的70%甲醇水溶液提取一次,重复上述操作,合并提取液,于容量瓶中定容至50 mL,摇匀。取上清液5 mL置于另一50 mL离心管中,加入吸附剂PSA 25 mg和C18 200 mg,涡旋2 min,3 500 r/min离心5 min,上清液经0.22 μm滤膜过滤待上机。
2.2.2 色谱条件
色谱柱:Syncronis C18(4.6 mm×250 mm,5 μm);流动相:甲醇-1.25%乙酸溶液;梯度洗脱程序(见表1);流速:1 mL/min;柱温:35 ℃;检测波长:278 nm;进样量:10 μL。
2.2.3 提取和净化条件的优化
通过预实验选取对儿茶素类和咖啡因含量影响最大的4个因素做正交实验,分别为:吸附剂的种类、含量、水浴温度与提取溶剂质量分数。设计正交试验,以儿茶素类和咖啡因含量为指标,采用L9(34),找出最佳的提取净化条件。因素水平表见表2。
2.2.4 方法学考察
在上述优化后的最佳实验条件下进行方法学验证,包括线性关系、方法检出限、方法定量限、加标回收率、精密度。
回收率的计算公式如式(1)。
(1)
式(1)中:Z—回收率(%);X—样品中儿茶素类和咖啡因的含量(mg/kg);M—空白样品中儿茶素类和咖啡因的含量(mg/kg);Y—样品的加标量(mg/kg)。
样品中儿茶素类和咖啡因含量的计算公式见式(2)。
(2)
式(2)中:C—儿茶素类和咖啡因的含量,%;ρ—样品中儿茶素类和咖啡因的浓度,μg/mL;m—样品的称样量,g。
精密度的计算公式见式(3)(4)。
(3)
CV=(SD/X)×100(4)
式(3)(4)中:SD—标准偏差(%);X—样品中儿茶素类和咖啡碱含量的平均值;N—测量次数;CV—相对标准偏差(%)。
3 结果与分析
3.1 提取和净化条件的优化
3.1.1 提取溶剂的选择
分别选取甲醇、乙醇、水对茶叶中的儿茶素类组分和咖啡因进行提取,结果发现,用纯水作提取溶剂时,样品提取不充分,儿茶素类组分和咖啡因提取含量仅为甲醇提取含量的60%;用乙醇作提取溶剂时,样品提取液中有杂质干扰,目标峰峰型不呈正态分布;用甲醇作提取溶剂时,样品中儿茶素类组分和咖啡因提取率更高,且各组分峰型均呈正态分布。
3.1.2 提取溶剂质量分数的选择
分别选取20%甲醇、40%甲醇、60%甲醇、80%甲醇与100%甲醇对样品中的儿茶素类组分和咖啡因进行提取,结果发现,在甲醇质量分数为20%~80%时,样品中儿茶素类和咖啡因的含量随着甲醇质量分数的增加而增加,当甲醇的质量分数增加到100%时,样品中儿茶素类和咖啡因的含量有降低趋势。这可能是因为相对于纯甲醇溶剂,儿茶素和咖啡因更容易溶于甲醇水溶液。
3.1.3 提取溶剂的pH值的选择
分别选取pH为2.5的80%甲醇、pH为4的80%甲醇、pH为6的80%甲醇与pH为7.5的80%甲醇对样品中的儿茶素类组分和咖啡因进行提取,结果发现,当pH在4~6时,样品中的5种儿茶素类和咖啡因较稳定,当pH<4时,EGC含量降低较多,pH>6时,EGC和EGCG含量降低明显。
3.1.4 净化剂种类和含量的选择
分别选取PSA、C18、Al2O3、GCB 4种净化剂,在4个用量水平(50、100、200 mg与400 mg)下对样品进行净化,结果发现,用GCB和Al2O3净化时,随着用量的增加,对5种儿茶
素和咖啡因的吸附均越来越强,5种儿茶素和咖啡因提取量下降明显。C18对5种儿茶素和咖啡因的吸附作用较弱,当C18含量为200 mg时,净化液颜色较浅,C18含量小于200 mg时,净化液颜色较深;PSA在50 mg时对5种儿茶素和咖啡因的吸附作用较低,且随着PSA含量的增加对5种儿茶素和咖啡因的吸附作用有递增趋势,见图1;因此本实验选取C18和PSA作为净化剂。
3.1.5 提取条件和净化剂用量的优化
采用正交实验对茶叶中5种儿茶素和咖啡因的提取条件和净化剂用量进行优化。设计四因素三水平的正交试验L9(34),以5种儿茶素和咖啡因的平均含量为考察指标,结果见表2。
由R值大小可知,影响5种儿茶素和咖啡因回收率的因素顺序为A(甲醇质量分数)>C(PSA)>B(pH)>D(C18)。选择各因素k值最大的水平,确定出茶叶最佳的提取和凈化条件为A3B1C1D2,即甲醇质量分数为80%,pH值为4,PSA为25 mg,C18为200 mg,此时平均回收率为98.31%。
3.2 流动相的选择
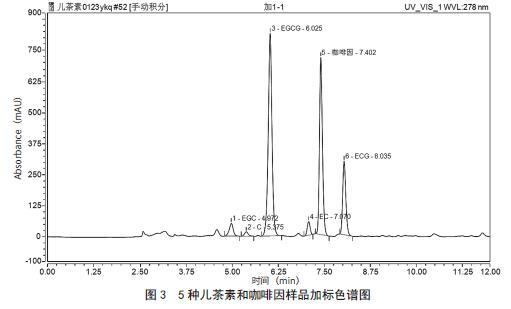
采用梯度洗脱分别比较了国家标准流动相[18]、甲醇-水、甲醇-1.25%乙酸铵溶液作为流动相对6种目标物的分离效果,结果发现,采用国家标准流动相[19]、甲醇-水时,6种目标物不能完全分离,且有些物质峰缺失,不能进行有效洗脱;用甲醇-1.25%乙酸获得的色谱图见图2。从图2可以看出,5种儿茶素和咖啡因的分离效果好,分析时间短,各物质峰分离度均大于1.5,且峰型较好。
3.3 方法学考察
3.3.1 线性关系和方法检出限
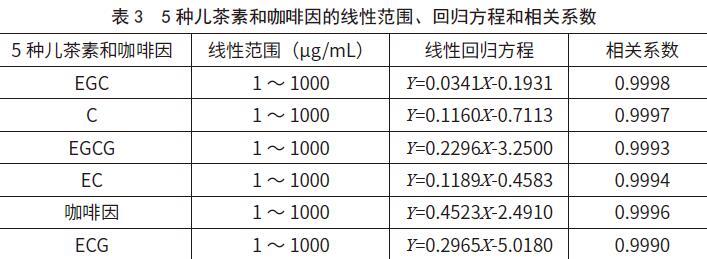
对5种儿茶素和咖啡因标准品进行逐级稀释,配制成浓度为1、5、20、50、100、200、500、800 μg/mL与1 000 μg/mL的工作液,以峰面积为纵坐标,浓度为横坐标,计算回归方程和相关系数。由表3可知,5种儿茶素和咖啡因的线性现性相关系数均达0.999。
3.3.2 加标回收率、相对标准偏差
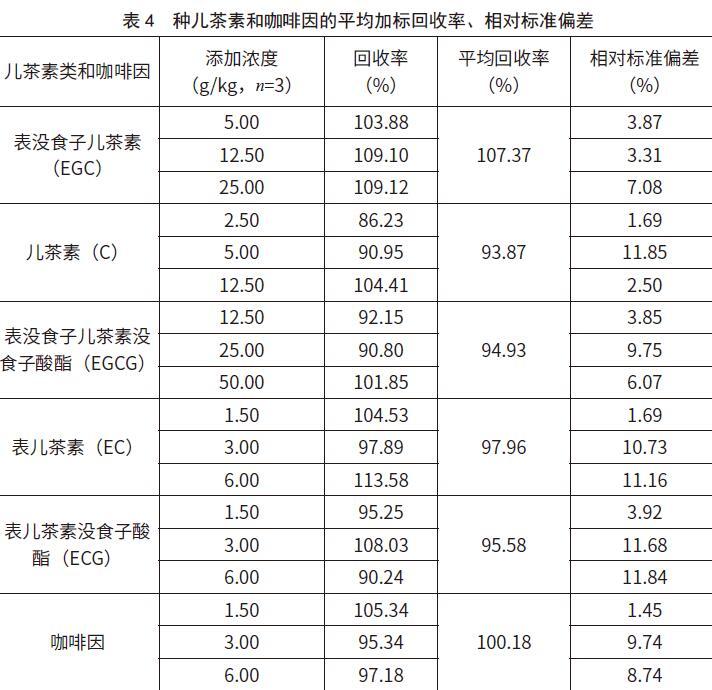
在0.2 g茶叶样品中添加适量5种儿茶素和咖啡因标准溶液,每个添加量设置3个平行,进行加标回收率实验、回收率、相对标准偏差,结果见图3和表4 。
结果表明,3份平行样品中,5种儿茶素和咖啡因的平均回收率均大于93%;相对标准偏差在1.45%~1.85%。
4 实际样品分析
采用本方法对市售的茶叶(红茶和绿茶)中的5种儿茶素和咖啡因进行了检测,结果见表5。
从表5可看出,红茶和绿茶均检出5种儿茶素和咖啡因,其中两类茶叶咖啡因含量相当,红茶在发酵过程中儿茶素发生氧化,5种儿茶素总量,尤其是EGCG明显低于红茶;此外同类品种不同等级的茶叶因加工工工艺不同,5种儿茶素含量也有较大差异。
5 结论
建立了茶叶中5种儿茶素(C、EC、EGC、EGCG、ECG)和咖啡因的QuEChERS-HPLC检测方法,相比于国家标准方法,该方法中采用的流动相更简单、分析时间更短,而且仅需12 min即可完成对样品的分析,且分离度更好。该方法通过提高甲醇的质量分数从而提高了儿茶素的含量,通过控制提取液pH,增加了儿茶素组份的稳定性;与文献报道的商品化固相萃取前处理净化相比,QuEChERS方法可批量处理样品、节约人力、且成本更低,优势明显。因此本文所建立的方法具有快速、简单、适用于批量处理及实用性强等特点,为监控茶叶质量和为消费者合理选择提供基础数据。
参考文献
[1]杨新,陈莉,卢红梅,等.茶多酚提取与纯化方法及其功能活性研究进展[J].食品工业科技,2019,40(5):322-328,332.
[2]包蓉,谷欣莹,陈佳.茶多酚提取纯化及其功能特性研究进展[J].安徽农学通报,2018,24(10):109-110,156.
[3]李军,辛勤,杨雁.绿茶多酚药理作用的研究进展[J].中国热带医学,2014,
14(1):128-130.
[4]张晓梦,倪艳,李先荣.茶多酚的药理作用研究进展[J].药物评价研究,2013,36(2):157-160.
[5]中华人民共和国国家质量监督检验检疫总局.GB/T 14456.3-2016 绿茶 第3部分:中小叶种绿茶[S].北京:中国标准出版社.
[6]赵卉,杜晓.低咖啡碱茶的研究进展[J].华中农业大学学报,2008
(4):564-568.
[7] Nawrot P, Jordan S, Eastwood J, Rotstein J, et al. Effects of caffeine on human health[J]. Food Additives & Contaminants: Part A,2003,20(1).
[8][13][17][18][19]国家市场监督管理总局.GB/T 8313-2018 茶叶中茶多酚和儿茶素类含量的检测方法[S].北京:中国标准出版社,2018.
[9]段联勃,李娟,徐杰,等.超高效液相色谱-串联质谱测定武夷岩茶中咖啡碱、茶氨酸和儿茶素[J].中国茶叶,2019,41(7):38-42.
[10]支红峰,杨璐,胡中豪,等.超高效液相色谱同时测定绿茶中10种活性物质[J].食品工業,2019,40(2):306-309.
[11]Rahim A A, Nofrizal S, Saad B. Rapid tea catechins and caffeine determination by HPLC using microwave-assisted extraction and silica monolithic column[J]. Food Chemistry,2014(147):262-268.
[12] Dilanka C, Preethi S. Simple isocratic method for simultaneous determination of caffeine and catechins in tea products by HPLC[J]. SpringerPlus,2016,5(1):970.
[14]高俊,夏涛,朱博,等.HPLC-PDA对茶叶中茶氨酸、儿茶素和生物碱的同时分离检测研究[J].安徽农业大学学报,2008(3):324-328.
[15]刘臣,张雷,刘婧,等.反相高效液相色谱法同时测定碧螺春茶中4种儿茶素类化合物及咖啡因含量[J].安徽农业科学,2012,40(12):7425-7427.
[16]朱媛,施梅,陈昌云.固相萃取-高效液相色谱法测定茶叶中儿茶素[J].南京晓庄学院学报,2013,29(3):46-48,60.

