小粒性菌核病菌侵染桑椹表达谱分析*
殷培峰 孙 骁 步显勇 向玉勇 柴新义 蔡金鑫
1. 滁州学院生物与食品工程学院,安徽 滁州 239000; 2. 安徽盼盼食品有限公司,安徽 滁州 239000
果桑具有高经济价值和开发潜力,其果实味甜汁多,营养价值丰富,在我国栽植面积不断扩大,但桑椹菌核病的发生率也大幅度上升。桑椹菌核发病原因在于菌核萌发产生子实体释放子囊抱子侵染花序,孢子萌发后在子房内大量繁殖,导致桑椹失去食用价值[1]。感病后期,菌丝在各种因素诱导下逐步形成菌核,并以菌核形式在土中越冬,第2年3月下旬至4月上中旬,气温在20℃左右,湿度在85%以上菌核继续萌发产生子囊盘,释放孢子,继续为害[2]。桑椹菌核病病原菌多样,以桑实杯盘菌(Ciboria shiraiana)、肉阜状杯盘菌(Ciboria carunculoides)、核地杖菌(Scleromitrula shiraiana)为主[3],核盘菌(Sclerotinia sclerotiorum),Scleromitrula sp.和Synciboria ningpoensis也被报道对桑花序具有侵染能力,导致桑椹发病[4-5]。菌核病致病性在其它农作物如油菜报道较多,致病菌核盘菌菌丝代谢产生的多聚半乳糖醛酸酶(Polygalacturonase)和草酸(Oxalic acid)是关键致病因子,另外,果胶酶(Pectinase)、胶质酶(Cutinase enzyme)、几丁质酶(Chitinase)和一些胞外酶(Ectoenzyme)等也在致病过程中发挥了重要作用,但在桑椹菌核病病原菌侵染过程中的主要致病基因报道较少。
现阶段,对桑椹菌核病防治主要通过喷洒抗真菌类农药[6],但易产生农药残留。为进行生物防治,减少农药使用[7],探究病原菌致病相关基因种类及数量,及这些基因参与过程代谢途径[8],是菌核病防治工作研究的重点。高通量测序技术可从整体水平上获得所有转录本的序列信息和表达信息,已经被越来越广泛地应用于各类致病菌的致病机理研究。本研究对小粒性菌核病(mulberry sorosus parvulling sclerote disease)病原菌感病初期转录组进行测序,并对这些基因进行生物信息学分析,获得致病基因种类数量,基因参与主要代谢通路,为通过基因工程对菌核病进行防治提供理论基础。
1 材料与方法
1.1 植物材料
实验材料为滁州学院果桑种植基地果桑“大10”。人工接种收集的小粒性菌核病孢子,采集第3天发病病果,用无菌水冲洗,剔除外部桑椹果肉,获取病原菌菌丝,液氮-80 ℃下速冻保存,在南京普东兴生物科技有限公司提取总RNA,进行测序分析。
1.2 样本表达谱测序及测序样本信息注释
以 TRIzol 法提取总RNA,采用Qubit 2.0荧光计进行核酸精确定量,NanoDrop检测其浓度,富集纯化 mRNA,反转录合成双链 cDNA,构建测序文库。使用Ion ProtonTM高通量测序仪测序,采用FastQC软件对原始测序数据进行质控,过滤、去除低质量碱基较多的reads和测序接头[9]。过滤后的reads比对到NR数据库,获取测序信息。E-value值小于10~5为可信值,获取reads信息,拼接获得Unigenes及相对表达水平(RPKM)[10],并对基因功能进行注释。
1.3 基因NR数据库比对分析及GO和KEEY分析
利用blast进行NR数据库物种分布比对分析,统计blast结果中每个能比对上的物种所对应的基因数目。根据注释信息,对基因进行GO注释,得到每个基因的GO注释,包括细胞组成、分子功能及生物过程,探讨真菌的基因功能特征。使用KEGG数据库对基因进行KEGG注释,了解基因在生物学上的代谢通路及功能。通过对基因功能进行注释分析,获取感病过程中致病基因。
2 结果与分析
2.1 样本测序基本信息
RNA提取结果显示,样本浓度大于200ng/μl的最低要求;NanoDrop检测OD260/280为2.084,RIN值为1.6,28S:18S值为8.1,所提取的样本满足建库要求。经测序获得reads数3551251个,对reads进行拼接获得Unigene14446个,平均长度1093,RPKM值平均75,RPKM值小于5的Unigene数为11398个:RPKM值介于50~100基因数量为1556个,大于100基因数量为1491个,其中有167个Unigene的RPKM值超过1000。将测序结果与NR数据库blast比对,能比对上的Unigene数量为14357个,按照物种统计,包含5种真菌,数目最多的是核盘菌(Sclerotinia sclerotiorum),其次为富克葡萄孢盘菌(Botryotinia fuckeliana)。其中核盘菌和雪腐大粒菌核病(Sclerotinia borealis)为核盘菌科核盘菌属真菌,富克葡萄孢盘菌为核盘菌科葡萄孢盘菌属真菌,杯霉科盘二孢属杨盘二孢菌(Marssonina brunnea)1个,一种产抗真菌生素相关丝状真菌(Glarea lozoyensis)。核盘菌检测到基因7292个,富克葡萄孢盘菌基因5271个,雪腐大粒菌核病基因738个,杨盘二孢菌基因266个。

表1 Unigene的NR数据库比对分析
2.2 Ungene GO分类
对Unigene进行GO注释,在细胞组成(cellular component)、基因分子功能(molecular function)、生物过程(Biological process)分别获得8,4,19个注释条目(class)。其中Unigene数量最多的是生物学过程,注释到的Unigene数最少的是分子功能。生物学过程包括组织结构形成(Anatomical structure formation),生物调节(Biological regulation),发育进程(Developmental process),定殖(Establishment of localization),色素淀积(pigmentation)等,分子功能主要包括结合(binding),催化(catalytic),分子结构(structural molecule)和运输(transporter)。
2.3 Unigenes代谢通路分析
在生物体中,不同基因相互协调行使其生物学功能,基于通路的分析,有助于进一步的探索基因的生物学功能及基因调控机制的研究,KEGG数据库以pathway为单位分析基因代谢通路及功能。通过KEGG注释,共有1491个Unigenes被注释,相关代谢通路有208个,Unigenes数较多的有代谢通路,次生代谢产物生物合成,微生物代谢和糖酵解等。

表2 KEGG注释比例最多的前10个代谢通路
2.4 主要致病基因筛选
菌核病在侵染过程中分泌各种酶类及分泌草酸对植物细胞壁及细胞内物质进行降解,包括纤维素,果胶,几丁质,淀粉,蛋白质[11]。通过分析比对,筛选出小粒性菌核病菌丝侵染过程中致病相关基因,其中cAMP依赖性蛋白激酶(Camp-dependent protein kinase)类4个,多聚半乳糖醛酸酶(Ppolygalacturonase)类6个,几丁质酶(Chitinase)类6个,酸性蛋白(Acid protease)类3个:糖苷酶(Glucosidase)类8个,纤维二糖脱氢酶(Cellobiose dehydrogenase)类3个,胶质酶(Cutinase)类4个,漆酶(Laccase)类1个,淀粉酶(Amylase)类4个。同时发现草酸生成关键基因草酰乙酸乙基水解酶(Oxaloacetate acetylhydrolase)表达。
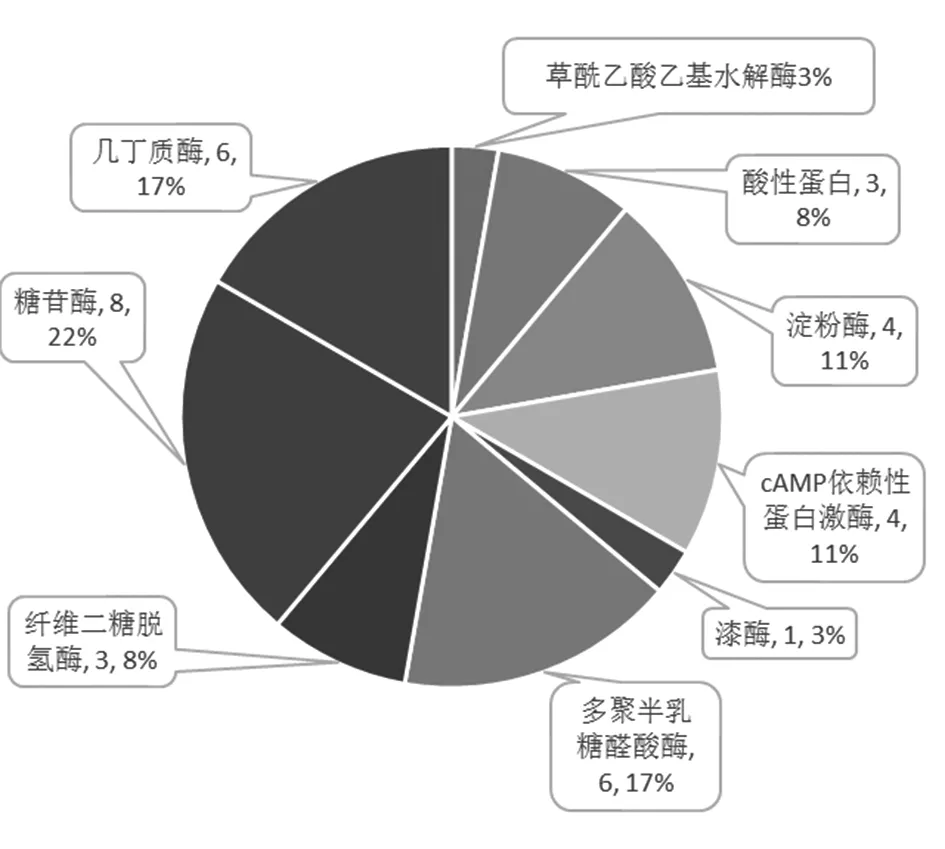
图2 核盘菌主要致病基因数量及占比
3 讨 论
转录组测序技术可对样本进行表达谱序列分析,高效的挖掘转录本有用信息。本研究通过对侵染期小粒性菌核病菌丝体总转录本的表达注释,探明该致病菌的主要致病基因及代谢途径。发现小粒性菌核病菌在侵染阶段蛋白功能与结合、催化、分子结构和运输有关。富集到代谢通路208个,主要参与生化合成和次生产物代谢等生物学通路。为开展菌核病菌致病基因克隆,基因功能验证及生物防治提供生物信息学基础。
核盘菌侵染过程中表达产物多聚半乳糖酸酸酶(Polygalacturonase, PGs)[12]和草酸(Oxalic acid,OA)[13]在核盘菌科真菌的致病过程中起着关键作用。草酸能够螯合钙离子来降低果胶聚合物的稳定性,从而增加病原菌产生的果胶酶进入寄主的可能性以及寄主对果胶酶的敏感性,草酸还能够抑制寄主植物的氧爆发和多酚氧化酶的活性。多聚半乳糖酸酸酶在核盘菌类病原真菌侵染过程中发挥着定植和致病因子的作用。此外草酸和多聚半乳糖醛酸酶存在着协同作用,核盘菌在侵染植物时产生的草酸能够维持较低的pH环境,有利于包括聚半乳糖酸酸酶在内的水解酶活性的发挥[14]。通过表达谱分析发现小粒性菌核病菌在侵染过程中多聚半乳糖醛酸酶和生成草酸相关关键蛋白--草酰乙酸乙基水解酶都有表达,说明小粒性菌核病菌致病过程与其他核盘菌相似。同时也发现漆酶、蛋白酶、果胶酶、糖苷酶、纤维素酶和淀粉酶等致病因子[15]。在这些酶作用下,可使桑椹子房内果胶质完全分解,降解细胞壁中的多聚糖结构,迅速消解组织中胶层,引起细胞电解质外渗、质壁分离和软腐。以上致病基因表达可使小粒性菌核病菌更容易侵染桑组织器官,导致桑椹腐败,失去食用价值。
通过GO功能富集分析和代谢通路显著性分析,发现小粒性菌核病菌在侵染初期次生代谢产物生物合成,氨基酸生物合成,糖酵解/糖异生途径等显著富集,并伴随细胞定殖,色素沉积等生理过程,研究结果将为今后进一步探索其侵染分子机制提供基础资料。

