水提法同步提取分离香菇中蛋白质和多糖的工艺研究
胡丽玲 刘世柱 吴志君 周晓云 陈雯雯
水提法同步提取分离香菇中蛋白质和多糖的工艺研究
胡丽玲 刘世柱 吴志君 周晓云 陈雯雯
(浙江方格药业有限公司,浙江 庆元 323800)
通过水提法同步提取分离香菇中的蛋白质和多糖,采用单因素实验研究料液比、提取温度、提取时间与蛋白质和多糖提取率的关系,并通过正交实验优化工艺条件。结果为,影响蛋白质提取率的主次因素为提取温度>料液比>提取时间;影响多糖提取率的主次因素为料液比>提取温度>提取时间。综合分析得到提取的最佳工艺组合为料液比20、提取温度100 ℃、提取时间3.5 h(二次提取)。该组合下蛋白质提取率为6.90%,多糖提取率达38.50%。
香菇;蛋白质;多糖;提取率;影响因素
香菇,又名花菇、冬菇等,属担子菌纲伞菌目口蘑科香菇属,是世界上第二大食用菌品种[1]。其味道鲜美,含有丰富的多糖和蛋白质,药用价值高,是一种集营养、保健和药用价值于一体的药食两用真菌[2]。现代医学研究表明,香菇多糖具有抗病毒[3]、抗肿瘤[4]、抗疲劳[5]等多方面的生物活性,可提高机体免疫力,对维护人类健康和预防疾病有重大意义[6, 7]。
目前国内对香菇多糖的研究较多,对香菇蛋白质提取研究较少。本研究通过水提法,以提取时间、料液比、提取温度为考察因素,提取分离香菇中蛋白质和多糖,采用正交试验法优化提取条件,以利于充分利用香菇原料资源,促进深加工,提高产品附加值。
1 材料与方法
1.1 材料与试剂
香菇干品来源于浙江庆元,粉碎过80目筛。试剂包括盐酸、氢氧化钠、苯酚、硫酸、无水乙醇、蒸馏水、D-无水葡萄糖保准品、牛血清蛋白标准品和考马斯亮蓝G-250等。仪器与设备:粉碎机、离心机、旋转蒸发仪、紫外分光光度计和烘箱等。
1.2 实验方法
(1)水提法提取流程。称取一定量的香菇粉末,加入一定量蒸馏水,在一定温度下水提,3 000 r/min,离心10 min,取上清液,沉渣加入一定量的纯化水进行二次提取,3 000 r/min离心10 min,弃去沉渣,合并滤液。
(2)蛋白质等电点确定。将上清液分为若干等份,配制1 mol/L盐酸溶液,25 ℃下调pH至酸性,蛋白质沉淀完全后,3 000 r/min离心10 min,上清液采用考马斯亮蓝法检测蛋白质残留率,残留率最低的为蛋白质等电点。
(3)蛋白质检测。沉淀加入一定量的水溶解,于65 ℃下烘干称重,检测蛋白质提取率。采用考马斯亮蓝法[8],精确称取100 mg的牛血清蛋白标准品,用蒸馏水定容至100 mL,得到1 mg/ mL的牛血清蛋白标准品溶液。用移液枪分别吸取0,0.01 mL,0.02 mL,0.04 mL,0.06 mL,0.08 mL,0.10 mL于10 mL具塞试管中,加水补至0.10 mL,摇匀后再分别加入考马斯亮蓝G-250试剂5 mL,摇匀,放置2分钟于595 nm下检测吸光度值,绘制标准曲线。
(4)多糖检测。合并蛋白质沉淀后的上清液,25 ℃下用1 mol/L NaOH调节pH至中性,65~70 ℃下旋蒸浓缩,加入4倍量乙醇进行沉淀,3 000 r/min离心10 min,沉淀加入一定量水溶解,65 ℃下烘干称重,检测多糖提取率。采用苯酚-硫酸法[9],精确称取10 mg D-无水葡萄糖标准品,用蒸馏水定容至100 mL,得到0.1 mg/mL的葡萄糖标准品溶液。分别吸取0、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL于25 mL具塞试管中,加水补至1.0 mL,摇匀,加1 mL 5%苯酚溶液,摇匀,加5 mL 硫酸,摇匀,静置10 min。待充分混合,30 ℃下水浴20 min,冷却至室温,于490 nm下检测吸光度值,绘制标准曲线。
(5)单因素实验。在单因素实验中,分别考察料液比、提取温度、提取时间对蛋白质和多糖提取率的影响。
(6)正交实验。在单因素实验的基础上,选取3个单因素实验中的最佳实验条件,采用L9(33)正交设计对蛋白质和多糖提取条件进行优化。
2 结果与分析
2.1 蛋白质等电点确定
用1 mol/L HCl调节pH至3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1,静置过夜沉淀后,离心,上清液采用考马斯亮蓝法检测蛋白质含量,结果见图1。当pH=3.7时,上清液中蛋白质残留量最低,说明沉淀的蛋白质含量最多;pH在3.4~3.6之间,上清液蛋白质残留量相差不大;pH在3.8~4.2之间,上清液蛋白质残留量呈上升趋势。因此选择pH 3.7为蛋白质的等电点。
图1 不同pH条件下的上清液蛋白质含量
2.2 单因素实验结果
(1)料液比与蛋白质和多糖提取率的关系。实验结果(表1)表明,在提取温度80 ℃,提取时间3.5 h的条件下,随料液比增大,蛋白质和多糖提取率呈先上升后下降趋势。料液比为20时,提取率最大,蛋白质和多糖提取率分别为5.63%和34.86%;料液比达到30时,提取率最低,分别为5.46%和33.91%。因此,正交试验选取料液比范围以20~25为宜。

表1 不同料液比下的蛋白质和多糖提取率
(2)温度与蛋白质和多糖提取率的关系。实验结果(表2)表明,在料液比为20,提取时间为3.5 h的条件下,随着提取温度的升高,蛋白质和多糖提取率呈现不断上升趋势,90 ℃时蛋白质和多糖的提取率分别6.53%和35.76%;100 ℃条件下多糖提取率略有下降,但差别不明显。综合考虑,正交试验选取提取温度的范围以80~100 ℃为宜。
(3)提取时间与蛋白质和多糖提取率的关系。

表2 不同温度下蛋白质和多糖的提取率
实验结果(表3)表明,在料液比为20,提取温度为90 ℃条件下,随着提取时间的增加,蛋白质和多糖提取率均呈上升趋势,提取时间4.5 h时,蛋白质和多糖提取率均达到最大值,分别为6.58%和36.45%。综合考虑,正交试验选取提取时间范围以3.5~4.5 h为宜。

表3 不同提取时间的蛋白质和多糖的提取率
2.3 正交试验结果与分析
通过分析可知,对于蛋白质提取,提取温度(B)对蛋白质提取率的效果最强,为主要因素,提取时间(C)对提取效果最弱。实验表明,影响蛋白质提取率的主次因素为B>A>C,提取的最优水平组合为B3A3C3(表4、表5)。
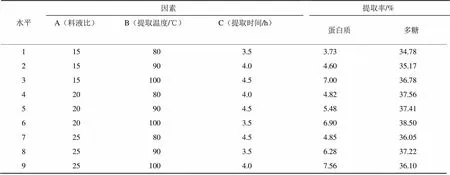
表4 正交试验结果
对于多糖提取,料液比(A)的极差最大,对提取的效果最强,为主要因素,提取时间(C)对多糖提取的效果最弱。实验表明,影响多糖提取率的主次因素为A>B>C,多糖提取的最优水平组合为A2B3C1。
综合分析,两者的最佳工艺组合为A2B3C1,即料液比为20、提取温度为100 ℃、提取时间为3.5 h,该组合下蛋白质提取率达6.90%,多糖提取率达38.50%。
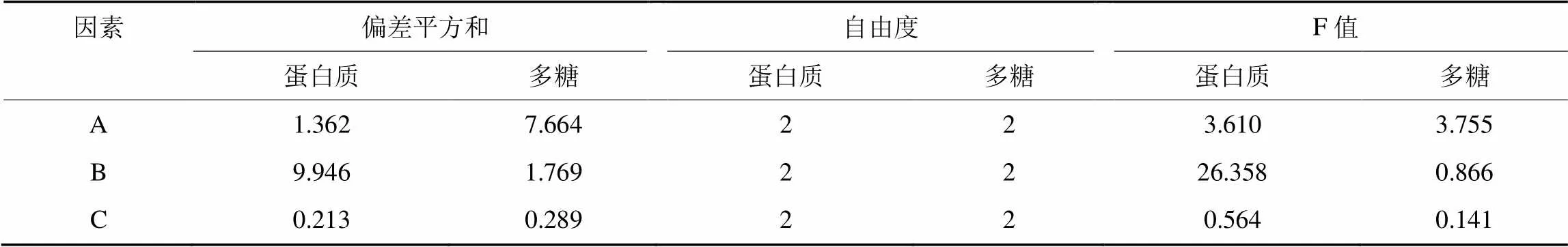
表5 蛋白质和多糖提取率极差分析
3 结 论
本实验通过水提法同步提取分离香菇中蛋白质和多糖,采用单因素实验研究料液比、提取温度、提取时间对蛋白质和多糖提取率的影响,并通过正交实验优化工艺条件。结果为影响蛋白质提取率的主次因素为提取温度>料液比>提取时间;影响多糖提取率的主次因素为料液比>提取温度>提取时间。综合分析得两者的最佳工艺组合为料液比20、提取温度100 ℃、提取时间3.5 h,在此条件下蛋白质提取率达6.90%,多糖提取率达38.50%。该工艺操作简便,成本低廉,蛋白质和多糖提取效果显著,能为香菇蛋白质和多糖工业化生产提供科学依据。
[1] 李月梅. 香菇的研究现状及发展前景[J]. 微生物学报, 2005, 32(4): 149-152.
[2] 林楠, 钟耀广, 王淑琴, 等. 超高压提取香菇多糖的研究[J]. 现代食品科技, 2010,26(9): 991-993.
[3] 张福明, 张淑琴. 香菇多糖对流感病毒的抑制作用[J].长春中医药大学学报, 2006, 22(4): 11-12.
[4] 袁静, 王平全. 香菇多糖抗肿瘤作用的研究进展[J]. 中国药房, 1999, 10(5): 233-234.
[5] 杨娟, 吴谋成, 张声华, 等. 香菇蛋白多糖抗疲劳作用研究[J]. 营养学报, 2001, 23(4): 350-353.
[6] 边洪荣, 李小娜, 潘海宇. 香菇有效成分提取分离及分析方法研究进展[J]. 中草药, 2002(9):附1-2.
[7] 刘春如, 易诚. 香菇营养价值和药用价值[J]. 中国林副特产, 2002(1): 52-53.
[8] 陈贵堂, 王丽敏, 姚舒愉, 等. 灰树花子实体多糖和蛋白的同步提取工艺研究[J]. 食品科技, 2014, 39(7): 248-251, 257.
[9] 于村, 丁钢强, 俞莎, 等. 香菇多糖测定的方法学研究[J]. 中国公共卫生, 2000(3): 53-54.
胡丽玲(1992—),女,学士,主要从事医药食品科研工作。
S646
B
2095-0934(2019)05-316-04

