水稻磷高效基因OsPHR2转化小麦及转基因植株的耐低肥能力分析
华 夏,方宇辉,高 崇,韩留鹏,胡 琳,李 艳
(河南省农业科学院 小麦研究所,河南 郑州 450002)
磷素是植物生长和发育所必需的大量元素之一,它不仅是植物体内许多重要化合物的组分,而且还以多种途径参与各种代谢过程,在农作物的生长发育中发挥着重要作用。目前,为了提高农作物的产量,磷肥的施用量逐年增加。然而,土壤中的磷素和施入土壤中的磷素80%被固定,变为难于被植物吸收的难溶态和有机态磷[1-2]。一般情况下,植物以吸收无机磷为主,而无机磷中可被直接吸收利用的有效磷含量占总无机磷含量的比例低于0.5%[3],导致磷肥当季利用率低下。磷肥的过度施用不但增加了农业生产成本,还给生态环境带来了众多隐患。小麦是我国重要的粮食作物,在生产中普遍面临着土壤有效磷不足的问题。因此,发掘耐低磷胁迫基因,利用转基因技术创制磷高效吸收利用的小麦新种质,进而快速选育出磷高效小麦新品种,对于充分利用土壤磷素资源、减少肥料浪费、防止环境污染和促进小麦生产的可持续发展具有重要意义。
目前,许多耐低磷胁迫转录因子已从拟南芥、水稻等植物中克隆出来。PHR1(Phosphate starvation response 1)和PHR2都属于MYB-CC(V-mybavian myeloblastosis viral oncogene homolog and coiled-coil)家族成员,是植物响应低磷胁迫的重要转录因子。研究表明,转小麦TaPHR1基因的小麦在低磷胁迫条件下的产量显著高于野生型对照[4]。水稻耐低磷胁迫基因OsPHR2通过调节磷饥饿诱导基因PSI(Phosphate starvation-induced)的表达而参与磷饥饿信号传导,OsPHR2过表达使PSI基因表达增强,从而提高了转基因植株叶鞘中磷的积累量[5-7]。在低磷条件下,过量表达OsPHR2基因可提高植物根系对低磷信号的响应,根构型的改变较野生型对照更明显,根长增长,根毛增多,磷吸收利用率显著提高[8]。OsPHR2是水稻磷信号调控体系的重要转录因子,在土壤缺磷条件下可显著提高植物对磷的吸收[8-9]。目前,关于OsPHR2基因转化小麦及对小麦耐低肥能力的影响研究还未见报道。为此,利用基因枪法,首次将OsPHR2基因导入河南省大面积推广的小麦品种和高代品系中,分析不同基因型小麦的转化效率和OsPHR2基因在小麦中的遗传稳定性,并分析转基因小麦的耐低肥能力及产量相关性状,以期为小麦养分高效利用育种提供材料基础和理论支撑。
1 材料和方法
1.1 材料
供试小麦品种(系)为郑麦1836、郑麦6687、郑麦7698、郑麦1342、郑麦6694、郑麦9188。
OsPHR2和Bar(双丙氨膦抗性)基因的线性转化片段如图1所示。这2个转化片段均是利用Hind Ⅲ限制性内切酶分别酶切环状表达载体 pWMB003-OsPHR2和pSBar,并通过胶回收而获得。线性转化片段只含有启动子[玉米Ubi(Ubiquitin)启动子]、目标基因和终止子(Nos终止子),不含有任何载体骨架序列。所有供试材料和OsPHR2、Bar基因表达载体均由河南省农业科学院小麦研究所分子育种研究室提供。

图1 OsPHR2和Bar基因线性表达载体片段Fig.1 Fragment of OsPHR2 and Bar gene linear expression vectors
1.2 培养基
诱导培养基:MS+2 mg/L 2,4-D+30 g/L蔗糖;高渗培养基:诱导培养基+0.4 mol/L甘露醇;分化培养基:MS+1 mg/L激动素+0.5 mg/L萘乙酸+5 mg/L草铵膦+30 g/L蔗糖;生根培养基:1/2 MS+0.2 mg/L萘乙酸+30 g/L蔗糖。在每种培养基中加入7 g/L琼脂粉,pH值调节为5.8,高温高压灭菌。其中,草铵膦经过滤除菌,再加入灭菌后温度降至50 ℃左右的培养基中。
1.3 小麦遗传转化和转OsPHR2基因植株的获得
于小麦开花后12~15 d,取小麦穗,将被覆白毛的幼嫩种子在无菌条件下进行消毒,剥取幼胚接种于诱导培养基上,置于25 ℃培养室内暗培养3~5 d,转移至高渗培养基(6 cm培养皿中央2.5 cm直径范围内)渗透处理4~6 h,然后采用基因枪介导转化法转化小麦愈伤组织,具体参照李艳等[10-11]的方法,将含有OsPHR2和Bar的2个独立线性表达载体共同转化至6个供试受体材料中。然后将小麦愈伤组织暗培养14 d,之后转移至分化培养基上,利用草铵膦进行2~3轮筛选,将获得的抗性幼苗转移至生根培养基上,通过壮苗、炼苗后移栽入河南省农业科学院智能温室中。
1.4 转OsPHR2基因植株的PCR检测
待转OsPHR2基因T0植株长到三叶一心期,利用CTAB法[12]提取植株叶片基因组DNA,分别对目的基因OsPHR2和选择标记基因Bar进行PCR检测。
选择标记基因Bar为草铵膦抗性基因,其检测引物为FBP1:5′-CCATCGTCAACCACTACATC-3′,RBP2:5′-ATGCCAGTTCCCGTGCTTGA-3′,扩增的目的片段长度为408 bp。PCR 反应体系为20 μL:2×TaqPCR StarMix with Loading Dye(GenStar)10 μL、正向引物和反向引物(10 μmol/L)各0.8 μL、200~600 ng 的DNA 模板1 μL,补加ddH2O至20 μL 。扩增程序:94 ℃预变性5 min;94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min。
目的基因OsPHR2检测引物为 FPP1:5′-AATATGGAGGCTTTGAACC-3′,RPP2:5′-TAACACACCCTTGGGAGTA-3′,扩增的目的片段长度为476 bp。PCR反应体系为20 μL:2×TaqPCR StarMix with Loading Dye(GenStar)10 μL、正向引物和反向引物(10 μmol/L)各0.8 μL、200~600 ng 的DNA 模板1 μL,补加ddH2O至20 μL 。扩增程序:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸40 s,33个循环;72 ℃延伸10 min。
扩增产物通过1%的琼脂糖凝胶电泳进行检测。以上引物均由生工生物工程(上海)股份有限公司合成。
1.5 高肥和低肥条件下转OsPHR2基因植株的产量性状调查
2018年10月将T1转基因小麦种植于国家黄淮海转基因小麦中试与产业化基地,试验设置高肥和低肥2个肥力水平(表1),常规大田管理。收获期,取自然风干的T1转基因株系和野生型对照各20株,调查单株穗数、穗粒数、千粒质量、单株产量和单株生物量。

表1 高、低肥处理土壤基础肥力和肥料施用量Tab.1 The soil basic fertility and fertilizer application amount of high and low fertility treatment
1.6 数据处理
利用SPSS 20.0对试验数据进行卡方测验和方差分析。
2 结果与分析
2.1 转OsPHR2基因小麦的获得
通过基因枪介导转化法将OsPHR2和Bar共转化郑麦1836、郑麦6687、郑麦7698、郑麦1342、郑麦6694、郑麦9188,为获得只含有OsPHR2基因、不含Bar和任何载体序列的转基因小麦株系提供了最大的可能性,愈伤组织的诱导、分化、筛选和抗性苗的获得如图2所示。
2.2 转OsPHR2基因小麦T0植株的PCR检测
利用PCR方法对抗性植株中目的基因OsPHR2和Bar进行检测,结果表明,有180株抗性植株均含有OsPHR2和Bar基因(图3—4),其中,郑麦1836有56株,郑麦6687有38株,郑麦7698有17株,郑麦1342有27株,郑麦6694有32株,郑麦9188有10株,野生型对照均未扩增出目标条带。初步证明目的基因OsPHR2已整合到小麦基因组中。
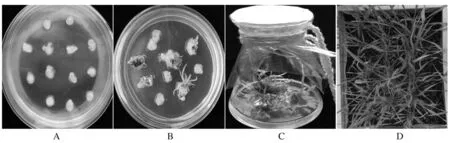
A:愈伤组织的诱导; B:愈伤组织的分化; C:抗性苗的筛选; D:抗性苗的移栽

M:D2000 Marker; 1:阳性对照; 2:野生型对照; 3:空白对照; 4—14:转化植株

M:D2000 Marker; 1:阳性对照; 2:野生型对照; 3:空白对照; 4—14:转化植株
从表2可以看出,从6个受体材料中共筛选到1 135株抗性再生植株,受体郑麦1836、郑麦6687、郑麦7698、郑麦1342、郑麦6694、郑麦9188的阳性率分别为3.32%、3.51%、6.83%、4.41%、3.78%、1.16%。说明不同基因型小麦的转化率存在差异,郑麦7698的转化率最高,郑麦9188最低。

表2 基因枪转化不同基因型小麦的转化率Tab.2 The transformation efficiency of different wheat genotypes by particle bombardment
注:阳性率=(PCR检测阳性植株数/轰击幼胚总数)×100%。
Notes: Positive rate=Positive plant number by PCR detection/Bombarded embryo number×100%.
2.3 转OsPHR2基因小麦的遗传分析
对从转OsPHR2基因T0阳性植株中获得的T1株系的OsPHR2基因进行PCR检测,并根据PCR结果对部分株系的分离比进行适合度测验。从表3可以看出,郑麦7698和郑麦1342转OsPHR2基因小麦T1共16个株系,其中,有15个株系的分离比与预期的比例(3∶1)差异不显著,符合孟德尔单基因遗传分离规律,郑麦7698转基因株系T-301的分离比与预期比例差异显著。上述结果初步表明,外源基因OsPHR2已整合到小麦基因组中,并能够稳定遗传。
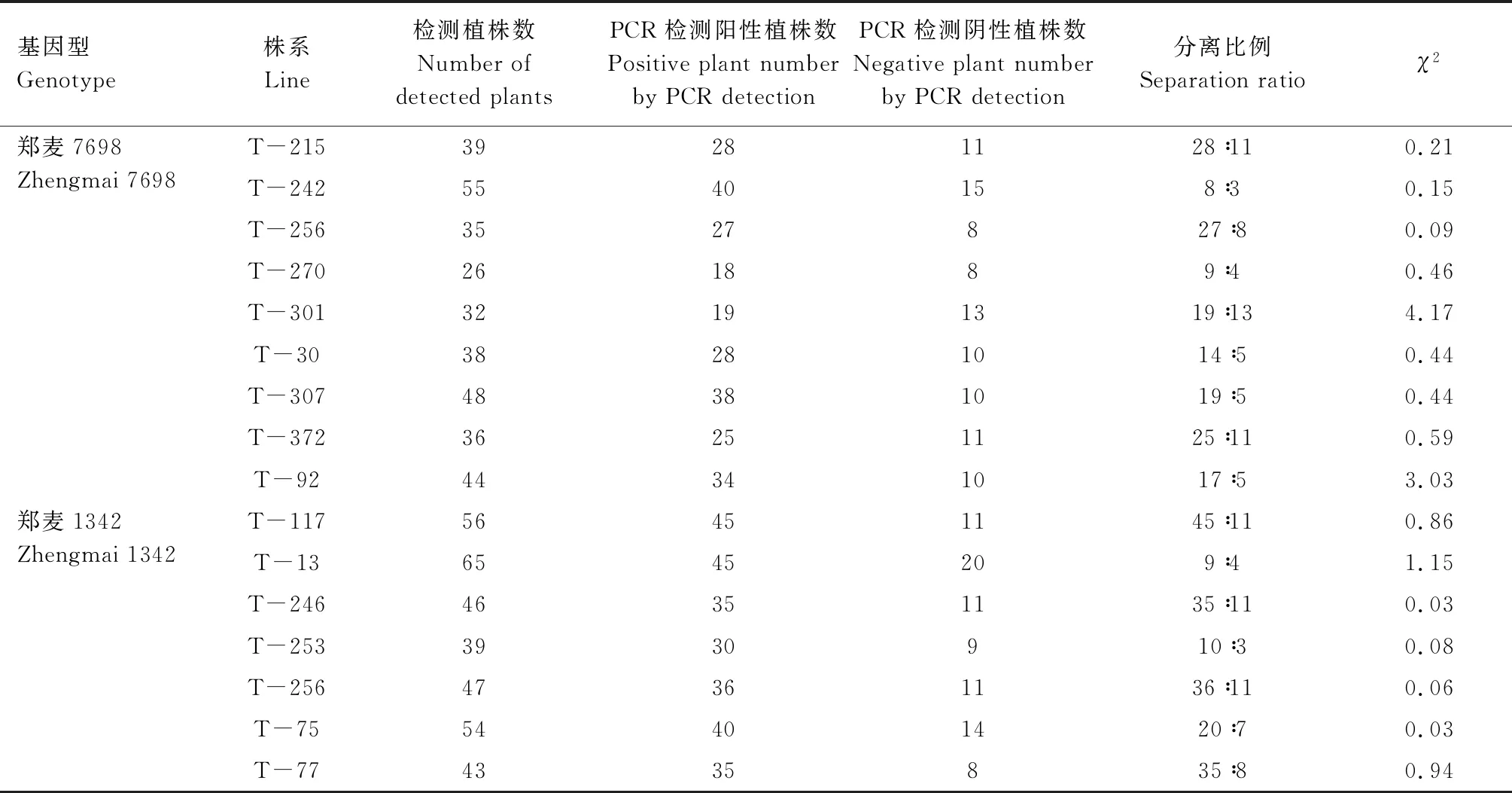
表3 转OsPHR2基因T1小麦的遗传分析Tab.3 Genetic analysis of OsPHR2-overexpressing T1 transgenic wheat
2.4 转OsPHR2基因小麦T1植株的农艺性状分析
从表4可以看出,在2种肥力条件下转OsPHR2基因小麦的单株产量均较野生型对照增加,但高肥条件下增加不显著;低肥条件下,郑麦7698和郑麦1342转OsPHR2基因小麦的平均单株产量分别较对照增加9.27%和11.06%,增产的原因主要是千粒质量和穗粒数总体均显著增加。另外,在2种肥力水平下,郑麦7698转基因小麦的单株生物量均较野生型对照显著增加。说明低肥条件下OsPHR2基因可以提高转基因小麦的养分利用效率。

表4 转OsPHR2基因T1小麦植株农艺性状分析Tab.4 Analysis of agronomic characters of OsPHR2-overexpressing T1 transgenic wheat plants
注: *代表转基因株系与野生型对照的差异显著(P<0.05)。
Notes:* indicates significant difference between transgenic plants and wild type plants (P<0.05).
3 结论与讨论
基因枪介导小麦遗传转化的成功与否受基因型、外植体类型以及轰击参数等多个因素的影响。其中,基因型对组织脱分化再生的决定性作用已被广泛认可[13]。为筛选到优良的小麦基因型受体材料,许多学者开展了大量研究。栗聪等[14]从196个黄淮地区小麦推广品种(系)中筛选到10个与对照Bobwhite相似或具有更高组培再生能力的品种(系)。蒋云等[15]从21 份四川省优良小麦品种(系)中筛选到5份适宜农杆菌介导转化的基因型,丰富了西南麦区小麦遗传转化的基因型受体材料。筛选再生能力强而且农艺性状良好的基因型作为转化受体,对小麦的遗传改良研究具有重要意义。郑麦1836、郑麦6687、郑麦7698、郑麦1342、郑麦6694、郑麦9188是河南省大面积推广品种、苗头品系,且具有较优的农艺性状。本研究发现,不同基因型遗传转化率存在明显差异,郑麦7698和郑麦1342的遗传转化率高于其他受体材料。同时,郑麦7698和郑麦1342是在生产上大面积推广应用的高产优质小麦品种。因此,利用郑麦7698和郑麦1342作为转基因受体材料,可快速培育出高产、优质、高效、节本的转基因小麦新品种。
根据PCR检测结果对转OsPHR2基因部分T1株系的分离比进行卡方测验,结果显示大部分株系符合孟德尔单基因遗传分离规律,证明OsPHR2已整合到小麦基因组中并在后代中能够稳定遗传,但有个别株系偏离此规律,这是转基因T1普遍存在的现象,与前人研究结果类似[16-17]。由于大部分T0植株收获的种子数量较少,本研究检测T1植株数目受限,外源基因能否在转基因植株中稳定遗传和表达,还需在T2、T3以及更高世代,利用较大的样本群体,并结合拷贝数和插入位点等进行进一步的遗传分析。
本研究还发现,在低肥条件下过表达OsPHR2的转基因小麦总体上显著增加了穗粒数和千粒质量,最终单株产量显著提高。前人在转基因拟南芥[18-19]、水稻[8]、大豆[20]的研究中发现,OsPHR2基因的过表达可以增强转基因植株对磷的吸收能力,抑制磷素从老叶向幼叶的转运再利用,改善根构型,增加百粒质量及籽粒蛋白质含量,这些可能与OsPHR2基因调控磷信号与磷吸收的3条途径[21]有密切关系,分别为OsPHR2基因可以直接调控低亲合磷转运体OsPT2(OryzasativaL. phosphate transporter 2),OsPHR2基因可通过调控IPS1-MiR399-PHO2(Inositol-1-phosphatesynthase-microRNA399-phosphate over-accumulator 2)途径调控低亲合和高亲合磷转运体PHR2-PHO-PT(Phosphate starvation response 2-phosphate over-accumulator-phosphate transporter)途径,OsPHR2基因调控磷转运体受OsPHF1(OryzasativaL. phosphate transporter traffic facilitator 1)的控制,下一步将对其调控机制进行研究。

