白芍总苷抑制局灶性脑缺血大鼠海马神经元损伤的机制研究
李红霞 张益明 陈刚 徐立 陈小丽 代小兰
海马神经元与机体多种神经系统功能密切相关,尤其是空间学习记忆能力[1-2]。因此,抑制海马神经元损伤对改善缺血性脑损伤患者的临床症状具有至关重要的作用。白芍总苷为毛茛科白芍属植物白芍的活性成分,既往研究发现芍药苷能够改善大鼠认知功能障碍并调节海马神经因子[3]。本研究就白芍总苷对局灶性脑缺血损伤大鼠海马神经元的保护作用及其机制作一探讨,现将结果报道如下。
1 材料和方法
1.1 实验动物 无特定病原体(SPF)级8周龄雄性SD大鼠,体质量230~260g,购自宁波大学实验动物中心[SYXK(浙)2014-0005],动物批次号:20181030006。实验前清洁环境饲养1周,每天光照12h+黑暗12h,恒室温25℃,相对湿度50%~70%,自由饮水、进食。
1.2 主要试剂 白芍总苷胶囊(国药准字H20055058,0.3g/粒,批号201712005,宁波立华制药有限公司);NF-κB、B 细胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2 相关 X 蛋白(Bax)多克隆抗体和二喹琳甲酸法(BCA)测定试剂盒(批号 201710013、201801007、201712011、201803002,上海碧云天生物技术有限公司);超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)试剂盒及TUNEL 试剂盒(批号 20180116、20180305、20180324、20171109,南京建成生物工程研究所);IL-1β、IL-6、TNF-α 的 ELISA 试剂盒(批号 180117、171230、171125,北京华英生物技术研究所)。
1.3 主要仪器 Multiskan MK-3型酶标仪(芬兰Thermo公司);SZ-1型组织匀浆器(江苏金坛市晶玻实验仪器厂);DYY-6B型稳压稳流电泳仪(北京六一仪器厂);DU700型紫外可见分光光度计(美国Beckman Coulter公司);H-7650型透射电子显微镜(日本Hitachi公司);RM2125型石蜡切片机(德国Leica公司);BH-2型倒置光学显微镜及摄像(日本Olympus公司)。
1.4 实验方法
1.4.1 模型建立 参照王新凤等[4]报道的实验方法,建立局灶性脑缺血大鼠模型。(1)线栓制作:取直径0.235mm钓鱼线并剪制3.5cm长度分段,轻轻灼烧一侧呈钉子帽状,在距离“钉子帽”一侧18~20mm处作标记,备用。(2)模型制备:大鼠腹腔注射10%水合氯醛溶液麻醉,颈部正中作切口,剥离右侧颈总动脉、颈外动脉、颈内动脉(充分暴露3者分叉处),结扎颈外动脉,于颈总动脉分叉处近心端作一切口,插入线栓至颈内动脉,遇阻力停止,深度距分叉处约18mm,固定线栓后逐层缝合,消毒。假手术组大鼠除不插入线栓外,其余操作同模型组。
1.4.2 分组与给药 将造模成功的100只大鼠按随机数字表法分为模型组、白芍总苷高剂量组(200mg/kg)、中剂量组(100mg/kg)、低剂量组(50mg/kg),每组 25只;假手术组大鼠25只。术后第2天开始灌胃给药,白芍总苷高、中、低剂量组分别将相应剂量的白芍总苷溶于3ml的0.9%氯化钠溶液中,假手术组和模型组给予等量的0.9%氯化钠溶液;1次/d,共28d。
1.4.3 海马神经元病理学观察 每组大鼠随机取10只,腹腔注射10%水合氯醛溶液麻醉后开胸、暴露心脏,于左心室植入一灌注针头、右心耳作一切口,快速灌洗0.9%氯化钠溶液,直至右心耳切口处流出的液体清澈停止;再用4%多聚甲醛溶液继续灌注固定,灌注速度由快变慢,待大鼠完全僵硬后,断头取脑分离出海马组织,置4%多聚甲醛溶液固定24h,石蜡包埋、切片(厚2μm),二甲苯透明、梯度乙醇脱蜡、水化处理,再行HE染色。在倒置光学显微镜下观察并照相保存。
1.4.4 海马神经元凋亡情况观察 取上述制备的海马组织石蜡切片,经脱蜡、水化处理后,进行TUNEL法染色。在倒置光学显微镜下观察并照相,细胞核棕黄色为阳性着色。每只大鼠随机取5张染色切片,每张切片取5个互不重叠的视野,计数每个视野细胞总数及凋亡细胞数。凋亡指数(AI)=(凋亡细胞数/细胞总数)×100%。
1.4.5 超微结构观察 取各组5只大鼠,按上述方法心脏灌流固定至肝脏颜色明显变淡时,立即断头取脑并分离出海马组织,切割成约1mm3小块后置4℃预冷的3%戊二醛溶液中,于4℃冰箱内固定2h;PBS浸洗30min,置1%四氧化锇溶液中,于4℃冰箱内再固定2h;依次经梯度乙醇脱水、还氧丙烷置换、环氧树脂Epon812浸透、包埋、聚合、光学显微镜下定位,超薄切片(60nm)经醋酸铀和柠檬酸铅染色后,在10 000倍透射电子显微镜下观察海马神经元超微结构并拍照。
1.4.6 凋亡相关蛋白(NF-κB、Bcl-2、Bax)表达检测 采用Western blot法。(1)蛋白提取:取各组剩余10只大鼠,腹腔注射10%水合氯醛溶液麻醉后,迅速置PBS冻结的冰块上取脑并分离出海马组织,置离心管中加入9倍量放射免疫沉淀法蛋白裂解液,将离心管置于盛有冰水混合物的烧杯中,研磨匀浆,低温高速离心(4℃,12 000rpm)15min后取上清液,-70℃冰箱保存,备检。(2)总蛋白含量测定:严格按照BCA测定试剂盒说明进行操作,使用酶标仪测定562nm处吸光度值,根据测定的标准曲线计算总蛋白浓度。(3)Western blot检测:蛋白样本经沸水10min高温变性处理后,上样、十二烷基硫酸钠聚丙烯酰胺(SDS-PAGE)凝胶电泳(电压130V,待溴酚蓝电泳至凝胶底部时停止)、转PVDF膜(电压100V、2h),丽春红溶液染膜、洗膜,5%脱脂奶粉封闭 1h,滴加一抗[NF-κB、Bcl-2、Bax、β-actin(1:500)],4℃摇床过夜;洗膜后滴加二抗(1:100),室温摇床孵育1h;洗膜后滴加电化学发光底物,室温孵育1min。利用凝胶成像系统对胶片上相应条带进行扫描,通过条带灰度值计算蛋白含量。
1.4.7 抗氧化酶(SOD、CAT)活性及MDA含量检测 取上述海马组织匀浆液,严格按照各试剂盒说明进行操作。采用黄嘌呤氧化酶法测定SOD活性,生化分析法测定CAT活性,硫代巴比妥酸法测定MDA含量。
1.4.8 炎症细胞因子(IL-1β、IL-6、TNF-α)水平检测 取上述海马组织匀浆液,严格按照ELISA检测试剂盒说明进行操作,使用酶标仪测定IL-1β、IL-6、TNF-α水平。
1.5 统计学处理 应用SPSS 15.0统计软件。计量资料用表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 白芍总苷对局灶性脑缺血大鼠海马神经元病理学改变的影响 假手术组大鼠海马神经元结构完整清晰、排列整齐、层次清晰(呈3~5层),未见异常;模型组海马神经元数量减少、间隙增大、层次不清,细胞边界不清、胞体肿胀变大、核固缩偏移等,呈明显病理性形态结构改变;白芍总苷低、中、高剂量组海马神经元上述病理性改变较模型组不同程度减轻,高剂量组最明显:神经元排列较为整齐、细胞分界清晰,可见少量神经元形态结构异常,见图1(插页)。
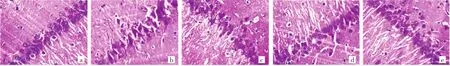
图1 各组大鼠海马神经元病理学检查结果(a:假手术组;b:模型组;c:低剂量组;d:中剂量组;e:高剂量组;HE染色,×200)
2.2 白芍总苷对局灶性脑缺血大鼠海马神经元凋亡的影响 模型组大鼠海马神经元凋亡数量明显多于假手术组,白芍总苷低、中、高剂量组海马神经元凋亡数量较模型组不同程度减少,见图2(插页)。模型组AI为(58.76±9.48)%,明显高于假手术组的(2.37±0.98)%,差异有统计学意义(P<0.05);白芍总苷中、高剂量组AI分别为(31.84±7.09)%、(25.47±6.28)%,均低于模型组,差异均有统计学意义(均P<0.05);白芍总苷低剂量组AI为(49.93±10.27)%,与模型组比较差异无统计学意义(P>0.05)。
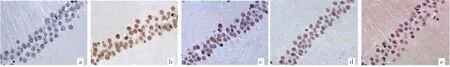
图2 各组大鼠海马神经元凋亡情况(a:假手术组;b:模型组;c:低剂量组;d:中剂量组;e:高剂量组;TUNEL法,×200)
2.3 白芍总苷对局灶性脑缺血大鼠海马神经元超微结构的影响 假手术组大鼠海马神经元超微结构未见异常。模型组海马神经元出现明显的病理性超微结构改变,包括胞膜破裂、碎片;胞浆溶解呈空泡状;核膜破裂、核仁边界不清、周围间隙增大;线粒体数量减少、体积增大、嵴断裂溶解、嵴内间隙增大;内质网颗粒脱落;高尔基体肿胀变大等。白芍总苷低、中、高剂量组上述病理性超微结构改变较模型组呈不同程度减轻,其中高剂量组最显著,见图3(插页)。
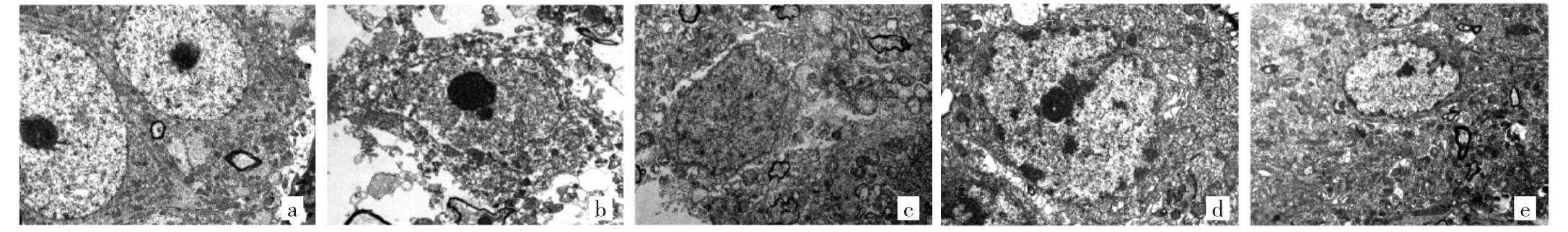
图3 各组大鼠海马神经元超微结构(a:假手术组;b:模型组;c:低剂量组;d:中剂量组;e:高剂量组;透射电子显微镜,×10 000)
2.4 白芍总苷对局灶性脑缺血大鼠海马Bcl-2、Bax、NF-κB蛋白表达及Bcl-2/Bax的影响 模型组大鼠海马 Bcl-2、Bax、NF-κB蛋白较假手术组均明显上调,Bcl-2/Bax降低,差异均有统计学意义(均P<0.05);白芍总苷中、高剂量组大鼠海马Bcl-2蛋白表达上调,Bax、NF-κB蛋白表达明显下调,与模型组比较差异均有统计学意义(均P<0.05),见表1和图4。
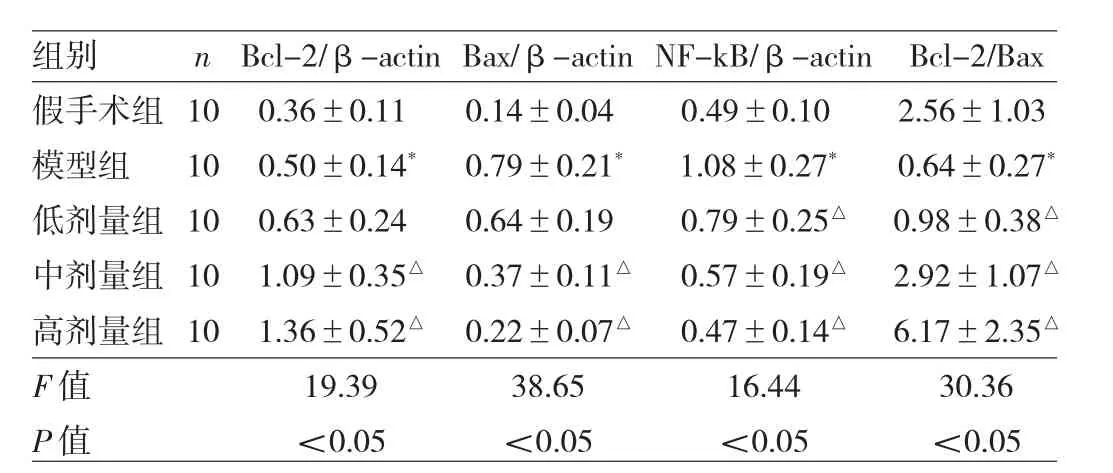
表1 各组大鼠海马Bcl-2、Bax、NF-κB蛋白表达及Bcl-2/Bax比较

图4 各组大鼠海马Bcl-2、Bax、NF-κB蛋白表达的电泳图(a:假手术组;b:模型组;c:低剂量组;d:中剂量组;e:高剂量组)
2.5 白芍总苷对局灶性脑缺血大鼠海马SOD、CAT活性和MDA含量的影响 与假手术组比较,模型组大鼠海马SOD、CAT活性均明显降低,MDA含量明显升高,差异均有统计学意义(均P<0.05);与模型组比较,白芍总苷中、高剂量组大鼠海马SOD、CAT活性均明显升高,MDA含量明显降低,差异均有统计学意义(均P<0.05),见表 2。
2.6 白芍总苷对局灶性脑缺血大鼠海马IL-1β、IL-6、TNF-α水平的影响 与假手术组比较,模型组大鼠海马IL-1β、IL-6、TNF-α水平均明显升高,差异均有统计学意义(均P<0.05);与模型组比较,白芍总苷中、高剂量组大鼠海马IL-1β、IL-6、TNF-α水平均明显降低,差异均有统计学意义(均P<0.05),见表3。
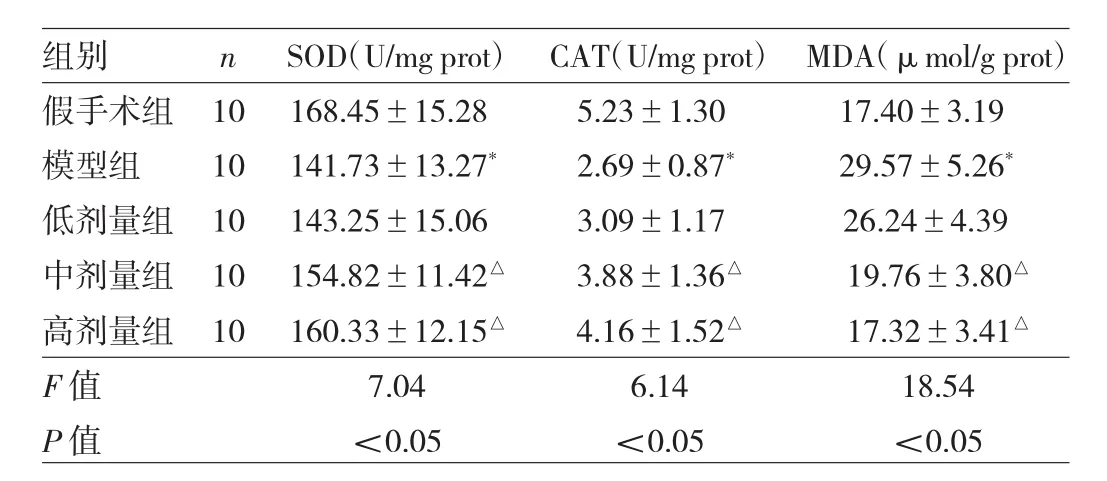
表2 各组大鼠海马SOD、CAT活性及MDA含量比较
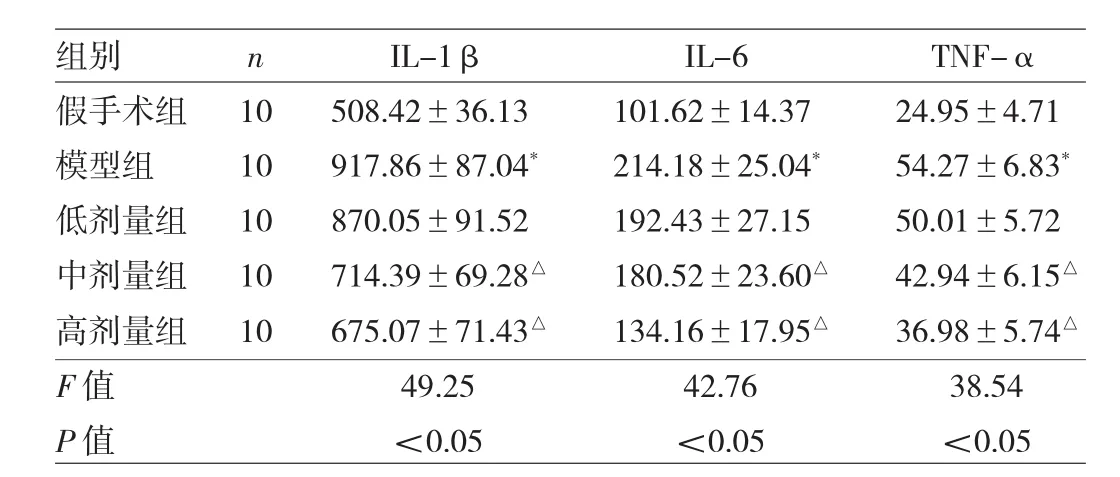
表3 各组大鼠海马IL-1β、IL-6、TNF-α水平比较(nmol/L)
3 讨论
脑血管病是临床常见病、多发病,其中缺血性脑血管病占70%以上,具有高致残率和高致死率,严重危害着人类生命与建康[5-6]。海马是与认知、学习记忆功能密切相关的脑区,而海马神经元对缺血、缺氧最为敏感[7-8],因此保护海马神经元对减少认知障碍等并发症具有重要作用。
白芍总苷是我国传统中药白芍的主要活性成分,具有多种药理学活性。本研究发现白芍总苷能明显改善局灶性脑缺血大鼠海马神经元层次不清、排列紊乱、神经元数量减少、间隙增大、胞体肿胀变大、核固缩偏移等病理性改变;抑制神经元凋亡;抑制神经元细胞膜、细胞质、细胞核、细胞器等出现的超微结构病变。病理生理学研究发现,多种机制参与脑缺血所致海马神经元损伤病理过程,其中氧化应激[9-10]、炎症级联反应[11-12]、细胞凋亡[11]具有重要的作用。脑缺血后氧自由基大量生成、抗氧化酶(SOD、CAT)失活及过度消耗是导致氧化应激的根本原因,氧自由基能氧化不饱和脂肪酸并破坏细胞膜,还能损伤核酸、引发DNA断裂等;脂质过氧化最终产物为MDA,其含量与氧自由基数量呈正相关,是评价氧化应激损伤程度的敏感指标[13]。白芍总苷是一种天然抗氧化剂,具有良好的抗氧化作用[14],本研究发现白芍总苷能明显提高局灶性脑缺血大鼠缺血侧海马SOD、CAT活性并降低MDA含量;提示白芍总苷能恢复缺血侧海马已耗尽的抗氧化能力,从而抑制其氧化应激反应。
脑缺血能病理性刺激小胶质细胞和星形胶质细胞,从而过度释放炎症因子(如细胞因子、趋化因子、基质金属蛋白酶等),进一步促进内皮细胞黏附分子的表达,使缺血区脑组织炎症细胞、中性粒细胞聚集[15];中性粒细胞可分泌细胞因子而进一步活化胶质细胞[16],从而形成炎症级联反应。活化的小胶质细胞、星形胶质细胞和神经细胞内炎症细胞因子IL-1β表达上调,而IL-1β水平升高可刺激另一种炎症细胞因子IL-6表达上调[17],IL-6水平与脑梗死体积密切相关。因此,IL-6可作为脑组织损伤的评价指标[18]。TNF-α是一种促炎细胞因子,脑缺血早期即可检测到TNF-α表达上调。有研究证实,通过阻断TNF-α表达能降低DNA碎片、减轻缺血侧脑损伤[19]。李振彬等[20]研究证实,白芍总苷具有炎症抑制作用。本研究结果发现,白芍总苷能明显降低局灶性脑缺血大鼠缺血侧海马IL-1β、IL-6、TNF-α水平,提示白芍总苷具有抑制缺血侧海马炎症反应的作用。
脑缺血发生后,缺血核心区神经元在数小时甚至几分钟内即发生不可逆坏死,而缺血核心区与正常脑组织之间的“半暗带”神经元死亡以凋亡为主要表现。细胞凋亡机制非常复杂,多种蛋白或活化蛋白酶参与凋亡过程的调控。Bcl-2蛋白家族通过影响线粒体膜通透性而在细胞凋亡信号传导中发挥重要作用[21],其中抗凋亡蛋白Bcl-2能将凋亡激活因子(Apaf-1)固定在线粒体膜上,从而抑制其发挥凋亡诱导作用。Bcl-2能通过抑制谷胱甘肽外泄而调控细胞内氧化还原电位,从而控制膜电位、抑制细胞凋亡;此外,促凋亡蛋白Bax为小分子细胞色素C提供通道,由线粒体进入胞质而促进细胞凋亡,而Bcl-2蛋白能与Bax蛋白形成同源二聚体,抑制Bax活性,关闭Bax通道而阻止小分子通过,从而拮抗Bax促凋亡作用。因此Bcl-2/Bax可反映两者在细胞凋亡调控中的作用[22]。氧自由基是NF-κB蛋白的重要激活剂[23],活化NF-κB蛋白能进入细胞核,并与凋亡相关基因cmyc结合,从而促进其转录表达,在细胞凋亡过程中发挥重要作用。齐晅等[24]研究发现,活化NF-κB蛋白在炎症反应与细胞凋亡之间具有重要的桥梁作用。本研究结果发现,白芍总苷能明显上调局灶性脑缺血大鼠海马Bcl-2蛋白表达,下调 Bax、NF-κB蛋白表达,提高Bcl-2/Bax,这可能是白芍总苷抑制缺血侧海马神经元凋亡的重要分子机制。
综上所述,白芍总苷对局灶性脑缺血大鼠海马神经元病理性改变及超微结构病变具有保护作用,作用机制可能与其调控凋亡相关蛋白表达、抑制氧化应激和炎症级联反应有关。

