诱导化疗联合同步放化疗序贯辅助化疗治疗局部晚期鼻咽癌的近远期疗效及安全性△
曾甜,吴双,康瑜,陈灿,杨攀,秦勤,张艳玲
陆军军医大学第一附属医院肿瘤科,重庆400038
鼻咽癌是临床常见的恶性肿瘤,约占全球所有恶性肿瘤的0.6%[1]。世界卫生组织(WHO)发表的《全球癌症报告2014》的统计分析显示,80%的鼻咽癌发生在中国[2],男性患病率是女性的2~3倍[1,3],严重威胁居民的身体健康和生活质量。鼻咽癌的早期发病症状较为隐匿,确诊时超过50%的患者已进展为局部晚期,且多已出现远处转移,影响临床疗效[4]。因解剖位置的特殊性及对放射线的高敏感性,早期鼻咽癌仅接受放射治疗即能达到满意的疗效;而同步放化疗是局部晚期鼻咽癌的标准治疗方案[5]。局部复发和远处转移是鼻咽癌患者治疗失败的主要原因,因此,本研究探讨诱导化疗联合同步放化疗序贯辅助化疗对局部晚期鼻咽癌患者的近远期疗效及安全性,以期延长患者的总生存率,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年11月至2017年11月在陆军军医大学第一附属医院住院治疗的鼻咽癌患者。纳入标准:经影像学检查及病理组织学检查确诊为Ⅲ~ⅣA期鼻咽癌。排除标准:①年龄<18岁;②出现远处转移;③合并其他系统恶性肿瘤;④存在重症感染、心力衰竭等放化疗禁忌证;⑤哺乳期及妊娠期妇女;⑥滥用药物、吸毒及酒精成瘾的患者;⑦合并严重精神疾病的患者。依据纳入和排除标准,本研究共纳入216例局部晚期鼻咽癌患者,其中男165例,女51例;年龄23~76岁,中位年龄为49岁;依据WHO的分型标准[6]对患者进行组织学亚型分型:角化型鳞状细胞癌11例,分化型非角化性癌32例,未分化型非角化性癌173例;依据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)癌症分期第七版[7]对患者进行TNM分期:T1期4例,T2期103例,T3期88例,T4期21例;N0期19例,N1期23例,N2期171例,N3期 3例;M0期216例;Ⅲ期(T1-2N2M0和 T3N0-2M0)192例,ⅣA 期(T1-3N3M0和T4N0-3M0)24例。
1.2 治疗方法
所有患者均接受多西他赛+奈达铂方案诱导化疗:化疗前1天,地塞米松8 mg口服,每天2次,连续3天,以预防血管水肿,同时使用止吐药物对症治疗。第1天,多西他赛75 mg/m2,静脉滴注,奈达铂80 mg/m2,静脉滴注,3周为1个疗程,共治疗2个疗程。诱导化疗结束后21天,根据实体瘤疗效评价标准1.1(response evaluation criteria in solid tumor 1.1,RECIST 1.1)[8]对患者诱导化疗效果进行评价。随后,所有患者接受同步放化疗,放疗采用适形调强放疗,依据“2010鼻咽癌调强放疗靶区及剂量设计指引专家共识”[9]勾画靶区,靶区处方剂量:①肿瘤靶区74 Gy;②颈部转移淋巴结70 Gy;③临床靶区 1(clinical target volume 1,CTV1)66 Gy;④临床靶区2(clinical target volume 2,CTV2)54 Gy,共33次,每天1次,每周5次;放疗期间接受奈达铂同步化疗,第1天,奈达铂80 mg/m2,静脉滴注,3周为1个疗程,共治疗2个疗程。放疗结束后4周,对所有患者的疗效进行评价。评价结束后,所有患者接受2个疗程多西他赛+奈达铂辅助化疗,化疗方案同诱导化疗,辅助化疗结束后4周,对所有患者的疗效进行评价。
1.3 观察指标和评估标准
根据RECIST 1.1[8]评价患者的近期疗效:完全缓解(complete response,CR),病灶全部消失并保持4周;部分缓解(partial response,PR),病灶最长径之和减少30%以上并保持4周;疾病进展(progressive disease,PD),病灶最长径之和增大20%以上并保持4周;疾病稳定(stable disease,SD),介于PR和PD之间。客观缓解率(objective response rate,ORR)=(CR+PR)例数/总例数×100%。每疗程化疗后观察记录患者症状、体征改变,每周复查血常规,每3周复查肝肾功能、心电图;参考常见不良反应事件评价标准4.0(common terminology criteria for adverse event 4.0,CTCAE 4.0)[10]对患者的不良反应进行评估。采用电话随访的方式对患者进行常规随访,每3个月1次,随访截止时间为2018年12月,观察所有患者的1年生存率、局部复发率及远处转移率。
1.4 统计学方法
采用SPSS 22.0软件对所有数据进行统计分析。计数资料以例数和率(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效情况
诱导化疗+同步放化疗后患者的ORR为88.0%(190/216),诱导化疗+同步放化疗+辅助化疗后患者的ORR为91.2%(197/216),均明显高于诱导化疗后患者的ORR为51.9%(112/216),差异均有统计学意义(χ2=66.946、81.122,P<0.01);但诱导化疗+同步放化疗后与诱导化疗+同步放化疗+辅助化疗后患者的ORR比较,差异无统计学意义(P>0.05)。(表1)
2.2 不良反应情况
216例鼻咽癌患者均完成诱导化疗、同步放化疗及辅助化疗,治疗期间未发生致死性不良反应。诱导化疗期间白细胞减少(39.4%)和恶心呕吐(35.2%)的发生率均较高,同步放化疗期间口腔黏膜炎(100%)、恶心呕吐(96.8%)和白细胞减少(95.8%)的发生率均较高,辅助化疗期间白细胞减少(98.1%)、恶心呕吐(85.6%)和血小板减少(59.7%)的发生率均较高。诱导化疗、同步放化疗和辅助化疗期间的各不良反应发生率比较,差异均有统计学意义(χ2=277.125、55.489、204.612、233.500、52.368、504.464,P<0.01)。(表2)
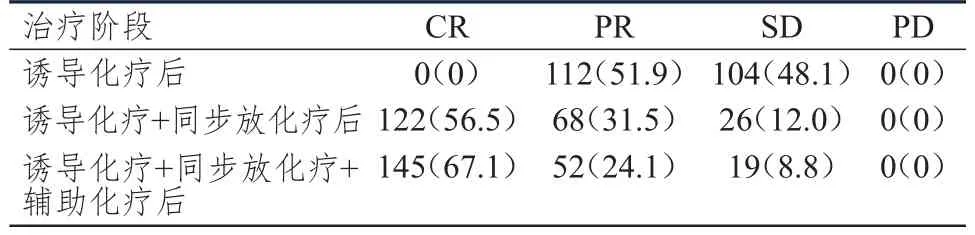
表1 不同治疗阶段局部晚期鼻咽癌患者的临床疗效[n=216,n(%)]
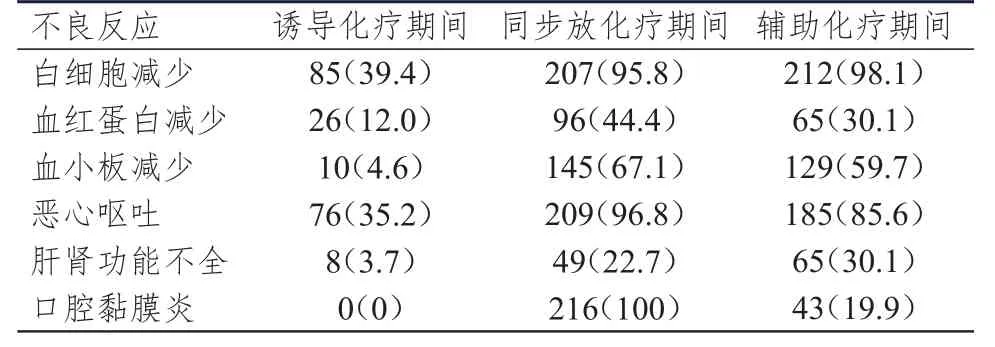
表2 不同治疗期间局部晚期鼻咽癌患者的不良反应发生情况[n=216,n(%)]
2.3 远期疗效情况
216例局部晚期患者在为期1年的随访中,PD患者34例(以肺、肝、骨远处转移为主),病死15例(13例因PD病死,1例因鼻腔大出血病死,1例死因不明)。Ⅲ期和ⅣA期鼻咽癌患者的1年生存率分别为93.8%(180/192)和87.5%(21/24),1年局部复发率分别为2.1%(4/192)和4.2%(1/24),1年远处转移率分别为12.5%(24/192)和20.8%(5/24)。为进一步分析不同的T或N分期对Ⅲ期患者疗效的影响,对TNM分期为Ⅲ期的患者进行分层分析,分为T1-2N2M0组104例和T3N0-2M0组88例,两组患者的1年生存率、1年局部复发率和1年远处转移率比较,差异均无统计学意义(P>0.05)(表3)。

表3 两组Ⅲ期鼻咽癌患者的远期疗效[n(%)]
3 讨论
鼻咽癌是临床常见的头颈部恶性肿瘤,鼻咽癌对放疗敏感,美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐,早期鼻咽癌仅接受放射治疗即可[11]。但研究显示,局部晚期及转移性鼻咽癌单纯放疗的效果欠佳[12],推荐放疗与化疗相结合的治疗方案,如诱导化疗、同步放化疗和辅助化疗。研究显示,同步放化疗已成为局部晚期鼻咽癌患者的标准治疗方案[5]。Baujat等[13]的Meta分析结果显示,放疗联合化疗可以使局部晚期鼻咽癌患者的5年生存率增加4%~6%,无瘤生存率提高10%,死亡风险下降18%,生存获益明显。局部复发和远处转移是局部晚期鼻咽癌治疗失败的主要原因,在同步放化疗前接受诱导化疗,可明显减少肿瘤负荷,快速缓解肿瘤对周围组织的压迫,消灭远处微小转移灶,达到优化治疗计划、保护正常组织的目的,并可以观察患者对化疗方案的客观反应情况[14]。Sun等[15]开展的Ⅲ期、随机、多中心临床研究结果显示,接受诱导化疗+同步放化疗的鼻咽癌患者3年无失败生存率为80%,高于单纯放化疗患者的72%(HR=0.68,95%CI:0.48~0.97,P<0.05),但接受诱导化疗+同步放化疗患者的总生存率并未显示明显优势。郑柳玉等[16]的研究结果显示,与单纯同步放化疗相比,诱导化疗+同步放化疗方案可行,但不能明显提高患者的无进展生存率和总生存率。为提高鼻咽癌患者的生存率,研究者对同步放化疗+辅助化疗的治疗模式进行探索,Al-Sarraf等[5]的研究中,同步放化疗+辅助化疗(顺铂+氟尿嘧啶)患者的3年无进展生存率和总生存率分别为69%和78%,均明显高于单纯放疗患者的24%和47%,表明同步放化疗+辅助化疗可明显改善鼻咽癌患者的预后,因此,成为北美地区局部晚期鼻咽癌的标准治疗方案。但也有研究显示,与接受单纯同步放化疗的患者相比,接受同步放化疗+辅助化疗患者的3年、5年总生存率并未明显提高[17-18]。Blanchard等[19]的Meta分析共纳入了19个随机对照临床研究,亚组分析结果显示,同步放化疗+辅助化疗的临床疗效明显优于单纯同步放化疗;该研究中,患者的随访时间长达7.7年,但延长随访时间是否会影响患者生存率,目前仍存在争议。
奈达铂是新一代铂类化合物,临床前药效学研究显示,奈达铂与顺铂相似,是一种广谱的抗肿瘤药物。邱杨等[20]的研究显示,奈达铂与顺铂治疗局部晚期鼻咽癌的近期疗效相近,但奈达铂导致的胃肠道和口腔黏膜不良反应均明显低于顺铂。因此,本研究探讨诱导化疗联合同步放化疗序贯辅助化疗对局部晚期鼻咽癌患者的近远期疗效及安全性,以期延长患者的总体生存率。216例局部晚期鼻咽癌患者均接受2个周期的多西他赛+奈达铂诱导化疗,然后接受调强放疗联合奈达铂全身化疗,放疗结束后行2个周期的辅助化疗,方案与诱导化疗相同,结果显示,入组患者均完成既定治疗计划,诱导化疗+同步放化疗+辅助化疗治疗后的ORR为91.2%,优于陈伙辉等[21]报道的88.0%、韦良鹏和梁善斌[22]报道的86.7%、韦军[23]报道的89.6%,以及邹茵和周志华[24]报道的72%。
不良反应分析发现,同步放化疗期间发生率较高的不良反应包括口腔黏膜炎(100%)、恶心呕吐(96.8%)和白细胞减少(95.8%),辅助化疗期间发生率较高的不良反应包括白细胞减少(98.1%)、恶心呕吐(85.6%)和血小板减少(59.7%),均高于既往研究[20-23]。此外,本研究还分层分析了临床分期为Ⅲ期鼻咽癌患者,结果显示,随访1年,T1-2N2M0组和T3N0-2M0组患者1年生存率、1年局部复发率和1年远处转移率比较,差异均无统计学意义(P>0.05),且均可达到较高的远期疗效。
综上所述,诱导化疗+同步放化疗+辅助化疗治疗局部晚期鼻咽癌疗效显著,但需要关注患者治疗期间的不良反应,需进一步扩大样本量、分组比较,并延长随访时间进行验证。

