培美曲塞长期维持治疗晚期肺腺癌的疗效与安全性分析
陈冬娜,马玉洁,刘娜,冯宇,胡兴胜#
1北京市朝阳区三环肿瘤医院内科,北京100122
2国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院内科,北京100021
肺癌是全球发病率及病死率最高的恶性肿瘤[1],严重威胁人类健康。肺癌分为非小细胞肺癌和小细胞肺癌,非小细胞肺癌包括鳞状细胞癌、腺癌和大细胞癌等,对表皮生长因子受体(epidermal growth factor receptor,EGFR)及间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)基因表达阴性的晚期非鳞非小细胞肺癌患者的一线治疗建议行培美曲塞或其他含铂类两药联合方案化疗。对一线治疗达到疾病控制的晚期非鳞非小细胞肺癌患者,可选择维持治疗,维持治疗的主要目的为提高肿瘤控制率、优化疗效、延长患者生存期[2]。本研究对中国医学科学院肿瘤医院与北京市朝阳区三环肿瘤医院收治的行培美曲塞长期维持治疗的29例晚期肺腺癌患者的病历资料进行总结,分析其临床特点,以期为临床治疗提供参考。
1 资料与方法
1.1 一般资料
选取2011年6月至2016年6月中国医学科学院肿瘤医院与北京市朝阳区三环肿瘤医院收治的行培美曲塞长期维持治疗的晚期肺腺癌患者的病历资料。纳入标准:①经细胞学或病理学确诊的初治局部晚期或转移性(ⅢB~Ⅳ期)肺腺癌患者,或一线化疗未经培美曲塞治疗者;②至少有一个客观可测量[影像学:计算机断层扫描(CT)或磁共振成像(MRI)]的肿瘤病灶,采用螺旋CT和MRI扫描最大径≥10 mm;③培美曲塞联合铂类化疗后培美曲塞单药维持治疗,总治疗时间超过18个月者;④临床及生存资料完整。排除标准:①细胞学或病理学不明确者;②病理分期不明确者。根据纳入和排除标准,本研究共纳入晚期肺腺癌患者29例,其中男性17例(58.6%),女性12例(41.4%);年龄28~70岁,中位年龄54岁;≥65岁6例(20.7%),<65岁23例(79.3%);肿瘤分期:Ⅲ期3例(10.3%),Ⅳ期26例(89.7%);EGFR基因突变9例(31.0%),ALK基因突变7例(24.1%),无基因突变3例(10.3%),未检测 10例(34.5%);吸烟者 6例(20.7%),不吸烟者23例(79.3%);联合化疗6个周期者16例(55.2%),联合化疗小于6个周期者6例(20.7%),联合化疗大于6个周期者7例(24.1%)。
1.2 治疗方法
所有患者均接受培美曲塞(500 mg/m2,第1天)联合顺铂(75 mg/m2,第1~3天)或卡铂(AUC=5,第1天)或奈达铂(80 mg/m2,第1~2天)方案化疗,静脉滴注,每3周为1个周期,联合化疗3~8个周期。在培美曲塞用药前1周开始口服叶酸400 μg/d,直至治疗结束后21天停止;在培美曲塞用药前1周应用维生素B121000 μg肌内注射,每9周1次;在培美曲塞用药前1天、当天及第2天均口服地塞米松片,每次4 mg,每天2次。联合化疗后单药培美曲塞(500 mg/m2,静脉滴注,第1天)维持治疗,每3~4周为1个周期,直至疾病进展,每周期复查血常规、生化全项及心电图。
1.3 观察指标及评价标准
观察所有患者的近期疗效、无进展生存期(progression-free survival,PFS)、1年生存率、2年生存率、3年生存率及不良反应发生情况。
收集患者治疗前1个月内的影像学资料作为基线,每2个周期化疗后进行影像学复查以评估疗效。参照实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)1.1版[3]进行疗效评估,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)、疾病进展(progressive disease,PD),总有效率(objective response rate,ORR)=(CR+PR)例数/总例数×100%,疾病控制率(disease control rate,DCR)=(CR+PR+SD)例数/总例数×100%。PFS定义为首次联合化疗开始至出现有客观证据证明疾病进展或任何原因导致患者死亡的时间。不良反应参照常见不良反应事件评价标准4.0版[4]进行评价:0级,无不良反应;1级,轻度不良反应;2级,中度不良反应;3级,重度不良反应;4级,威胁患者生命的不良反应。随访截止时间为2018年2月,中位随访时间为36个月(20~65个月)。
1.4 统计学方法
采用SPSS 17.0统计软件对数据进行统计分析。计数资料以例数和率(%)表示,以PFS为因变量,以临床特征为自变量,采用Kaplan-Meier进行生存分析。以P<0.05为差异有统计学意义。
2 结果
2.1 生存情况
截至2018年2月,29例晚期肺腺癌患者中,一线培美曲塞联合铂类治疗27例,二线培美曲塞联合铂类治疗2例;联合化疗后疗效评价无CR患者,PR 12例(41.4%),SD 17例(58.6%),ORR为41.4%,DCR为100%;中位维持治疗周期数为22个周期(9~59个周期),中位PFS为32个月(95%CI:27.998~36.002)(图 1)。至随访结束时,7例(24.1%)患者死亡,11例(37.9%)患者仍在接受单药培美曲塞维持治疗,4例(13.8%)患者接受了靶向药物治疗,2例(6.9%)患者进行对症治疗,4例(13.8%)患者调整化疗方案治疗,1例(3.4%)患者接受局部姑息放疗。29例患者的1年生存率为100%,2年生存率为100%,3年生存率为87%。
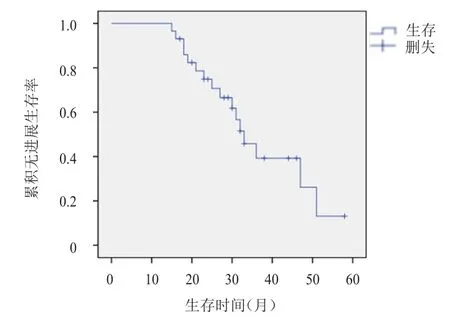
图1 29例晚期肺腺癌患者的无进展生存曲线
2.2 晚期肺腺癌患者PFS影响因素的单因素分析
单因素分析结果显示,不同年龄、性别、吸烟状况、肿瘤分期、基因突变情况、联合化疗疗效、治疗线数的培美曲塞长期维持治疗晚期肺腺癌患者的中位PFS比较,差异均无统计学意义(P>0.05)。不同联合化疗周期数、联合化疗最佳疗效时周期数的培美曲塞长期维持治疗晚期肺腺癌患者的中位PFS比较,差异均有统计学意义(P<0.05)。(表1)
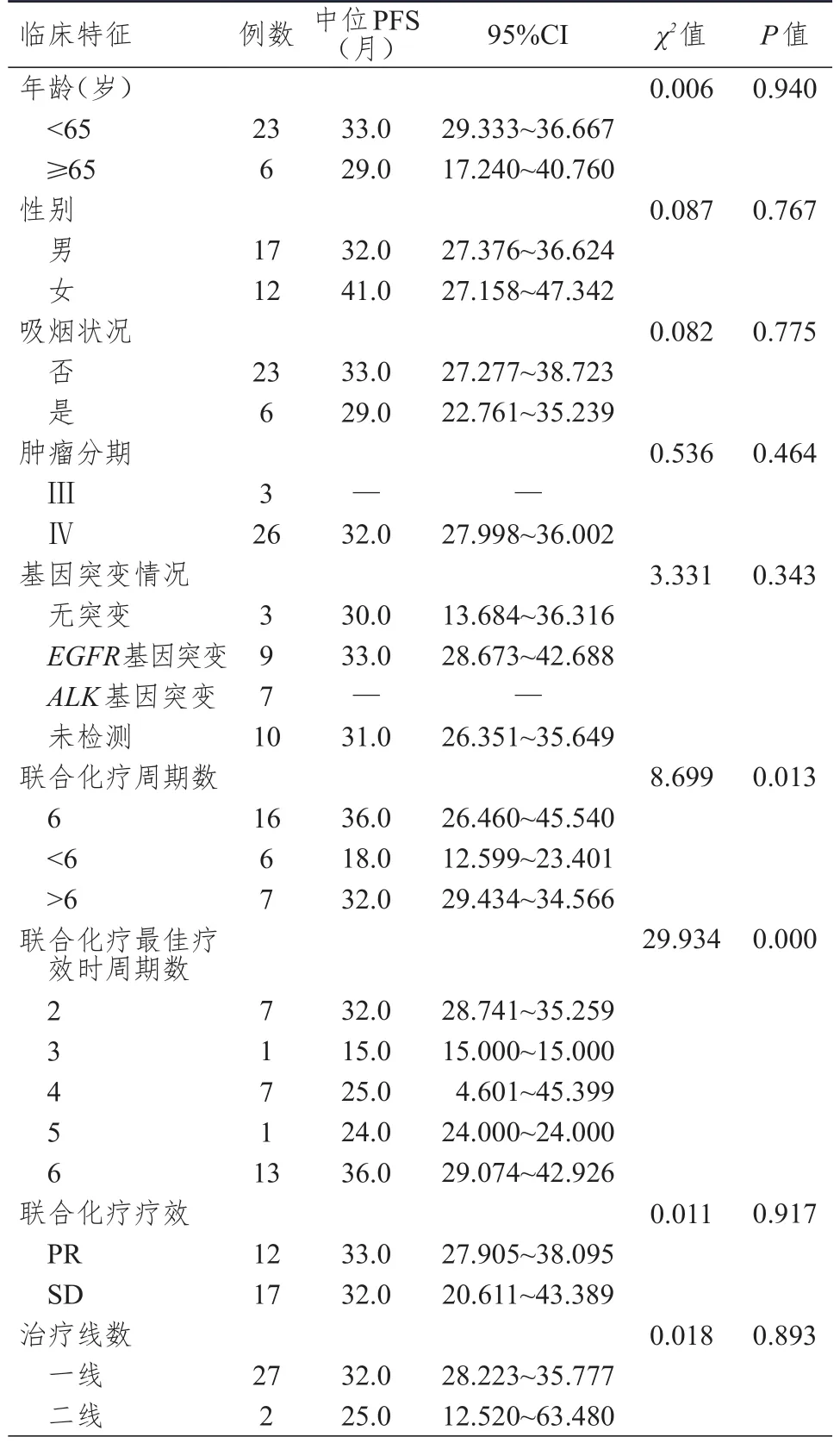
表1 29例晚期肺腺癌患者PFS影响因素的单因素分析
2.3 不良反应发生情况
本组患者常见的化疗相关不良反应主要包括血液学毒性(白细胞降低、中性粒细胞降低、血小板降低、贫血)、消化道反应(恶心、呕吐)及转氨酶升高。3~4级化疗相关不良反应主要为血液学毒性和消化道反应,多发生于联合化疗期间,其中含顺铂化疗方案导致的相关不良反应所占比例较多。维持治疗期间最常见的不良反应为转氨酶升高,但均为1~2级不良反应,少见的不良反应为皮疹、色素沉着、末梢神经炎等,经对症治疗后均能恢复正常。无因化疗相关不良反应死亡的病例。(表2)

表2 29例晚期肺腺癌患者培美曲塞联合化疗阶段及维持化疗阶段的不良反应发生情况[n(%)]
3 讨论
培美曲塞是一种新型的多靶点抗叶酸药物,作用于叶酸依赖性代谢途径中的多个酶,包括胸苷酸合成酶(thymidylate synthetase,TS)、二氢叶酸还原酶(dihytofolate reductase,DHFR)及甘氨酰胺核苷甲酰基转移酶(glycine nucleosides formyltransferase,GARFT)等。通过多靶点抑制上述关键酶活性,可以导致嘌呤和嘧啶合成障碍,使肿瘤细胞的增殖停滞于S期,从而控制肿瘤细胞的生长[5]。多项大型Ⅲ期临床研究结果均显示,培美曲塞作为一线治疗、维持治疗及二线治疗药物均显示出良好的疗效[6-9]。Yang等[10]对JMDB研究[6]中的东亚人群(中国台湾和韩国)进行亚组分析,结果显示东亚人群中生存数据与总人群结果相同,培美曲塞联合顺铂方案治疗可以延长非鳞非小细胞肺癌患者的生存期,培美曲塞联合顺铂方案治疗患者的中位PFS和中位总生存期分别为5.6、17.1个月,吉西他滨联合顺铂方案治疗患者的中位PFS和中位总生存期分别为5.5、16.5个月。胡兴胜等[11]报道,培美曲塞联合顺铂方案(PP组)一线治疗晚期非小细胞肺癌的总缓解率与吉西他滨联合顺铂方案(GP组)比较,差异无统计学意义(P>0.05);但在亚组分析中,PP组中非鳞癌患者及腺癌患者的总缓解率高于GP组,差异有统计学意义(P<0.05),且PP组的不良反应发生率低,因而PP组有较好的疗效和较轻的不良反应。
晚期非鳞非小细胞肺癌患者一线治疗及二线治疗后,培美曲塞被证实是有效的维持治疗药物之一[12]。维持治疗的理论基础是Goldie和Coldman假说,该理论认为早期使用非交叉耐药药物可以在耐药性产生前增加杀伤肿瘤细胞的效能,使治疗效果最优化[13]。对晚期非小细胞肺癌进行维持治疗是近年来肺癌治疗的研究热点[14]。JMEN研究[8]显示,一线含铂双药化疗方案治疗4个周期后,未出现疾病进展的非鳞非小细胞肺癌患者接受培美曲塞维持治疗后,患者的中位PFS为4.5个月。2009年美国国立综合癌症网络指南[15]开始推荐在经过一线含铂类药物联合方案或单药4~6个周期化疗后疾病获得有效控制或稳定的非小细胞肺癌患者,可继续原方案治疗或改用培美曲塞维持化疗直至疾病进展。PARAMOUNT研究[16-17]表明,经培美曲塞联合顺铂诱导治疗的晚期非鳞非小细胞肺癌患者接受培美曲塞维持治疗是有效的,且耐受性良好。中国原发性肺癌诊疗规范(2015版)[18]推荐含铂两药方案是标准的一线化疗方案,对一线治疗达到疾病控制(CR+PR+SD)的患者,可以选择维持治疗[同药维持:循证医学证据支持的药物有培美曲塞(非鳞癌)和吉西他滨;换药维持:循证医学证据支持的药物有培美曲塞(非鳞癌),对于EGFR基因敏感突变患者可以选择表皮生长因子受体-酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor,EGFR-TKI)]。但CONVINCE研究[19]结果显示,与化疗(顺铂/培美曲塞一线化疗后培美曲塞维持治疗)相比,埃克替尼一线治疗可以明显延长EGFR基因敏感突变的肺腺癌患者的中位PFS(9.9个月vs7.3个月),且耐受性良好。
本研究对培美曲塞联合铂类行一线或二线联合化疗后获得疾病控制的晚期肺腺癌患者行培美曲塞长期维持治疗的病例进行了分析,结果显示联合化疗后无CR患者,PR 12例(41.4%),SD 17例(58.6%),ORR为41.4%,DCR为100%,中位PFS为32个月(95%CI:27.998~36.002),分析时7例患者死亡,入组29例患者中位生存时间未达到,1年生存率为100%,2年生存率为100%,3年生存率为87%。本研究结果较同药维持试验PARAMOUNT研究中维持组的中位PFS 7.4个月、1年生存率58%、2年生存率32%均显著提高,PARAMOUNT研究中联合化疗为4个周期,本研究中联合化疗周期数为3~8个周期;本研究中单因素分析结果显示,不同联合化疗周期数晚期肺腺癌患者的中位PFS比较,差异有统计学意义(P<0.05),联合化疗周期数为6个周期时患者的中位PFS达到36.0个月,考虑一线联合化疗4~6个周期期间经常可见肿瘤缩小,且与本研究选取病例均为联合化疗后单药培美曲塞维持治疗超过18个月的患者有关[20]。PARAMOUNT研究中,联合化疗时取得不同最佳疗效的患者从维持治疗中获益一致,与本研究一致。本研究结果显示,不同联合化疗最佳疗效时周期数晚期肺腺癌患者的中位PFS比较,差异有统计学意义(P<0.05),联合化疗6周期时取得最佳疗效患者的中位PFS为36.0个月,明显长于2~5个周期时的中位PFS,究其原因可能与入组患者联合化疗6个周期的占比较高有关。冯婷婷等[21]报道,应用培美曲塞一线治疗不吸烟晚期肺腺癌患者的远期疗效明显优于吸烟患者,其可能机制为吸烟所致基因突变发生率增加,导致培美曲塞化疗敏感性下降。本研究结果显示,不吸烟患者的中位PFS为33.0个月,而吸烟患者的中位PFS为29.0个月,不同吸烟状况晚期肺腺癌患者的中位PFS比较,差异无统计学意义(P>0.05),究其原因可能与本研究入组病例数少有关。陈梦阁等[22]报道,培美曲塞联合铂类化疗的PFS与性别、年龄、吸烟、肿瘤分期及铂类药物的种类均无关,ALK基因断裂融合是PFS相关的唯一变量,本研究中单因素分析也显示年龄、性别、肿瘤分期、诱导化疗周期数、治疗线数等因素对PFS的影响均无统计学差异,且基因突变状态对PFS的影响也无统计学差异,但本组患者中单药培美曲塞维持治疗时间最长的3例患者(分别为65、48、47个周期)均伴有ALK突变,可能与入组病例数少和未检测比例(34.5%)高有关。
本组患者常见的化疗相关不良反应主要包括中性粒细胞降低、贫血、白细胞降低、血小板降低、恶心、呕吐、转氨酶升高。而CONVINCE研究[19]显示,化疗组的主要不良反应包括中性粒细胞降低(77.4%)、贫血(76.6%)、白细胞降低(70.1%)、恶心(54.7%)及转氨酶升高(40.1%)等。在中性粒细胞及白细胞降低、恶心及转氨酶升高方面,CONVINCE研究与本研究基本一致,而贫血的发生率方面,CONVINCE研究较本研究明显升高,考虑可能与本研究入组的男性患者(58.6%)及<65岁患者(79.3%)所占比例较多有关。
综上所述,培美曲塞联合铂类方案化疗后单药培美曲塞维持治疗晚期肺腺癌是安全、有效的,且不良反应轻。但本文为回顾性研究,不排除选择偏倚和样本量小等因素的影响,但结论与大样本、多中心、前瞻性研究结果一致,为真实肿瘤世界中患者的治疗提供明确依据。

