Trop-2基因在肝癌组织中的表达及对HepG 2细胞增殖的影响
张健,马海#,杨柳,杨红春,何振兴
南充市中心医院1普外科,2呼吸内科,四川 南充637000
肝癌为临床常见的一种恶性肿瘤,在过去20年中,全世界肝癌的发病率和病死率均增长了约1倍[1]。在中国,肝癌的发病率和病死率分别居恶性肿瘤第3位和第2位,严重威胁着人们的生命健康[2]。肿瘤相关钙信号转导蛋白2(tumor-associated calcium signal transducer 2,Trop-2)是GA733基因家族中的一个细胞表面受体,负责转导Ca2+信号[3]。相关研究表明,Trop-2在肺腺癌、胃癌和卵巢浆液性囊腺癌等多种恶性肿瘤中高表达,且其高表达能够促进肿瘤的生长,与患者的预后不良有关[4-6]。Trop-2高表达可能参与肿瘤的恶性生物学行为,但其在肝癌中的作用及作用机制尚不明确。蛋白激酶 C-α(protein kinase C alpha,PKC-α)作为上游调节因子,通过磷酸化核因子κB抑制因子(inhibitor of nuclear factor kappa B,IκB)激活核因子-κB(nuclear factor of kappa B,NF-κB),从而促进卵巢癌的发展[7]。本研究探究了Trop-2基因在肝癌组织和肝癌细胞中的表达情况,并进一步探究了其对肝癌细胞增殖的影响,旨在为肝癌的预后和靶点治疗提供理论依据。
1 材料与方法
1.1 材料
选取2016—2017年于南充市中心医院行手术切除的10例肝癌患者的肝癌组织标本和癌旁正常组织标本,所有患者在手术之前均未接受任何治疗。人肝癌细胞株HepG2、人高转移肝癌细胞株HCCLM3和人正常肝细胞株HL-7702均购自武汉普诺赛公司。
1.2 主要试剂与仪器
DMEM培养基和双抗(青霉素和链霉素)均购自美国Hyclone公司,南美胎牛血清购自美国Hyclone公司,PE Mouse Anti-Human Trop-2(564837)、Cycletest Plus DNA Reagent kit均购自美国BD生物公司,兔抗人Trop-2、兔抗人PKC-α、兔抗人p-PKC-α和兔抗人NF-κB抗体均购自美国Abcam公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔免疫球蛋白G(immunoglobulin G,IgG)二抗购自美国CST公司,总RNA提取试剂盒、CCK-8试剂盒均购自北京索莱宝科技有限公司,Prime-ScriptTMRT reagent kit、SYBR Premix Ex TaqTMⅡ试剂盒均购自宝生物工程(大连)有限公司,Trop-2和β-acting引物均由生工生物工程(上海)股份有限公司合成。TDZ4-WS型台式低速离心机购自长沙湘仪离心机仪器有限公司,MCO-15AC型二氧化碳培养箱购自三洋电机国际贸易有限公司,酶标仪(Multlskan)购自赛默飞世尔仪器有限公司,Cytoflex型流式分析仪购自美国Beckman公司。
1.3 Trop-2 siRNA引物序列设计
在GeneBank中查找Trop-2的基因序列,设计Trop-2siRNA和无关序列的寡核苷酸。Trop-2siRNA上游引物:5'-CACCTTCAAGACGTTTTTTG-3',下游引物:5'-AGCTCAAAAAACGTCTTGAA-3';阴性对照siRNA上游引物:5'-UUCUCCGAACGUGUCACGUTT-3',下游引物:5'-ACGUGACACGUUCGGAGAATT-3'。以上引物序列由生工生物工程(上海)股份有限公司合成。
1.4 细胞培养及转染
将人肝癌细胞HepG2、人高转移肝癌细胞HCCLM3和人正常肝细胞HL-7702分别接种于含10%胎牛血清的DMEM培养基中,置于5%CO2、37℃培养箱中培养。待细胞融合度达80%时,进行传代培养或进行实验。收集处于对数生长期的HepG2细胞,分为3组:空白对照组,仅添加Lipofectamine 2000不做转染的HepG2细胞;阴性对照组,转染无关序列的HepG2细胞;Trop-2siRNA组,转染Trop-2siRNA序列的HepG2细胞。采用Lipofectamine 2000进行转染,6 h后更换培养液,24 h后收集细胞进行后续实验。细胞转染步骤严格参照试剂盒操作说明书进行。
1.5 免疫组织化学染色法检测不同组织中Trop-2蛋白的表达情况
取肝癌组织和癌旁正常组织,常规石蜡包埋切片后,65℃烤片30 min,二甲苯脱蜡,梯度乙醇脱水。3%过氧化氢室温浸泡15 min后,采用磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗3次,每次5 min,滴加5%牛血清蛋白封闭液,置于37℃培养箱中培养30 min,吸去多余液体,滴加1∶100稀释的Trop-2一抗,4℃冰箱过夜。37℃培养箱复温30 min,PBS清洗3次,每次5 min。滴加IgG,37℃培养箱孵育30 min后,PBS冲洗3次,每次5 min。滴加链霉抗生物素蛋白-生物素-过氧化物酶复 合 物(streptavidin-biotin-peroxidase complex,SABC)试剂,37℃培养箱孵育30 min后PBS清洗3次,每次5 min。3,3’-二氨基联苯胺(3,3’-diaminobenzidine,DAB)显色5 min(显微镜下控制),使细胞质均匀着黄棕色,自来水终止显色,苏木素复染细胞核2~3 min,水洗,1%盐酸乙醇分化(快速),梯度乙醇脱水,二甲苯透明,中性光学树脂封片。采用PBS替代一抗作为阴性对照组。使用IPP 6.0软件对免疫组化图片进行积分光密度值(integral optical density,IOD)检测。
1.6 实时荧光定量PCR检测不同组织中Trop-2 mRNA表达
采用总RNA提取试剂提取肝癌组织及癌旁正常组织中的总RNA,使用逆转录试剂盒Prime-Script™RT reagent kit进行逆转录,制备 cDNA,各cDNA样品分别用下列引物进行实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)。Trop-2上游引物:5'-CCTCATCGCCGTCATCGT-3';下游引物:5'-CGGTTCCTTTCTCAACTCCC-3'。β-actin上游引物:5'-CACGAAACTACCTTCAACTCC-3';下游引物:5'-CATACTCCTGCTTGCTGATC-3'。反应体系12.5 μl:SYBR Premix Ex TaqTMⅡ 6.25 μl、上游引物0.5 μl、下游引物 0.5 μl、双蒸水 4.25 μl、cDNA 1 μl;反应条件:95℃预变性3 min;95℃变性10 s,60℃退火30 s,72℃延伸30 s,共25个循环。以βactin为内参,以2-ΔΔCt法计算肝癌组织及癌旁正常组织中Trop-2mRNA的相对表达量。实验重复3次。
1.7 流式细胞术检测不同细胞中Trop-2蛋白表达
取对数生长期的未经转染的HepG2、HCCLM3和HL-7702细胞,接种于DMEM培养基中培养至融合度达80%时收集细胞,参照FIX/PERM试剂盒操作说明书,在培养液中加入100 ml Reagent A室温孵育10 min,400g离心5 min,吸弃上清液;采用适量PBS洗涤2次,每次3 min,350g离心5 min,吸弃上清液,加入100 μl Reagent B混匀后,加入PE Mouse Anti-Human Trop-2,避光混匀,4℃避光反应30 min,PBS洗涤2次,每次3 min,350g离心5 min,吸弃上清液,加入1%多聚甲醛重悬细胞后,采用流式细胞仪检测HepG2细胞、HCCLM3细胞及HL-7702细胞中Trop-2蛋白的表达水平。实验重复3次。
1.8 蛋白质印迹法(Westernblot)检测蛋白表达量
1.8.1 不同组织中相关蛋白检测 肝癌组织和癌旁正常组织中相关蛋白检测:取适当大小的组织块,加入300 L细胞裂解液,置于冰上裂解30 min,其间在涡旋器上进行充分混合;然后以12 000 r/min于4℃离心20 min,收集上清液。采用二喹啉甲酸(bicinchoninic acid,BCA)法进行蛋白质定性,每4 μl蛋白质样品中加入1 μl十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)蛋白上样缓冲液(5×),混合蛋白质样品和缓冲液,煮沸5 min,样品于-20℃保存备用。使用等量蛋白质上样,选择10%SDS-PAGE进行分离,分离后的蛋白质转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,用5%的脱脂奶粉封闭1 h,封闭结束后结合一抗(Trop-2、PKC-α、p-PKC-α、NF-κB和β-actin均按1∶400稀释),4℃孵育过夜后TBST清洗,然后加入二抗(稀释比例均为1∶5000)室温孵育1 h,TBST清洗,ECL暗室显色。显色后的蛋白使用Bio-Rad全功能成像系统采集图像,Image-ProPlus分析光密度,以β-actin为内参,检测肝癌组织和癌旁组织中NF-κB、PKC-α、p-PKC-α、Trop-2的相对表达量。实验重复3次。
1.8.2 不同细胞中相关蛋白检测 收集处于对数生长期的未经转染的HepG2、HCCLM3、HL-7702细胞和转染后的空白对照组、阴性对照组、Trop-2siRNA组HepG2细胞,预冷PBS冲洗2次,每次3 min,每孔加入约100 μl全细胞蛋白质裂解液,振荡混匀,置冰上10 min后将细胞收集于1.5 ml离心管中。裂解体系在冰上进行超声作用,每次3 s,共3次,每次间隔1 s,超声后的裂解体系于4℃、13 000 r/min离心5 min并收集上清。用BCA法进行蛋白质定量。其余操作方法同“1.8.1”。计算未经转染的HepG2、HCCLM3和HL-7702细胞中Trop-2的相对表达量及空白对照组、阴性对照组、Trop-2siRNA组HepG2细胞中Trop-2、NF-κB、PKC-α和p-PKC-α蛋白的相对表达量。实验重复3次。
1.9 CCK-8法检测细胞增殖率
取处于对数生长期的阴性对照组、Trop-2siRNA组HepG2细胞,调整细胞浓度为4×104/ml,接种于96孔板中,继续培养24 h后,每孔加入10 μl CCK-8,4 h后终止培养,采用酶标仪于450 nm波长下测定细胞吸光度值。实验重复3次。
1.10 统计学分析
采用SPSS 20.0软件对数据进行分析。符合正态分布的计量资料以均数±标准差(±s)表示,两组间比较采用独立样本t检验,3组间比较用单因素方差分析(ANOVA-LSD);计数资料以例数表示。以P<0.05为差异有统计学意义。
2 结果
2.1 不同组织中Trop-2蛋白表达水平的比较
免疫组织化学染色结果显示:肝癌组织细胞质中浅黄色颗粒较多,癌旁正常组织细胞质中浅黄色颗粒极少(图1)。IPP6.0软件对免疫组织化学染色图片进行IOD检测,结果显示:肝癌组织中Trop-2蛋白的相对表达量为(0.27±0.01),明显高于癌旁正常组织的(0.23±0.01),差异有统计学意义(t=12.637,P<0.01)。
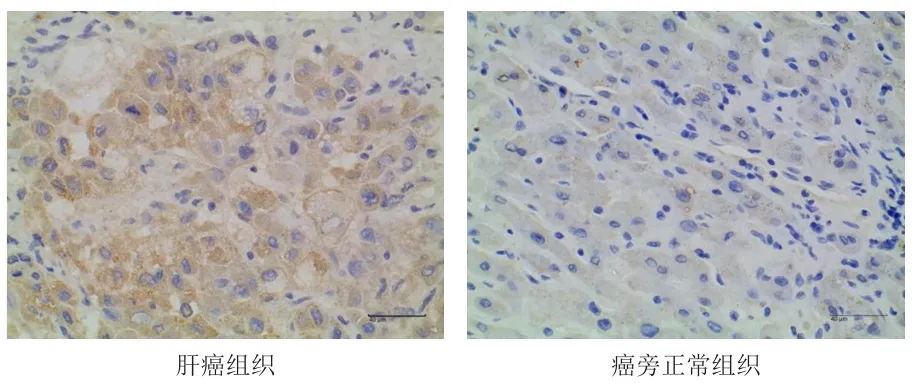
图1 肝癌组织和癌旁正常组织中Trop-2蛋白的表达情况(免疫组织化学染色法,×400)
2.2 不同组织中Trop-2 mRNA表达水平的比较
qRT-PCR检测结果显示:肝癌组织中Trop-2mRNA的相对表达量为(5.60±1.19),明显高于癌旁正常组织的(0.98±0.18),差异有统计学意义(t=12.066,P<0.01)。
2.3 不同细胞中Trop-2蛋白的表达情况
流式细胞术检测结果显示:HCCLM3细胞和HepG2细胞中Trop-2蛋白的相对表达量分别为(91.21±2.50)%、(94.14±2.36)%,均明显高于HL-7702细胞的(7.97±1.50)%,差异均有统计学意义(t=49.550、53.440,P<0.01)(图2)。Western blot检测结果显示,HCCLM3细胞和HepG2细胞中Trop-2蛋白的相对表达量分别为(0.91±0.08)、(0.81±0.04),均高于HL-7702细胞的(0.67±0.06),差异均有统计学意义(t=4.157、3.363,P<0.05)(图3)。

图2 流式细胞术检测Trop-2蛋白在未经转染的 3种细胞中的表达情况

图3 Western blot检测Trop-2蛋白在未经转染的 3种细胞中的表达情况
2.4 Westernblot检测不同组织中相关蛋白的表达
肝癌组织中p-PKC-α、NF-κB和Trop-2蛋白的相对表达量均明显高于癌旁正常组织,差异均有统计学意义(P<0.01)。肝癌组织中PKC-α蛋白的相对表达量与癌旁正常组织比较,差异无统计学意义(P>0.05)。(表1)
表1 不同组织中相关蛋白表达水平的比较(±s)
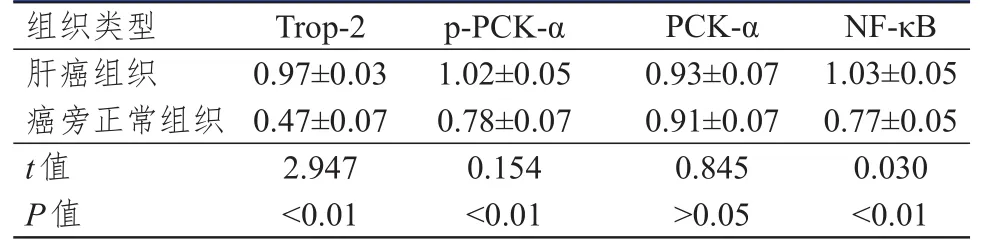
表1 不同组织中相关蛋白表达水平的比较(±s)
组织类型肝癌组织癌旁正常组织t值P值0.97±0.03 0.47±0.07 2.947<0.01 1.02±0.05 0.78±0.07 0.154<0.01 0.93±0.07 0.91±0.07 0.845>0.05 1.03±0.05 0.77±0.05 0.030<0.01 Trop-2 p-PCK-α PCK-α NF-κB
2.5 沉默Trop-2对肝癌HepG 2细胞相关蛋白的影响
Western blot检测结果显示:Trop-2siRNA组HepG2细胞中Trop-2、p-PKC-α、PKC-α和NF-κB蛋白的相对表达量均低于空白对照组和阴性对照组,差异均有统计学意义(P<0.05);阴性对照组HepG2细胞中Trop-2、p-PKC-α、PKC-α和NF-κB蛋白的相对表达量与空白对照组比较,差异均无统计学意义(P>0.05)。(表2)
表2 不同组别HepG 2细胞中相关蛋白表达水平的比较(±s)

表2 不同组别HepG 2细胞中相关蛋白表达水平的比较(±s)
注:a与空白对照组比较,P<0.05;b与阴性对照组比较,P<0.05
组别空白对照组阴性对照组Trop-2 siRNA组1.03±0.08 1.02±0.11 0.81±0.10a b 0.98±0.03 1.02±0.11 0.71±0.12a b0.97±0.03 0.93±0.09 0.78±0.06a b 1.00±0.00 0.98±0.10 0.73±0.11a b Trop-2 p-PCK-α PCK-α NF-κB
2.6 沉默Trop-2对肝癌HepG 2细胞增殖的影响
CCK-8法检测结果显示:Trop-2siRNA组HepG2细胞的增殖率为(76.953±9.043)%,低于阴性对照组的(96.940±15.752)%,差异有统计学意义(t=6.564,P<0.05)。
3 讨论
Trop-2由Lipinski在1981年首次从滋养层细胞膜上发现,并证实其在正常组织中几乎不表达。乔宇[8]在对影响直肠癌转移及预后的因子进行分析时发现,Trop-2在直肠癌组织中的表达水平明显高于癌旁组织,且与患者的肿瘤分期、淋巴结转移和远处转移情况有关。Heist等[9]对肺癌患者行Trop-2抗体联合肿瘤药物治疗,结果显示该联合方案治疗可以延缓患者的病情进展。目前,关于Trop-2在肝癌发生发展中作用机制的研究尚少。因此,本研究对Trop-2在肝癌组织和细胞中的表达情况进行研究,结果显示,肝癌组织中Trop-2蛋白和mRNA的相对表达量均高于癌旁正常组织(P<0.05);流式细胞术和Western blot法对人肝癌细胞株HepG2、人高转移肝癌细胞株HCCLM3和人正常肝细胞株HL-7702中Trop-2蛋白的表达水平进行检测,结果显示HepG2细胞和HCCLM3细胞中Trop-2蛋白的相对表达量均高于HL-7702细胞(P<0.05)。提示Trop-2可能促进肝癌细胞的恶性增殖或迁移,可作为肝癌预后的标志基因。为了验证这一推测,本研究采用RNA干扰技术沉默细胞中Trop-2基因表达,结果发现Trop-2沉默后,HepG2细胞增殖率被显著性降低。进一步说明了Trop-2可能参与了肝癌的发生、发展,可以作为肝癌预后的标志基因。本研究上述结果也与乳腺癌、肺癌和头颈部鳞状细胞癌等恶性肿瘤报道的结果相一致[10-11]。
Trop-2作为一种跨膜钙信号传感器,能够与PKC-α催化区结合,并磷酸化细胞质中的PKC-α,使其转移至细胞膜并激活下游其他蛋白[12]。本研究采用Western blot法检测不同组织中PKC-α和p-PKC-α的表达情况,结果发现肝癌组织中p-PKC-α蛋白的相对表达量明显高于癌旁组织(P<0.01),但两种组织中PKC-α蛋白的相对表达量比较,差异无统计学意义(P>0.05)。提示PKC-α可能是Trop-2的下游基因,过表达的Trop-2与PKC-α相结合,可以促进其激活。也有学者推测,Trop-2与PKC-α之间是一种正反馈调节,Trop-2被激活后,促使更多的PKC-α被磷酸化,而p-PKC-α又促进Trop-2的激活,这种正反馈调节在细胞凋亡过程中发挥着重要作用[13]。正常生理条件下,NF-κB与抑制因子IκBα在细胞质中形成复合物,其功能活性被抑制;当受到上游配体或细胞外刺激激活后,IκB蛋白激酶复合物(inhibitor of nuclear factor kappa-B kinase,IKK)进入细胞核,调节相关因子表达。庞雪莲[14]对PKC-α与NF-κB在食管癌中的关系进行研究,结果显示PKC-α被磷酸化后,可以激活NF-κB上游激酶IKK,最终激活NF-κB,提高肿瘤细胞的迁移能力。本研究采用蛋Western blot法对肝癌组织和癌旁正常组织中NF-κB的表达水平进行检测,结果显示,与癌旁正常组织相比,肝癌组织中NF-κB的相对表达量明显增高(P<0.01)。提示在肝癌组织中被激活的PKC-α可能同样激活了NF-κB。上述研究表明,Trop-2可能通过调控PKC-α/NF-κB通路影响肝癌的发生、发展。为了进一步验证Trop-2对PKC-α和NF-κB的影响,本研究采用Trop-2siRNA干扰Trop-2表达,结果显示:Trop-2siRNA组HepG2细胞中p-PKC-α、PKC-α和NF-κB蛋白的相对表达量均低于空白对照组和阴性对照组,表明Trop-2是PKC-α-NF-κB通路的上游基因。
综上所述,Trop-2在肝癌组织中高表达,其可能通过PKC-α/NF-κB通路调控肝癌的发生发展,通过靶向沉默Trop-2可以抑制肝癌细胞的增殖,但其具体调节机制还需要更进一步的深入了解和研究。

