早期肠内营养支持治疗小儿胃肠功能障碍的价值
杨婷莉,包龙梅,贺永锋,周西
胃肠功能障碍多为胃肠道疾病的伴随症状,其作为一种独立诊断术语在临床上研究甚少[1]。国内赵祥文等首次提出“胃肠功能障碍”这一概念[2],从理论上对此病症进行了论述。胃肠功能障碍是多器官衰竭功能障碍综合征的一种,严重胃肠损伤是引起器官衰竭的诱因。临床上一旦出现胃肠功能障碍,治疗难度大,死亡率高[3]。既往多项资料证实对于胃肠功能障碍患儿,肠内营养有助于保护胃肠黏膜,促进胃肠功能恢复[4-5]。但对于治疗时机的选择,临床仍未形成规范意见。本文对安康市中心医院、西安交通大学第二附属医院80例胃肠功能障碍患儿临床资料进行回顾性分析,探讨肠内早期营养支持不同干预时机的临床应用价值,现报道如下。
1 资料与方法
1.1 一般资料
收集2017年2月至2019年2月安康市中心医院、西安交通大学第二附属医院收治的80例胃肠功能障碍患儿的临床资料。纳入标准:①出现腹胀、肠鸣音消失或呕吐咖啡样液体即可明确诊断[6];②小儿危重病例评分(PCIS)78~90分;③均在安康市中心医院、西安交通大学第二附属医院接受早期肠内营养支持,且病历资料完整。排除标准:①合并有其他胃肠道疾病者;②既往有精神意识障碍病史者;③对治疗药物禁忌者;④心、肝、肾功能严重不全者。本研究经两院医学伦理委员会批准。根据肠内营养干预时机不同将80例患者分为观察组(发生胃肠功能障碍2 d内给予肠内营养,40例)和对照组(发生胃肠功能障碍2 d后7 d内给予肠内营养,40例)。两组性别、年龄、小儿危重病例评分、临床症状等基本资料比较,差异均无统计学意义(P>0.05),见表1。
1.2 治疗方案
患者入院确诊后均进行基础治疗:①病原菌检测,并依据检测结果给予抗生素干预,控制感染;② 胃肠减压,补充电解质,吸出消化道滞留液体和气体,依据患者电解质状态,进行针对性干预;③ 皮下注射新斯的明(上海信谊金朱药业有限公司,国药准字H31022770,2 mL/支)0.045~0.06 mg/kg,静滴酚妥拉明(上海旭东海普药业有限公司,国药准字H31020589,1ml/支)0.2~0.5 mg/kg,3~4次/d;④对于病情严重者给予呼吸机辅助呼吸或激素甲基强的松龙干预。两组患者均接受肠内营养:营养配方:能量密度70 kcal/100 mL,100%乳清蛋白质,50%中链甘油三酯及100%肽类。根据公式:热量=年龄×系数+1 000计算每日所需热量[7],ICU肠内营养支持的患儿为公式推荐热量的25%,过渡至普食营养患儿每日热量为推荐剂量的60%。以鼻饲胃管输注,间歇推注,起始剂量1 mL/kg/次,每3 h/次,根据患儿耐受情况可逐渐加量,待胃内回抽奶量>30%则可持续24 h输注。观察组患者在确诊后2 d内即开始肠内营养,对照组患者在患儿病情稳定,确诊后3~7 d开始肠内营养支持。
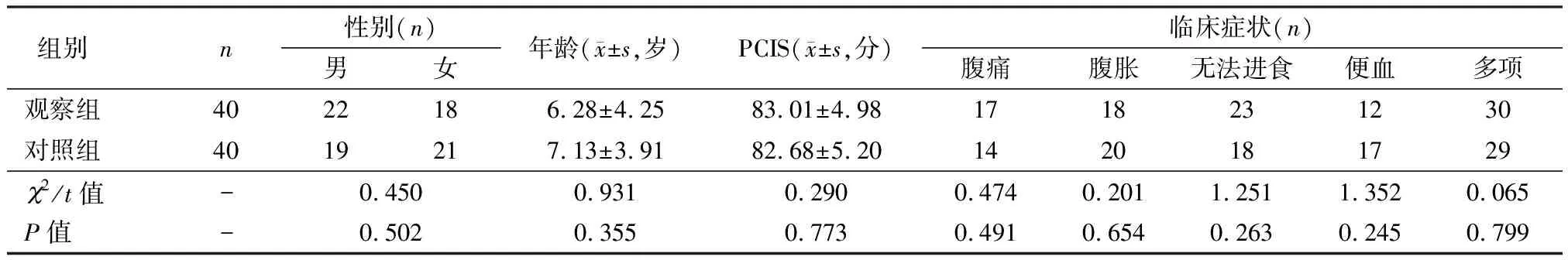
表1 两组基本资料比较
1.3 观察指标
1.3.1 疗效评价标准 在肠内营养干预结束后评定疗效[8],显效:临床症状体征消失,肠鸣音恢复,无其他并发症及不良反应;有效:临床症状减轻,肠鸣音增强,对基本生活无较大影响;无效:有并发症产生,临床症状仍然存在,病情无缓解或者加重。以(显效+有效)/n×100%计算总有效率。
1.3.2 实验室指标 分别在干预前(入院确诊后24 h内)和干预后(肠内营养干预结束后24 h内)采集空腹取静脉血3~5 mL,检测患儿血浆D-乳酸、二胺氧化酶(DAO)活性及血清瓜氨酸水平。血浆-乳酸和DAO活性水平均采用分光光度法检测,血清瓜氨酸水平采用高效液相色谱法检测。分别在干预前后取肘静脉血3~5 mL,采用CM-800型全自动生化分析仪免疫比浊法检测并比较两组患者血清白蛋白(Alb)、血清前白蛋白(PA)及转铁蛋白(TRF),试剂盒均由宁波普瑞柏生物技术有限公司提供,操作按试剂盒说明进行。所有检测均由西安交通大学第二附属医院检验科5年以上工作经验医师完成,并经检验科副主任医师读取数据。
1.3.3 不良反应 记录并两组患者干预期间腹胀腹泻、误吸、胃出血及呕吐等胃肠道不良反应发生情况。
1.4 统计学方法

2 结果
2.1 两组临床疗效比较
观察组总有效率为92.5%,显著高于对照组的75.0%,差异有统计学意义(P<0.05),见表2。
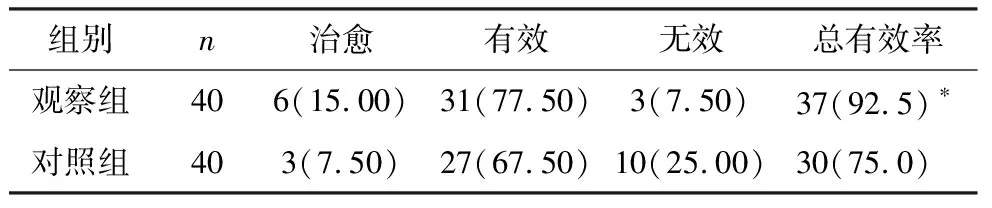
表2 两组临床疗效比较 [n(%)]

2.2 两组实验室指标比较
干预后观察组D-乳酸较干预前显著降低,DAO活性水平和血清瓜氨酸较干预前显著升高,差异均有统计学意义(P<0.05)。干预后观察组D-乳酸显著低于对照组,DAO活性水平和血清管氨酸水平显著高于对照组,差异均有统计学意义(P<0.05)。见表3。

表3 两组实验室指标比较
注:*与干预前比较,P<0.05
2.3 两组营养状态水平比较
干预后观察组Alb(39.23±2.28)g/L,显著高于对照组(35.01±3.47)g/L,差异有统计学意义(t=6.428,P=0.000)。干预后观察组PA和TRF分别为(195.62±28.45)mg/L和(4.21±1.38)g/L,均低于对照组的(178.55±24.13)mg/L和(3.21±1.05)g/L,差异均有统计学意义(t=2.894、3.647;P=0.005、0.001)。见图1。
2.4 两组不良反应发生率比较
两组肠内营养干预期间腹胀腹泻、误吸、胃出血及呕吐等不良反应总发生率比较,差异无统计学意义(P>0.05),见表4。
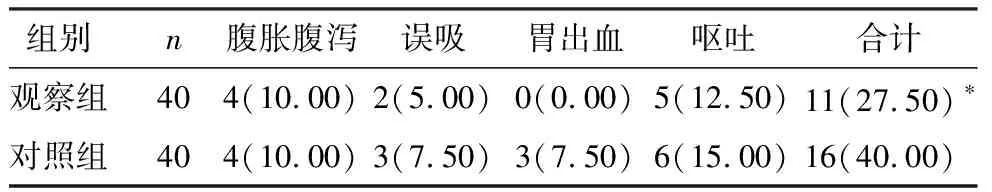
表4 两组不良反应发生率比较 [n(%)]

3 讨论
胃肠功能障碍患儿常伴有创伤窒息或免疫功能低下,是导致胃肠功能衰竭的重要诱因,使病情加重,预后不良。在胃肠道功能障碍发生后,可引起患儿肠道菌群感染,损伤胃肠道功能,干扰营养物质的吸收,甚至发生贫血和营养不良,使病情进一步复杂,增加治疗难度[9]。因而保护胃肠黏膜是胃肠功能障碍患儿主要的治疗内容。Pensabene L等[10]认为保持肠道微生态环境的稳定,纠正电解质紊乱状态,同时改善肠道血供,对促进胃肠功能的恢复具有重要意义,而肠内营养是保障胃肠功能障碍患儿的必要措施。
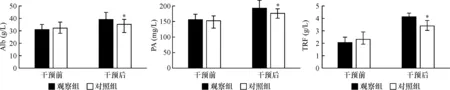
图1 两组干预前后Alb、PA、TRF水平比较 *与观察组比较,P<0.05
胃肠功能障碍患儿基础代谢率低,肠道储备功能差,尤其是对于危重患儿,如未能及时补充营养,使肠黏膜发生坏死和肠壁细胞损伤,会进一步影响血流动力学和分解代谢状态,使病情恶化[11-12]。指南也指出对于危重患儿,应首选肠内营养干预[13]。吴巍巍等[14]报道也认为对于严重烧伤引起的胃肠功能障碍患儿,肠内营养有助于改善患儿前白蛋白、Hb及血钾血钠等微量离子含量,促进患儿早期康复。TRF是血浆中主要的含铁蛋白质,在机体铁转运过程中发挥重要作用,TRF水平下降多提示机体贫血和营养不良[15]。本研究参照既往文献标准[8],进一步对比不同时机开展早期肠内营养支持患儿后的临床疗效,结果显示干预后观察组PA和TRF显著高于对照组,提示发病后2 d内早期肠内营养支持效果更为显著。这可能是因早期肠内营养支持干预能保护胃肠壁黏膜结构的完整性,增加胃肠蠕动,减少外界刺激对内脏血流和病理生理的影响[16]。朱莉军等[17]也认为早期干预能及时纠正患儿全身营养不良状况,有助于增强患儿对疾病的免疫抵抗力,这对改善患儿预后有积极作用。
D-乳酸是由肠道菌群代谢的产物,能特异性反映肠道通透性,张玮等[18]认为D-乳酸水平与肠黏膜受损程度具有显著相关性。DAO则是具有高度活性的细胞内酶,能较为敏感的反映肠道黏膜屏障功能[19]。本研究显示两组患者干预后血浆D-乳酸菌降低,DAO活性均增强,且观察组效果更明显,这可能是因早期肠内营养支持能改善患儿营养状况,缓解肠道炎症,进而发挥肠道黏膜屏障保护修复功能[20]。另外,本研究显示干预后观察组血清瓜氨酸水平显著升高,提示患者胃肠黏膜屏障功能得到修复,这也可能是早期肠内营养提高疗效的机制之一。另外,本研究显示不同时机进行肠内营养支持干预的患者不良反应发生率,差异无统计学意义,提示早期肠内营养干预具有较高的安全性。
综上,胃肠功能障碍患儿2 d内给与肠内营养支持干预疗效显著,有助于改善患儿营养状态,这可能与其调节血浆D-乳酸、DAO活性及血清瓜氨酸水平有关。

