甲基营养型芽孢杆菌的分离鉴定及其广谱抗菌性能初步研究
张可可,席宇,吴少雄,弓丽珊,阴红霞,刘人聚, 薛梦娟,张亚然,刘岩*
(1.郑州大学 生命科学学院,郑州 450001;2.河南省农业科学院 农业质量标准 与检测技术研究所,郑州 450002)
食源性致病菌通过食物等途径进入人体后大量繁殖并产生内毒素进而对人体健康造成损害。比如,蜡样芽孢杆菌能够导致食物腐败,并产生腹泻型肠毒素[1]、呕吐型肠毒素[2]、细胞毒素[3]、溶血素等多种毒素来危害人体健康[4,5],而大肠杆菌多利用黏附素使细菌定植于泌尿道和肠道,大量繁殖后产生多种外毒素。近年来,食品安全问题已成为当今世界性公共卫生热点[6,7]。因此,食源性疾病的防治已经迫在眉睫。
食品加工过程中可通过高温、高压、控制pH、紫外线和激光照射等物理方法减少或消除食源性致病菌的危害[8-11],然而设备昂贵,流程繁多,灭菌往往不彻底。利用化学消毒剂和防腐剂等物质抑制食源性致病菌的生长和繁殖也有一定的弊端,部分人群易产生抵触情绪[12,13]。如何选择合适的消毒防腐剂和控制最佳的用量已成为目前的最大难题,同时食品酿造行业中消毒剂等残留也可能留下食品安全隐患,因此,目前利用化学类消毒剂和防腐剂防治食源性致病菌并不是一种理想的方法。生物法是利用植物提取物或微生物代谢物抑制病原菌[14-20]。在理化手段受限的情况下,利用生物源天然抑菌物质来防治食源性致病菌已引起众多科研者的兴趣。芽孢杆菌可以分泌多种类型的天然抗菌活性物质,在食品加工行业具有潜在的用途[21-24]。本研究从烟田土壤中分离、鉴定了一株芽孢杆菌SX09,并初步研究了其对几株常见的食源性致病菌和食品腐败霉菌的抑制作用,旨在为天然食品添加剂的选择提供有益的参考。
1 材料与方法
1.1 材料、供试菌株及培养基
分离拮抗芽孢杆菌的土壤样品于2017年8月采集于河南省南阳市某烟田。0.5%的碱性复红染色液、平板计数琼脂(PCA)、马铃薯葡萄糖琼脂(PDA)、营养琼脂(NA)、营养肉汤(NB)及胰蛋白胨大豆肉汤(TSB):购自北京陆桥技术股份有限公司;马铃薯葡萄糖水(PDW):购自青岛海博生物技术有限公司。芽孢杆菌分离纯化采用NA和NB培养基。本实验供试菌株、菌株来源及培养基见表1。

表1 供试菌株、菌株来源及培养基Table 1 Tested strains, strains' source and culture media
1.2 仪器与设备
SW-CJ-2F型双人双面净化工作台 苏州净化设备有限公司;LDZX-50KPS高压蒸汽灭菌器 上海申安医疗器械厂;Avanti J-25低温高速离心机 美国贝克曼库尔特有限公司;GHP-9160恒温振荡培养箱 太仓市实验设备厂;VITEK 2 COMPACT全自动微生物鉴定系统 法国生物梅里埃公司;GHP-9160隔水式恒温培养箱 上海一恒科技有限公司;Eclipse E200生物显微镜 尼康仪器有限公司;Autof ms1000全自动微生物质谱检测系统 郑州安图生物工程股份有限公司。
1.3 土壤中拮抗芽孢杆菌菌株的筛选
在含45 mL无菌生理盐水的锥形瓶中无菌操作加入5 g土样,150 r/min振荡20 min,75 ℃水浴10 min,静置5 min后取悬液划线于NA平板,42 ℃培养48 h,将优势的单菌落继续划线纯化获得纯培养。以金黄色葡萄球菌和大肠杆菌为目标菌株采用牛津杯进行拮抗芽孢杆菌的筛选[25]:培养皿中加入10 mL的2%的水琼脂,凝固后距平板中心1.5 cm处分别放置3个牛津杯,20 mL冷却至50 ℃的PCA培养基中加入0.5 mL目标菌液混合均匀后倾注入培养皿中,凝固后取出牛津杯。分离菌株在NB中培养24 h后过滤获得无菌发酵液,3个牛津杯孔分别加入100 μL无菌生理盐水、100 μL NB和100 μL无菌发酵液,4 ℃冰箱中放置4 h后,于37 ℃培养16 h,观察是否产生抑菌圈。
1.4 筛选芽孢杆菌菌株的鉴定
分离菌株接种到NA平板上于37 ℃下进行培养,定时观察培养特征;石碳酸复红染液进行单染色,镜检观察菌体特征;采用法国梅里埃VITEK 2 COMPACT全自动微生物鉴定系统进行生理生化特征的测定;采用郑州安图生物工程股份有限公司的全自动微生物质谱检测系统(Autof ms1000)进行菌株的质谱特征测定;筛选菌株的16S rDNA基因序列的PCR扩增及测序委托生工生物工程(上海)股份有限公司进行,序列同源性的分析参考文献[24]和文献[26]进行。
1.5 筛选芽孢杆菌菌株抗菌谱的测定
参考1.3的方法检测筛选菌株在PDW中发酵24 h的无菌上清液对金黄色葡萄球菌、大肠杆菌、蜡样芽孢杆菌、单增李斯特菌和阪崎肠杆菌的抑制效果。筛选菌株对根霉菌、齐整小核菌和青霉菌的抑制效果检测采用1.3的牛津杯法,略有改动:除培养皿上层倾注20 mL冷却至55 ℃的PDA外,培养皿下层水琼脂的倾注、牛津杯的放置及牛津杯孔物质的添加均按1.3的方法进行。牛津杯孔加样后于4 ℃冰箱放置4 h,培养皿中心分别接入一个5 mm供试菌菌块于30 ℃进行培养,观察抑菌圈是否产生。
2 结果与讨论
2.1 拮抗菌株的筛选
通过高温抗性选择和划线纯化处理,从采集的土样中分离出6株细菌,经染色镜检,初步判断6株菌均为芽孢杆菌。以金黄色葡萄球菌、大肠杆菌和青霉菌为目标菌株进行拮抗性能筛选,获得一株同时能够拮抗供试细菌和真菌的芽孢杆菌,命名为SX09。SX09的发酵上清液对金黄色葡萄球菌和大肠杆菌均产生明显的抑菌圈。
2.2 拮抗菌株的菌落及菌体特征
在NA平板上培养36 h后,菌株SX09的菌落形态见图1。SX09的菌落干燥,暗白色,圆形边缘不规则,表面褶皱,中间有环状凸起,菌落直径为2~3 mm(见图1a)。染色后镜检菌体呈现杆状,芽孢多为端生(见图1b)。
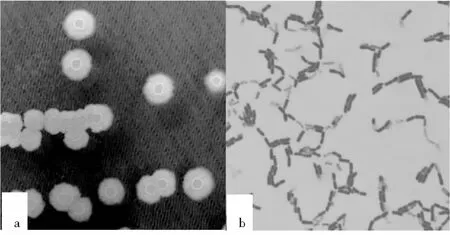
图1 菌株SX09在NA上菌落特征及菌体形态(×1000倍)Fig.1 Colony characteristics and mycelial morphology of strain SX09 on NA (1000 times)
2.3 拮抗菌株的生理生化反应
采用GP鉴定卡对菌株SX09的生理生化反应进行检测,结果表明菌株SX09可利用苦杏仁苷、D-木糖、环式糊精、蔗糖、D-山梨醇、D-半乳糖、D-核糖、乳糖、N-乙酰氨基葡萄糖、D-麦芽糖、D-甘露醇、D-甘露糖、D-棉子糖和D-海藻糖,不能利用水杨素;精氨酸双水解酶、α-葡萄糖糖苷酶和焦谷氨酸芳胺酶等呈阳性,磷脂酰磷脂酶C、β-半乳糖苷酶、精氨酸双水解酶和丙氨酸芳胺酶等呈阴性,生理生化反应与甲基营养型芽孢杆菌(Bacillusmethylotrophicus)比较接近[27]。具体实验结果见表2。

表2 分离菌株的生理生化特征Table 2 Physiological and biochemical characteristics of isolated strains

续 表
注:“+”表示结果呈阳性;“-”表示结果呈阴性。
2.4 筛选菌株的质谱检测
采用郑州安图生物工程股份有限公司的全自动微生物质谱检测系统(Autof ms1000)对菌株SX09进行鉴定,经过数据库检索分析,菌株SX09的分值为8.732,介于6.0~9.0范围内,因此MALDI-TOF MS只能初步将菌株SX09鉴定为芽孢杆菌属。
2.5 筛选菌株16S rDNA基因序列的PCR扩增及系统发育分析
提取菌株SX09的基因组DNA,通过PCR扩增其16S rDNA序列,经琼脂糖凝胶电泳检测,在1500 bp附近出现明显的扩增条带(见图2),回收测序,序列长度为1592 bp。菌株SX09的16S rDNA基因序列在GeneBank进行比对,选取同源性较高的14株芽孢杆菌和同源性相对不高的10株芽孢杆菌的16S rDNA序列,构建系统进化树(见图3),结果显示:菌株SX09和多株枯草芽孢杆菌、解淀粉芽孢杆菌和甲基营养型芽孢杆菌处于一个分支,置信度为88,因此,综合考虑菌株SX09的菌落、形态和生理生化特性,初步将菌株SX09鉴定为一株甲基营养型芽孢杆菌(BacillusmethylotrophicusSX09)。

图2 菌株SX09的16S rDNA序列PCR扩增结果Fig.2 The PCR amplification result of 16S rDNA sequence of strain SX09

图3 基于16S rDNA基因序列的菌株SX09的系统进化树Fig.3 Phylogenetic tree of strain SX09 based on 16S rDNA gene sequence
2.6 菌株SX09对供试食源性致病菌的拮抗作用
菌株SX09对供试的5株食源性致病菌均有明显的抑制作用,抑菌圈直径见表3。菌株SX09对供试大肠埃希氏菌的抑制效果最佳,其抑菌圈直径达(26.3±0.34) mm,而对金黄色葡萄球菌的抑菌效果相对较差,抑菌圈直径为(20.5±0.19) mm。阪崎肠杆菌、单增李斯特菌和蜡样芽孢杆菌的抑菌圈直径分别为(25.2±0.56) mm、(22.7±0.15) mm和(23.4±0.20) mm。通过对实验室保藏的3株食品腐败霉菌的抑制性能进行检测,结果发现菌株SX09对3株霉菌也具有较强的抑制作用,尤其是根霉菌的抑菌圈直径可达(24.7±0.16) mm。

表3 菌株 SX09对几株供试菌株的抑菌效果Table 3 Antibacterial effect of strain SX09 against several tested strains
3 结论
甲基营养型芽孢杆菌是一种值得我们开发和利用的微生物,本实验初步确定菌株 SX09为一株甲基营养型芽孢杆菌,对供试的食源性致病菌具有抑制作用,尤其是对阪崎肠杆菌具有较强的抑制效果,抑菌圈直径可达(25.2±0.56) mm。此外, 菌株SX09对3株食品腐败霉菌也具有明显的抑制效果,推测该菌具有广谱的抗菌性能。菌株SX09在PDW中发酵可产生胞外抑菌物质,该种抑菌物质对常见食源性致病菌和霉菌都有一定的抑菌效果,因此在食品加工领域具有一定潜在的商业应用价值。

