高效液相色谱法测定发酵液中有机酸的优化研究
马永强,邓倩,范洪臣,李凤
(哈尔滨商业大学 食品工程学院省高校食品科学与工程重点实验室,哈尔滨 150076)
啤酒是世界上最受欢迎的含酒精饮料[1]。通常由麦芽、酵母、酒花和水4种原料酿造[2]。啤酒营养丰富,其组成成分包括各类醇、醛、酸、酮和酯[3-5]。小麦啤酒是啤酒的重要分类,区别于拉格啤酒酿造,是在酿造原料中添加小麦,采用艾尔酵母,较高的发酵温度(18~25 ℃),因此其发酵液具有不同于其他种类啤酒特殊的水果香气和酸味,尤其是酸味给发酵液带来了重要作用。发酵液的酸味主要由无机酸和有机酸组成,有机酸是发酵液中存在的重要化合物,它不仅对啤酒的酸味有重大影响,而且还具有其他风味特征,如苦味或咸味[6]。研究表明,啤酒中含有醋酸、苹果酸、柠檬酸、富马酸、甲酸盐、乳酸、琥珀酸等多种有机酸,这些有机酸在不同类型的发酵液中含量差异很大[7]。此外,有机酸也会影响发酵液的酸碱度,这会影响发酵液的质量,如风味稳定性[8]。Coote和Kirsop以及Mackenzie和Kenny都发现有机酸的生成是导致发酵过程中pH值下降的重要因素[9]。影响发酵液的酸味及其他风味特征,因此,控制啤酒中有机酸的含量是十分重要的。Li Hong和Liu Fang[10]研究了拉格啤酒发酵产生的7种有机酸规律以及对啤酒风味的影响。
有机酸的种类和含量对发酵液有机酸的研究起着重要作用,但发酵液由于所含成分与拉格啤酒、醋等发酵产物成分千差万别,因此在样品的前处理、测量条件上都会不同。有机酸测定的方法较多,包括电位滴定法[11]、分光光度法、气相色谱法、离子色谱法、高效液相色谱法[12]等。上述方法中,液相色谱法最灵敏和准确并且被广泛运用。本研究通过优化反相C18柱的色谱条件和预处理条件,拟建立一种操作简单、方便,且具有灵敏性、准确性、稳定性的发酵液中有机酸的测定方法,对发酵液前处理的优化形成一套检测有机酸的体系,使数据更精准,也可以为其他发酵食品提供借鉴方法。
1 实验
1.1 仪器与设备
Agilent 1200 高效液相色谱仪 美国Agilent 公司;Tiank C18(250 mm×4.6 mm,5 μm)色谱柱、预处理柱Superclean C18(500 mg/6 mL) 美国菲罗门公司;SHE-111型超声波清洗器 郑州长城科工贸有限公司;电子天平 Sartorinls仪器(北京)有限公司;高速冷冻离心机 上海欢奥科技有限公司。
1.2 材料与试剂
标准品:柠檬酸、琥珀酸、乳酸、苹果酸、草酸、酒石酸、冰醋酸,美国Sigma公司;发酵液:保拉纳酵母型发酵液,德国保拉纳啤酒(北京)有限责任公司;试剂:H3PO4、HCl、NH3·H2O、NaH2PO4、KH2PO4、(NH4)2HPO4、亚铁氰化钾、硫酸锌、乙酸锌、三氯乙酸:AR,国药集团化学试剂有限公司。
1.3 方法
1.3.1 标准溶液配制
有机酸标准品的配制参照GB 5009.157—2016中方法。酒石酸、苹果酸、乳酸、柠檬酸、草酸、冰醋酸及琥珀酸,取表1中浓度各5 mL,用0.02 mol/L的磷酸定容至100 mL容量瓶中。

表1 有机酸混合标准溶液配制参照浓度Table 1 Reference concentration of mixed standard solution of organic acids
1.3.2 样品前处理
取5 mL啤酒样品于100 mL 容量瓶中,分别加入2 mL 10.6%亚铁氰化钾和2 mL 30%硫酸锌溶液,超纯水定容至100 mL。摇匀后静止10 min后,用45000 r/min离心机分离20 min。取上清液加入用甲醇活化好的Superclean C18小柱中,使样品溶液缓慢流过小柱以除去色素等干扰物,弃去最初2 mL流出液,收集样液。
1.3.3 测定条件优化1.3.3.1 不同前处理条件
a.蛋白沉淀剂的选择
参考钱国英[13]、储黎娟等[14]及余永健等[15]关于食醋有机酸的测定,分别采用亚铁氰化钾-乙酸锌,亚铁氰化钾-硫酸锌及无水乙醇进行前处理,余下条件不变,观察其有机酸分离效果。
b.分离方法的选择
根据王奇等[16]的食醋有机酸前处理方法,啤酒无法直接在蛋白沉淀剂处理后完全沉淀、分离、过滤,所以参考张奇等[17]的离心机分离法,并结合实验室设备设定为转速45000 r/min,时间20 min。
c.固相萃取小柱的对比选择
选择Superclean C18小柱、旧Superclean C18小柱、活性炭小柱分别采用甲醇进行活化,然后用超纯水将甲醇洗净[18],最后将已通过前处理的样品溶液缓慢流过小柱以除去色素等干扰物,弃去最初流出的2 mL,收集其后的流出液在确定的最佳色谱条件下进样分析,考察不同固相萃取小柱对不同酸度发酵液有机酸的高效液相色谱图的影响,确定最佳的固相萃取小柱。
1.3.3.2 不同流动相的选择
选择NaH2PO4、KH2PO4、H3PO43种缓冲液为流动相,固定其浓度 0.02 mol/L、pH 2.7、流速0.6 mL/min、柱温 37 ℃,分离7种有机酸混合标准样品,得出最优缓冲溶液后,再分别固定余下条件,选取0.01,0.02,0.03 mol/L 3种不同浓度的缓冲液,调节 pH 至 2.3,2.5,2.7,2.9,3.1,研究不同缓冲溶液种类、浓度及pH对有机酸分离效果的影响。
1.3.3.3 柱温的选择
固定其他条件,改变色谱柱温度为30,37,40 ℃,研究柱温对有机酸分离效果的影响。
1.3.3.4 流速的选择
固定其他条件,改变流动相的流速为 0.425,0.6,0.7,0.8,0.9 mL/min 进行实验,研究不同流速对有机酸分离效果的影响。
1.3.3.5 检测波长的选择
固定其他条件,在205,210,215 nm 波长对7种有机酸的标准溶液分别进行HPLC测定,研究其有机酸保留时间及分离效果。
1.3.3.6 HPLC测定
前处理后进行测定,磷酸盐缓冲溶液浓度为0.02 mol/L,pH为2.7,再经 0.45 μm混纤-水系微孔滤膜抽真空过滤,超声波脱气后备用[19]。设定流速为0.6 mL/min,柱温为37 ℃,进样体积为20 μL,检测波长为210 nm,测定时间为30 min进行测定。
1.3.3.7 有机酸分析的方法学评价
a.线性关系考察
以峰面积对浓度绘制标准曲线,得线性范围、回归方程及相关系数,同时以信噪比 S/N=3对应的浓度确定各有机酸的检出限。
b.精密度试验
为了确定分析方法的精密度,按选定的色谱条件,12 h内连续 5 次对同一混合标样进行 HPLC 分析,测定各有机酸的保留时间和峰面积,计算其精密度(以相对标准偏差RSD 表示)。
c.准确度试验
验证方法的准确度,进行回收率试验。对混合标样进行 HPLC 分析,根据样品的含量和测定值计算回收率。
d.重复性试验
取同一样品 5 份(5 mL),分别按优化的预处理方法处理样品,在最佳色谱条件下测定各种有机酸,计算 RSD。
e.稳定性试验
取 1 份样品,分别在制样后 0,4,8,12,24 h最佳色谱条件下进样分析,测定各有机酸的浓度,计算 RSD,考察样品的稳定性。
2 分析与讨论
2.1 发酵液前处理的选择
2.1.1 蛋白沉淀剂的选择
不同蛋白沉淀剂前处理的发酵液样品有机酸分离效果见图1。

图1 不同蛋白沉淀剂前处理的发酵液样品有机酸分离效果图Fig.1 Separation effect diagrams of organic acids from fermentation broth samples pretreated with different protein precipitators
由图1可知,用无水乙醇沉淀蛋白时,样品的有机酸响应值很低,可能醇沉的蛋白对有机酸有吸附作用,有机酸含量降低。亚铁氰化钾-乙酸锌沉淀蛋白后测得的有机酸含量也偏低,亚铁氰化钾-硫酸锌沉淀蛋白后测得的有机酸响应值较高,推测由蛋白沉淀吸附的有机酸损失量较少,因此选用亚铁氰化钾-硫酸锌作为沉淀发酵液的蛋白质沉淀剂。
2.1.2 固相萃取小柱的对比选择
在发酵液有机酸测定中,蛋白质去除后,其糖类和色素会干扰测定和污染色谱柱。近年来固相萃取技术已较多地用于基体复杂的样品,同时活性炭具有较强的吸附作用,也能够吸附各种有机物和色素,本实验考察了固相萃取小柱和活性炭对发酵液预处理后的分离效果,见图2。
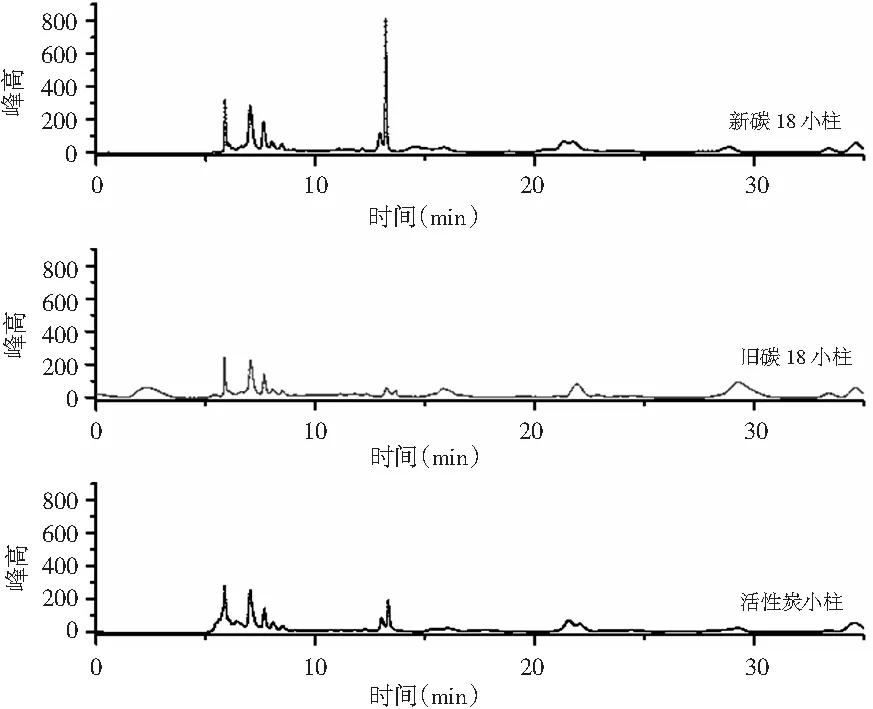
图2 不同固相萃取小柱的有机酸发酵液样品分离效果图Fig.2 Separation effect diagrams of organic acids from fermentation broth samples by different solid-phase extraction columns
由图2可知,经活性炭处理的样品,有机酸消失,有些杂质没有去除形成了拖尾。实验结果表明,C18固相萃取柱非常有效,处理后样品无色透明,适用于液相色谱分析。为了降低成本,固相小柱经洗脱后,与新柱相比有机酸含量有较大差别,不建议重新回收使用。因此选用C18固相萃取小柱作为蛋白质沉淀剂后发酵液的前处理手段。
2.2 流动相种类的选择
盐的种类不同导致流动相的离子强度也不同,进而对色谱峰的峰形有显著影响[20]。 同时,磷酸盐缓冲溶液是最典型和最合适的洗脱液,在紫外区几乎无吸收[21]。比较KH2PO4、NaH2PO4和H3PO4作为流动相的分离效果,固定流动相浓度为0.02 mol/L,流速为0.6 mL/min,柱温为37 ℃,检测波长为210 nm,对有机酸混合标准溶液进行测定。

图3 不同流动相的有机酸标准品分离效果图Fig.3 Separation effect diagrams of organic acid standard samples with different mobile phases
由图3可知,以KH2PO4作流动相,7种有机酸分离度较差,峰形重叠;以NaH2PO4为流动相,有机酸的分离度不佳,且峰形有拖尾现象;以H3PO4作流动相分析效果最好,各酸的分离度和峰形均满足分离需求,7种有机酸在30 min内出峰完毕,综合考虑,选择H3PO4为流动相缓冲盐。
2.3 流动相浓度的选择
流动相浓度越高,待测有机酸的存在形式越稳定,但浓度超过一定范围时,随着离子强度增大,有机酸分离不良,影响泵和柱的寿命,增加流动相的背景吸收,灵敏度下降[22]。本实验考察3种不同浓度(0.01,0.02,0.03 mol/L)H3PO4流动相对各种有机酸保留时间及分离效果的影响。

图4 不同浓度流动相的有机酸标准品分离效果图Fig.4 Separation effect diagrams of organic acid standard samples with different concentration of mobile phases
由图4可知,H3PO4的浓度为0.01 mol/L 时,有机酸的分离效果不好;H3PO4的浓度为0.02 mol/L时,有机酸均能得到分离,且不影响分离效果。考虑到上述效果,本实验使用0.02 mol/L H3PO4溶液作为流动相。
2.4 流动相pH的选择
有机酸均为弱酸,流动相的pH 影响样品的离子化状态,提高H+浓度,有机酸解离平衡则倾向于分子态,可增加有机酸的保留时间,因此由于分配系数不同有机酸被分离。从色谱柱填料本身来看,在强酸和强碱条件下不稳定,硅胶基体和键合相受到破坏,本色谱柱的pH为2.7左右,而pH>3 时,分离效果不佳。以0.02 mol/L的H3PO4作为流动相,用HCl调节流动相pH值分别为2.4,2.7,3.0,分析pH对混合标准溶液中有机酸分离效果的影响。
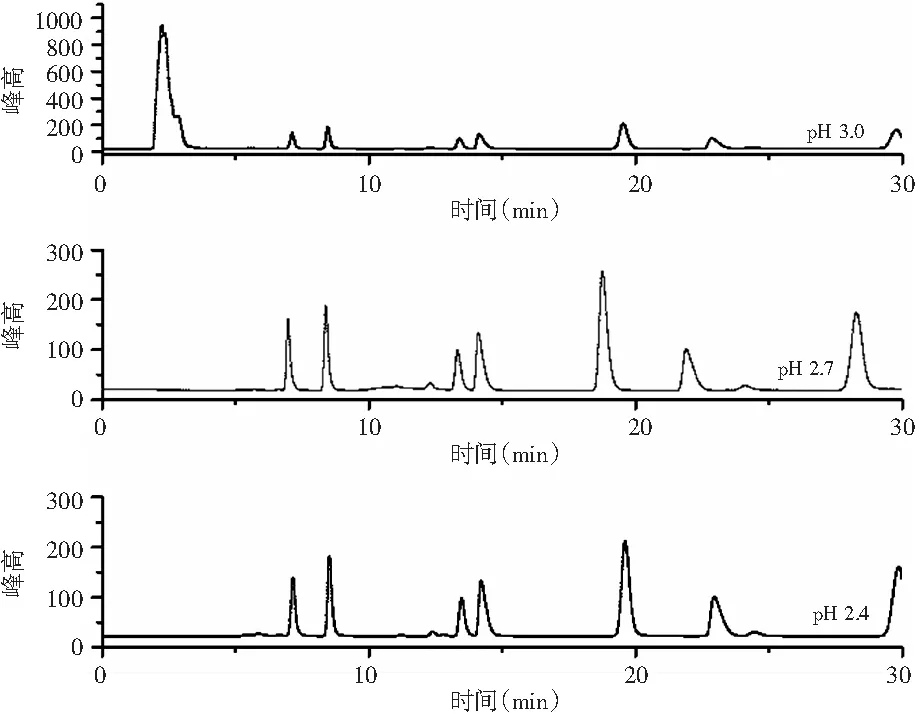
图5 不同pH流动相的有机酸标准品分离效果图Fig.5 Separation effect diagrams of organic acid standard samples of mobile phases with different pH values
由图5可知,pH对分离效果有显著影响,pH为3.0时有机酸分离不佳,pH为2.4时有机酸峰面积明显小于其他两组,只有当pH为2.7时7种有机酸分离效果最佳,则选择pH为2.7。
2.5 检测波长的选择
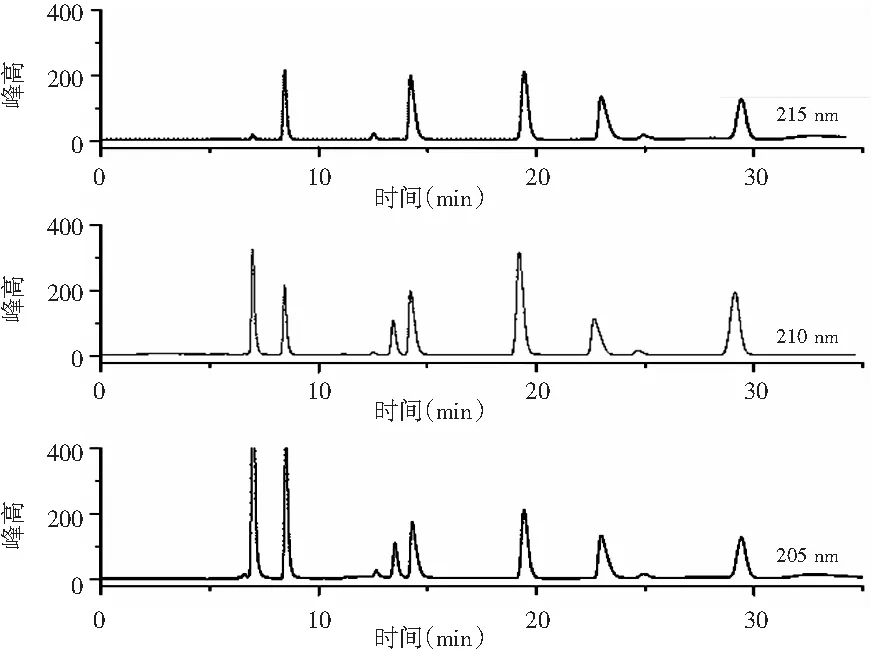
图6 不同检测波长的有机酸标准品分离效果图Fig.6 Separation effect diagrams of organic acid standard samples at different detection wavelengths
选用205,210,215 nm 3种波长进行了检测,分析混标测定后的图谱(见图6):7种有机酸的吸收强度随着波长变大而呈下降趋势,波长205 nm时各有机酸的吸收强度高,但是基线噪音大;波长215 nm时有机酸的吸收强度弱;波长210 nm时每种有机酸的吸收强度高,基线噪声的影响小。Morales研究表明一元有机酸在 205~215 nm 处有吸收带;二元酸及多元酸中吸收峰也在210 nm 附近。本实验与Morales的研究结果一致,故采用210 nm 波长进行有机酸的检测。
2.6 柱温的选择
色谱理论认为柱温是影响柱效和分离度的主要因素[23],柱温升高可使保留时间减小,但柱温过高不利于有机酸的分离同时影响色谱柱的使用寿命。 固定其他条件,调整柱温为31,34,37,40 ℃,以研究柱温对有机酸分离的影响,见图7。
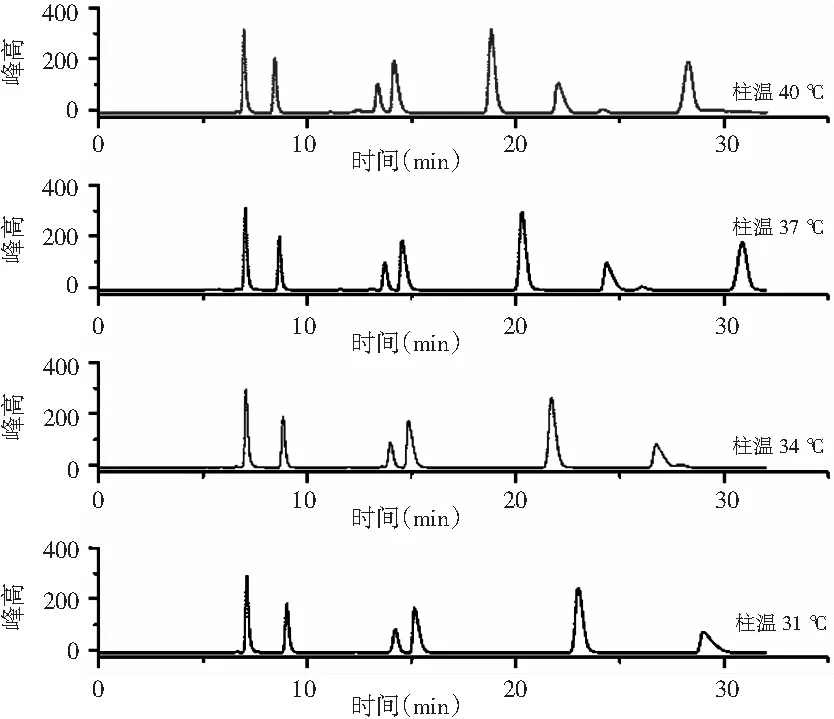
图7 不同柱温的有机酸标准品分离效果图Fig.7 Separation effect diagrams of organic acid standard samples at different column temperatures
由图7可知,31 ℃时有机酸分离不佳,各有机酸的保留时间随柱温的升高而降低。柱温为40 ℃时,部分有机酸不能完全分离。考虑到有机酸的分离度,色谱柱温度定为37 ℃。
2.7 流速的选择
在色谱分离时,流速太快,柱压高,不利于色谱柱的保护和长期使用;流速太慢,有机酸的保留时间延长,容易引起峰值变形和拖尾。合适的流速有利于有机酸的分离,本实验采用0.425,0.6,0.7,0.8,0.9 mL/min考察对有机酸分离的效果。
由图8可知,0.425 mL/min时色谱峰出现变形和拖尾现象,而0.9 mL/min时柱压过大,综合考虑,采用流速0.6 mL/min。

图8 不同流速的有机酸标准品分离效果图Fig.8 Separation effect diagrams of organic acid standard samples at different flow rates
2.8 有机酸 HPLC 分析方法的验证结果
2.8.1 线性关系考察结果
在最佳色谱条件下分析7种有机酸标准系列溶液,并使用峰面积-浓度曲线来量化每种有机酸的峰面积-浓度曲线。得到7 种有机酸的标准方程、相关系数及最低检出限,结果见表2。

表2 有机酸标准曲线的线性参数Table 2 Linear parameters of organic acid standard curves
由表2可知,有机酸的峰面积与浓度之间的线性关系良好,线性范围宽,检出限低,表明该方法的灵敏度较高。7种有机酸单标出峰时间表见表3。

表3 7种有机酸单标出峰时间表Table 3 Single-labeled peak time schedule for seven organic acids
2.8.2 精密度试验结果

表4 有机酸分析方法的精密度(n=5)Table 4 Precision of analytical methods for organic acids(n=5)

(b)峰面积(mAU)
由表4可知,各有机酸保留时间的 RSD 为0.01%~0.04%,峰面积的RSD 为 0.00%~0.05%,表明该方法的精密度较好。
2.8.3 准确度试验结果
根据表4中有机酸峰面积的平均值,通过表2中线性关系的回归方程计算相应的有机酸含量,再与标准样品的原始浓度进行对比,得出回收率为83%,见表5。

表5 准确度试验结果Table 5 Results of accuracy experiment
由表5可知,本实验有机酸混标回收率为83%,准确度较高。
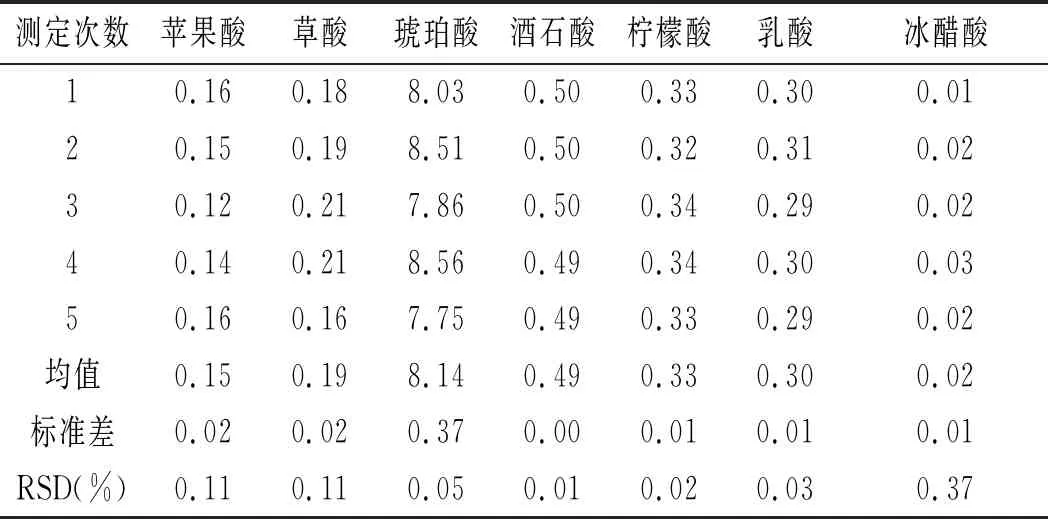
2.8.4 重复性试验结果
同一发酵液样品在相同处理条件下分5次(时间间距不超过40 min)测定得出的结果见图9。此实验结果有机酸峰面积及其对应浓度数据分析见表6。

图9 重复性试验有机酸分离效果图Fig.9 Separation effect diagrams of organic acids in repetitive experiment

测定次数苹果酸草酸琥珀酸酒石酸柠檬酸乳酸冰醋酸1204.45166.65174.5093.8343.27189.81141.582200.95155.68183.9394.0140.02194.81148.243170.41126.53171.0293.5652.98174.01150.974189.99127.15184.78106.0254.04192.00161.545204.55186.97169.0195.9843.57178.97145.89均值194.07152.60176.6596.6846.78185.92149.64标准差14.5026.067.315.316.318.967.45RSD(%)0.070.170.040.050.130.050.05
(b)有机酸含量(mg/mL)
由表6可知,各有机酸峰面积的RSD为0.04%~0.17%,有机酸含量的RSD 为 0.01%~0.37%。表明该方法的重复性较好。
2.8.5 稳定性试验结果
同一发酵液样品在相同处理条件下分5次,测定时间分别为0,4,8,12,24 h测定得出的结果见图10。此实验结果有机酸峰面积及其通过标准曲线计算得到的对应浓度数据分析见表7。
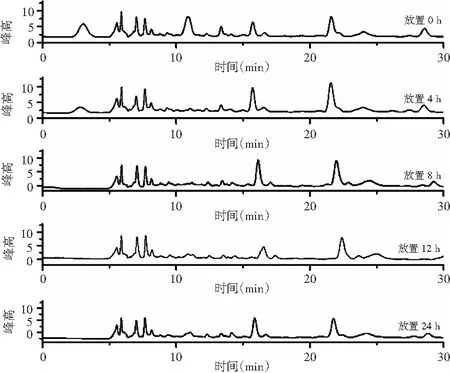
图10 稳定性试验有机酸分离效果图Fig.10 Separation effect diagrams of organic acids in stability experiment
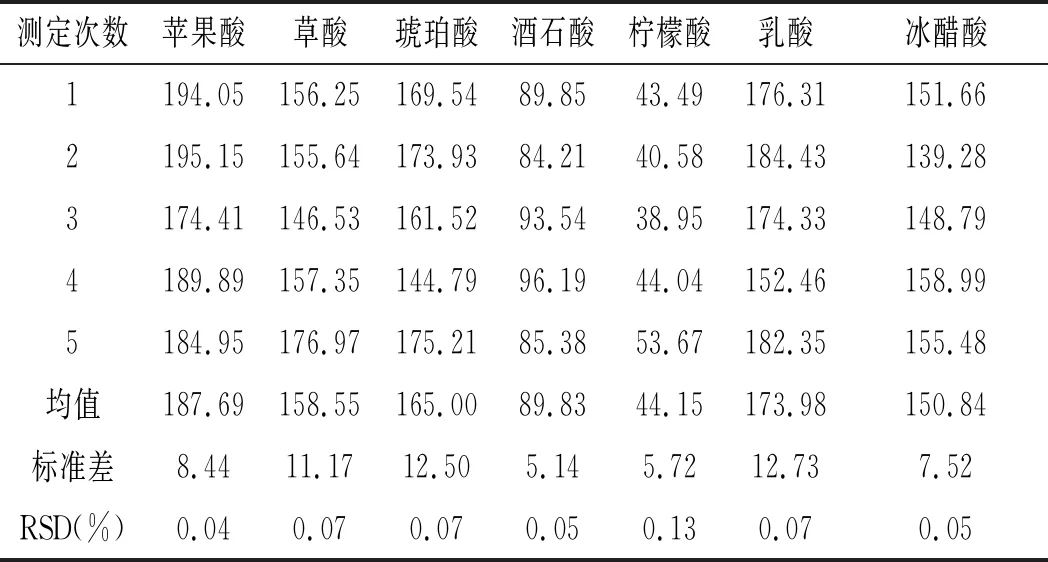
测定次数苹果酸草酸琥珀酸酒石酸柠檬酸乳酸冰醋酸1194.05156.25169.5489.8543.49176.31151.662195.15155.64173.9384.2140.58184.43139.283174.41146.53161.5293.5438.95174.33148.794189.89157.35144.7996.1944.04152.46158.995184.95176.97175.2185.3853.67182.35155.48均值187.69158.55165.0089.8344.15173.98150.84标准差8.4411.1712.505.145.7212.737.52RSD(%)0.040.070.070.050.130.070.05

(b)有机酸含量(mg/mL)
由表7可知,各有机酸峰面积的RSD为0.04%~0.13%,有机酸含量的RSD 为0.01%~0.35%,表明该方法的稳定性较好。
3 结语
本研究对反相C18色谱柱的色谱条件和预处理条件进行了优化,并采用高效液相色谱法同时测定了7种有机酸。样品经 SPE固相萃取柱纯化后,采用 C18色谱柱进行分离,流动相为0.02 mol/L H3PO4(pH 2.7),流速为0.6 mL/min,在紫外检测波长为210 nm时,可实现7种有机酸的分离和精确定量。该方法的回收率为83%,相对标准偏差(RSD)<0.04%,各有机酸的线性相关系数R2>0.994,该检测方法操作简便、灵敏、准确、稳定,可用于发酵液中有机酸的定量分析。与董霞[24]测定了6种有机酸的研究结果对比,该方法能较好地证明其研究结果,发酵液中的主要有机酸的种类在此实验中得到了验证,且初步得出该发酵液中琥珀酸含量略高于其他有机酸,其可能是影响发酵液酸感的重要有机酸。但这只是研究发酵液有机酸的一个开端,发酵液中的有机酸种类远远不止已检测的7种,影响其产酸的因素众多,其有机酸含量和酸感的关系均需要我们后续跟进研究。

