姜黄素对机械牵张引发的Ⅱ型肺泡上皮细胞ezrin/Akt通路及炎性因子的影响
朱卫华,覃 煜,王成中
0 引言
呼吸机所致肺损伤(VILI)是急性肺损伤(ALI)及呼吸窘迫综合征(ARDS)等患者接受机械通气支持治疗时最常见的并发症,而其导致的不良反应机制是因为较强的机械牵张应力引起效应细胞活化,从而产生大量的炎症因子促使肺损伤[1-2]。姜黄素主要提取于姜科、天南星科等植物的根茎,外观黄色,为酸性多酚类物质,在生活中可作为色素及食品添加剂[3-4]。早期研究已证实姜黄素的药理功效较多,在抗氧化、抗炎、抗病毒及抗肿瘤等方面发挥着重要作用[5-8]。也有研究发现,姜黄素能够改善肺泡上皮细胞炎性反应及慢性阻塞性肺疾病[9-10],但对机械牵张引发的Ⅱ型肺泡上皮细胞炎性损伤的保护作用研究较少。埃兹蛋白(ezrin)属于一种膜骨架连接蛋白,而且其磷酸化水平与内皮细胞通透性改变相关[11];然而,Ⅱ型肺泡上皮细胞(AT-Ⅱ细胞)ezrin蛋白是否参与姜黄素对VILI损伤的保护作用国内外尚未见研究。本文进一步研究姜黄素对VILI损伤导致的AT-Ⅱ细胞中ezrin/Akt信号通路及炎性因子的影响,以期为姜黄素的临床应用提供参考。
1 材料及方法
1.1 实验大鼠 10~12周龄雄性SD大鼠(260~320 g),购于北京维利通实验动物中心。
1.2 主要试剂及仪器 DMEM培养基、胎牛血清(美国Gibco-BRL公司);全氟丙烷(天津晶明新技术有限公司);TNF-α、IL-1β及IL-6 ELISA试剂盒购自武汉华美生物公司;羊抗大鼠p-ezrin、ezrin、p-Akt和Akt抗体均购自英国Abcam公司;羊抗兔二抗及化学发光检测试剂盒购自美国Cell Signaling公司。BBS-DDC超净工作台(山东博科科学仪器有限公司);LRH-150 BOD CO2细胞培养箱(上海印溪仪器表有限公司);Victor3 1420 Multilable Counter 酶标仪(DX540,美国);DYCZ-24DN凝胶电泳仪(北京六一仪器厂);成像系统(BIO-RAD,美国)。
1.3 AT-Ⅱ细胞分离与培养 参考文献[12]的方法对大鼠AT-Ⅱ细胞进行分离与培养。具体步骤如下:麻醉大鼠后采用PBS灌洗肺内血液,并利用气管插管向肺内通气数次,至肺呈苍白色,再向肺内灌注胰酶进行消化,清除肺门周围结缔组织,并快速剪碎组织及终止消化,4 ℃震荡25 min,过80目、200目、280目不锈钢筛过滤,离心收集细胞;用含10%FBS的DMEM培养基重悬,用PBS、培养液清洗细胞1次,把细胞悬液加入制作IgG包被的培养皿,37 ℃、5%CO2培养4 h,离心收集未黏附放入细胞,培养液清洗1次,碱性磷酸酶染色检测AT-Ⅱ细胞纯度,台盼蓝染色检测细胞活力,然后进行后续实验。
1.4 AT-Ⅱ细胞牵张刺激及药物处理 取对数期细胞接种于6孔Bioflex弹性膜细胞培养板培养48 h后,Flexercell 4000TM应力加载系统施加20%的机械牵张应力,频率为30 r/min,时间分别为4、8、16、24、28 h。并且采用不同浓度姜黄素(10、20、30 μmol/L)分别处理细胞16、24 h后,检测细胞中ezrin/Akt通路蛋白及培养液中炎性因子水平。
1.5 Western blot检测p-ezrin、ezrin、p-Akt、Akt蛋白表达 机械牵张及不同浓度姜黄素处理细胞16 h后,收集细胞,加入裂解液在冰上充分裂解细胞30 min,4 ℃、12 000 r/min离心15 min,收集上清,采用BCA法测定蛋白浓度。采用12%的SDS-PAGE凝胶电泳分离蛋白,然后将蛋白转移至NC膜上,5%脱脂牛奶封闭1 h,加入1∶1 000稀释的p-ezrin、ezrin、p-Akt和Akt抗体4 ℃孵育过夜,再加入1∶3 000稀释的二抗室温孵育1.5 h,TBST清洗3次后ECL显色曝光,Image J软件分析蛋白灰度值。
1.6 ELISA检测细胞培养液中TNF-α、IL-1β及IL-6水平 收集细胞培养液,离心,收集上清。严格按照TNF-α、IL-1β及IL-6 ELISA试剂盒操作说明书检测炎性因子水平。
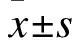
2 结果
2.1 VILI诱导AT-Ⅱ细胞ezrin/Akt通路p-ezrin/ezrin、p-Akt/Akt蛋白表达量的动态变化 VILI刺激AT-Ⅱ细胞4、8、16、24、48 h后,采用Western blot检测细胞中p-ezrin、ezrin、p-Akt、Akt蛋白表达水平的动态变化,如图1。每种蛋白在对照组细胞中均有不同程度的表达。p-ezrin蛋白表达水平在VILI刺激16 h时表达量最高,8~24 h时保持高表达水平,刺激24 h后表达逐渐下降。p-Akt蛋白表达水平在VILI刺激4 h开始逐渐升高,在16 h表达水平升至最高,刺激24、48 h表达水平降低。但VILI刺激没有改变ezrin、Akt的表达水平,相对于对照组差异没有明显变化。

图1 VILI诱导下AT-Ⅱ细胞p-ezrin和p-Akt
2.2 姜黄素对VILI诱导下AT-Ⅱ细胞中p-ezrin和p-Akt蛋白表达的影响 根据上述p-ezrin和p-Akt蛋白表达的动态变化情况,采用VILI诱导AT-Ⅱ细胞16 h构建模型。结果见图2,VILI诱导组AT-Ⅱ细胞中p-ezrin和p-Akt蛋白表达水平相对于对照组显著升高(P<0.05)。加入10、20、30 μmol/L姜黄素干预AT-Ⅱ细胞16 h后,均能够不同程度地下调在VILI刺激下p-ezrin和p-Akt蛋白的表达,表现出剂量依赖性(P<0.05)。

图2 姜黄素对p-ezrin和p-Akt蛋白表达的影响
注:1.对照组;2.VILI诱导组;3.VILI+10 μmol/L姜黄素;4.VILI+20 μmol/L姜黄素;5.VILI+30 μmol/L姜黄素。与对照组比较,*P<0.05;与VILI诱导组比较,#P<0.05
2.3 VILI诱导AT-Ⅱ细胞上清中TNF-α、IL-1β及IL-6水平的动态变化 ELISA分析了VILI诱导不同时间点AT-Ⅱ细胞上清中TNF-α、IL-1β及IL-6水平的动态变化,见图3。TNF-α、IL-1β及IL-6在对照组细胞中均有分泌;VILI干预后,TNF-α、IL-1β及IL-6含量均有不同程度的升高。结果表明,在VILI刺激8 h内,这3种炎性介质的含量没有发生明显改变(P>0.05);随着刺激时间的进一步延长,在16、24、48 h时TNF-α、IL-1β及IL-6水平显著升高(P<0.05)。

图3 VILI诱导下AT-Ⅱ细胞上清炎性因子的动态变化
2.4 姜黄素对VILI诱导下AT-Ⅱ细胞上清中TNF-α、IL-1β及IL-6水平的影响 根据“2.3”项实验结果,将VILI刺激时间确定为24 h。VILI刺激24 h,AT-Ⅱ细胞上清中TNF-α、IL-1β及IL-6水平均显著增高(P<0.05);加入10、20、30 μmol/L姜黄素干预AT-Ⅱ细胞24 h后,均能够不同程度地抑制炎症介质TNF-α、IL-1β及IL-6的分泌,表现出剂量依赖性(P<0.05)。见表1。
注:与对照组比较,*P<0.05;与VILI诱导组比较,#P<0.05
3 讨论
机械通气常用于ALI和ARDS等疾病的辅助支持治疗,然而该手段也会带来较多的并发症,如肺损伤。目前对于VILI的发病机制存在不同的观点,主要认为其不仅仅存在本身的机械损伤,还存在炎性介质的参与[12]。肺的组成细胞较多,机械通气过程会引起细胞空间位置的改变及细胞间的相互作用。AT-Ⅱ细胞是VILI损伤发生时主要的效应细胞,较强的机械应力会导致AT-Ⅱ细胞结构发生变化,进一步诱导其损伤。深入探讨机械通气时AT-Ⅱ细胞骨架及相关蛋白的变化对VILI损伤的认识有着重大意义。
ezrin蛋白是一种特异的膜骨架连接蛋白,主要表达于脊椎动物的上皮细胞。早期研究已证实,ezrin蛋白与细胞间黏附、连接、细胞迁移、细胞骨架构建及肿瘤细胞的侵袭转移等关系密切[13-14]。ezrin蛋白活化时主要表现在羧基端苏氨酸残基磷酸化,会进一步激活下游Akt信号通路,诱发炎性反应[15-16]。生理条件下,ezrin蛋白氨基端和羧基端形成分子内或分子键交联而处于失活状态,当外界刺激(如TNF-α、晚期糖基化终产物及凝血酶)时会诱导其磷酸化而激活,进而发挥相应的生物学效应。研究还发现,ezrin蛋白激活与脐静脉、肺血管内皮细胞损伤及通透性关系密切。体内实验发现,机械通气能够导致肺过度膨胀,引发肺内炎症反应,进而促使AT-Ⅱ细胞损伤,引起肺上皮通透性升高及细胞功能破坏[17]。本文研究也发现,机械牵张干预后,AT-Ⅱ细胞ezrin/Akt信号通路中p-ezrin及p-Akt蛋白表达水平显著升高,而且细胞培养液中炎性因子TNF-α、IL-1β及IL-6的释放量也明显增高。
姜黄素是从姜黄属植物根茎中提取的多酚类物质,能够通过改变细胞因子水平发挥不同的生物学效应。姜黄素在阿尔茨海默症、肺间质纤维化、动脉粥样硬化等方面的应用研究较多[18]。早期研究发现,姜黄素能够抑制炎性因子TNF-α、IL-1β及IL-6的产生,阻断炎性通路的活化,起着较强的抗炎作用[19],但其具体作用机制尚不清楚。本文采用姜黄素处理VILI细胞,进一步证实不同浓度姜黄素能够抑制TNF-α、IL-1β及IL-6的释放水平,并且下调ezrin/Akt信号通路中p-ezrin及p-Akt蛋白的表达。初步推断姜黄素对VILI损伤具有保护作用,其机制可能与下调ezrin/Akt信号传导来降低炎症因子产生有关,为防治VILI损伤提供了新的研究方向。

