犬细小病毒2c亚型毒株的分离与鉴定
邓 永,孔冬妮,侯力丹,毛娅卿,王 嘉
(中国兽医药品监察所,北京 100081)
犬细小病毒病是由犬细小病毒(Canineparvo-virus,CPV)引起的一种高度接触性、烈性传染病[1]。该病在临床上以剧烈呕吐、出血性肠炎及白细胞显著减少为主要特征,分为出血性胃肠炎和急性心肌炎两种类型[2]。前者主要侵害犬的肠上皮隐窝细胞,引起犬剧烈呕吐及血样下痢;后者主要侵害犬心肌细胞,引起犬心率紊乱,突然死亡[3-4]。该病在世界范围内流行,是危害犬健康最严重的疾病之一,给养犬业带来了巨大的经济损失。随着我国经济的发展,养犬的人数越来越多,犬细小病毒对犬的危害非常严重[5-7]。本实验采集了纳米PCR检测为阳性疑似感染犬细小病毒病犬的粪便,并在F81细胞上增殖培养,将分离的病毒通过纳米PCR试验检测、血凝试验、免疫过氧化物酶单层细胞染色(IPMA)试验和基因测序分析,确定其株型[8-10],为监测CPV的变异状况和流行趋势提供依据,对其进行持续监测将为是否需要更新当前可用的疫苗和检测方法提供依据。
1 材 料
1.1 细胞、病料和载体 猫肾细胞(F81)由中国兽医药品监察所病毒制品检测实验室保存;病料采集于广西大学动物医院临床粪便;pMD-18T克隆载体(批号K8201AB)购自于TaKaRa公司。
1.2 主要试剂 DMEM培养液(批号8118126)购自GIBCO公司、MEM培养液(批号AC10447375)购自Hyclone公司、胎牛血清(批号ST170802)购自PAN SERATECH;注射用青霉素钠(批号180508)购自山东鲁抗公司、注射用硫酸链霉素(批号20180201)购自华北制药公司;DL2000 DNA Marker(批号746087AH)购自博迈德公司 and Pluss Marker(批号AHF1915A)购自TaKaRa公司、Taq DNA聚合酶(批号745661AH)购自博迈德公司;DNA提取试剂盒(批号03718KC5)购自AXYGEN公司;胶回收试剂盒(批号R6620)购自AXYGEN公司;纳米PCR试剂盒(批号NPK01)购自山东大正生物有限公司;质粒提取试剂盒(批号Q6020)购自TIANGEN公司。
1.3 主要仪器 CO2培养箱(THERMO公司)、荧光显微镜(OLYMPUS公司)、PCR仪(美国BIO-RAD公司)、小型高速冷冻离心机(HIMAC公司)、高速冷冻离心机(PROTEINSIPMLE公司)、紫外凝胶成像系统(TANON2500)(上海天能科技有限公司)、电子天平(METTLER TOLEDO PL203-IC)、低温台式高速离心机(Biofugo primo R)(美国THERMO公司)、Milli-Q纯水仪(美国MILLIPORE公司)、移液枪(美国EPPENDORF公司)、96 孔V型血凝板、微型血凝振荡(上海生物工程公司)、普通光学显微镜(OLYMPUS公司)等。
2 方 法
2.1 临床样品处理 采用纳米PCR检测为阳性疑似感染犬细小病毒的粪便作为样品,将粪便放入EP管中,用PBS将其重旋,并加入1%青、链霉素。15000 r/min离心15 min,将上清用0.22 μm滤膜过滤除菌后作为分离病毒样品,-80 ℃保存。
2.2 病毒的分离与增殖 将病料用适量PBS重悬,然后15000 r/min离心15 min,用移液器吸取上清,用0.22 μm滤器无菌过滤,同步接种于新消化的F81细胞中,加入含5% FBS(胎牛血清)的DMEM细胞培养液,加入1% 青、链霉素双抗,然后放入37 ℃,5%CO2细胞培养箱进行培养,同时设正常细胞对照。每天观察细胞生长情况和细胞病变(CPE)情况。盲传3代无CPE则弃去,产生CPE的细胞再连续传3代,当出现90%的CPE时,收获病毒。
2.3 样品PCR的测定
2.3.1 引物设计及合成 参照GenBank 中发表的CPV-2(登录号:AB054222)基因组序列的分析,应用Primer 6.0软件设计扩增CPV VP2基因的全长序列引物,经过VP2基因全长序列比对后筛选出保守区域并设计能扩增出574 bp目的条带的引物[11-12]。引物由华大基因公司合成(表1)。

表1 CPV VP2基因保守序列PCR扩增引物Tab 1 The primers of CPV VP2 gene conservative sequence PCR amplification
2.3.2 样品DNA提取 样品及病毒分离后细胞培养物 DNA的提取使用AXYGEN公司的 DNA 提取试剂盒进行,具体操作按照使用说明书进行。
2.3.3 PCR的扩增 以提取的DNA为模板,应用引物 VP2-F和VP2-R来扩增目的片段,大小为574 bp,用已经优化好条件的纳米PCR进行扩增,将PCR产物 5 μL与6× Loading buffer加样缓冲液混匀,在1%的琼脂糖凝胶上电泳,电压为120 V,30 min后,于凝胶成像系统内观察结果,并照相。
2.3.4 血凝实验 按常规微量 HA操作方法在96孔 “V”型微量板上进行。将待检病毒液于 96孔微量血凝板中倍比稀释后加入等量1%猪红细胞悬液,4 ℃静置1 h后判定结果。
2.3.5 免疫过氧化物酶单层细胞染色法(IPMA)鉴定 取1 mL经过离心的病料上清,经过0.22 μL滤器同步接种于F81细胞,加入足量的含5%胎牛血清的MEM,于5% CO2,37 ℃培养48 h,用PBS(200 μL/孔)洗3次,电吹风吹干,直到孔边缘出现白色圈为宜。每孔加入100 μL 33%丙酮-PBS,室温放置30 min。弃固定液,用电吹风吹干。进行IPMA试验,具体操作步骤如下:每孔加入200 μL洗涤液,置室温漂洗一次,轻轻甩出洗液,吸水纸上轻叩。用样品稀释液将待检样品、阴性血清对照品和阳性血清对照品作1∶100倍稀释。取上述稀释血清样品分别加入到对应孔,每孔100 μL,于37 ℃温箱中孵育1 h。再次洗板后,每孔加入100 μL稀释的HRP-SPA辣根过氧化物酶标记的二抗,将反应板放入盒中,于37 ℃温箱中放置30 min。再次洗板。每孔加入100 μL底物显色液,避光,于37 ℃温箱中反应15 min。弃去反应液,每孔加入200 μL蒸馏水洗板一次,每孔加入100 μL ddH2O观察结果。在显微镜下观察各孔显色情况,进行样品结果判定。在CPV阳性血清下,若有病毒感染的细胞染色后细胞质内或细胞核周围呈棕红色判定为阳性,若无病毒感染细胞核无着色反应判定为阴性。
2.3.6 VP2基因PCR扩增与序列分析 在NCBI网站上下载几个CPV的VP2序列,使用DNAMAN软件进行比对。根据比对结果,选择CPV的VP2基因的保守区域使用Primer6.0软件设计一对覆盖犬细小病毒VP2基因全长的引物P1、P2(表2),通过PCR扩增获得VP2全长基因(表3)。所使用的引物为上海生工生物公司合成,扩增片段长度为1755 bp。按文献[13]方法提取待检样品、阴性对照与标准CPV的DNA,进行PCR扩增和琼脂糖电泳凝胶观察。用AXYGEN公司的凝胶回收试剂盒回收PCR产物。将回收的目的基因片段与pMD18-T载体16 ℃连接过夜,转化E.coliJM109,经酶切鉴定和质粒PCR鉴定后,将阳性克隆送上海生工生物公司测序。
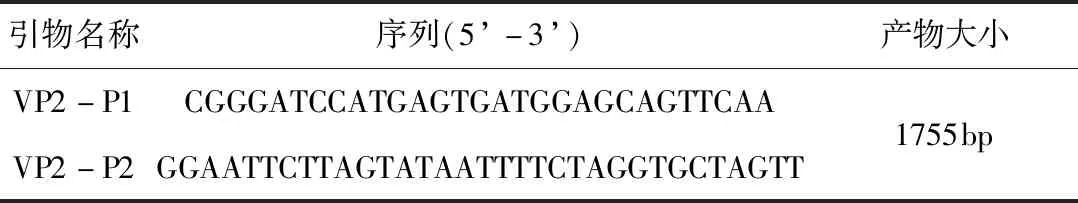
表2 CPV VP2全长基因PCR扩增引物Tab 2 The primers of CPV VP2 gene PCR amplification

表3 PCR扩增参数Tab 3 PCR amplification parameters
2.3.7 序列测定及分析 将鉴定后的阳性菌液送去测序,测序结果用 DNAMAN 软件对获得的VP2基因序列进行拼接,并与NCBI上已经公布的犬细小病毒的全基因组序列以及相关蛋白的核酸序列进行比较,确定其所分离的病毒株型并推导氨基酸序列。
3 结果与分析
3.1 病毒在F81细胞上的分离与增殖结果 病料上清接种于F81细胞后培养5 d,接种的细胞明显出现拉长,变圆,脱落状态,呈现明显的CPE,未接种的细胞状态正常(图1)。反复冻融并继续传代,仍然出现同样的CPE,将出现CPE的样品命名为CPV-Guangxi23。
3.2 目的基因的扩增结果 将PCR扩增的目的基因以1%琼脂糖凝胶电泳,结果显示在574 bp处可见目的条带,与预期结果相符合,表明成功扩增出VP2保守序列(图2)。
3.3 红细胞血凝检测结果 采用微量血凝试验检测分离上清对猪红细胞的凝集作用,结果显示病毒在4 ℃条件下能够凝集猪红细胞,与己知CPV血凝谱相符(图3)。该上清液血凝效价可达214。

A:CPV感染的F81细胞;B:正常细胞A:F81 cells infected with CPV (×100);B:control F81 cells (×100)图1 感染CPV的F81细胞和健康F81细胞Fig 1 Healthy F81 cell and F81 cell infected with CPV
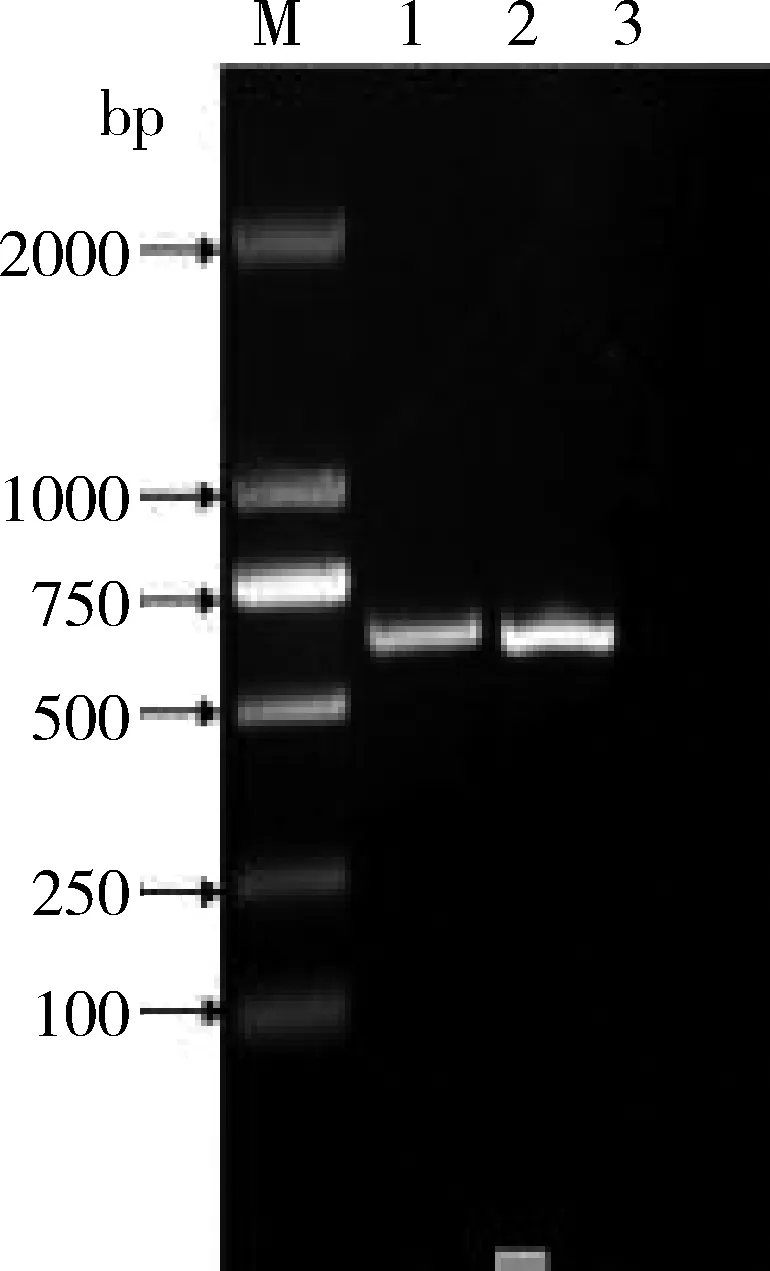
M:DL2000 DNA Marker;1、2:样品PCR产物;3:阴性对照M:DL2000 DNA Marker;1、2:PCR production of sample;3:Negative control图2 CPV-VP2基因保守序列的PCR产物Fig 2 PCR production of CPV-VP2 gene conservative sequence from samples
3.4 免疫过氧化物酶单层细胞染色法(IPMA)鉴定结果 将病毒液同步接种F81细胞培养48 h后用33%丙酮固定,然后用CPV阳性血清和阴性血清,按1∶100稀释,按照IPMA操作方法进行,结果显示接种病毒F81细胞能与阳性血清反应,细胞核周围呈棕红色染色;接种病毒F81细胞不能与阴性血清反应,呈现细胞正常颜色,未接种病毒的F81细胞也不能与阳性血清反应,呈现正常细胞颜色,结果与预期相符(图4)。
3.5 测序结果 图5显示,Guangxi23样品细小病毒序列中编码VP2蛋白426位氨基酸的密码子为GAA,编码Glu,表明这份样品中的细小病毒为CPV-2c型,命名为CPV-2c-Guangxi23。

1-23列:病毒液依次按2倍倍比稀释;24列:红细胞对照Line1-23:serial two-fold dilutions of the virus;Line24:RBC control图3 病毒血凝特性检测结果Fig 3 The result of hemagglutination

A:阴性血清;B:阳性血清;C:阳性血清 A:Rabbit negative serum;B:Rabbit positive serum;C:positive serum图4 F81细胞接种CPV病毒48 h后IPMA结果(×100)Fig 4 IPMA results detected 48 h after inoculation of CPV in F81 cells (×100)using different sera
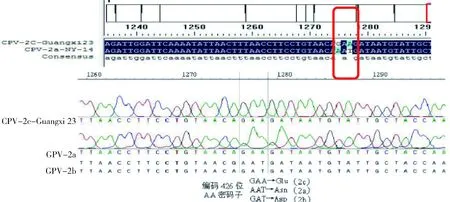
CPV-Guangxi23编码426位氨基酸的密码子为GAA,而CPV-2a编码426位氨基酸的密码子为AAT,CPV-2b编码426位氨基酸的密码子为GATThe codon for AA at position 426 of VP2 of CPV-Guangxi23 is GAA,while AAT for CPV-2a and GAT for CPV-2b图5 CPV-Guangxi23样品测序彩图Fig 5 The sequencing result of CPV-Guangxi23
3.6 序列分析 使用 DNAMAN软件进行分析比对,结果显示Guangxi23样品与CPV-2c型同源性都在99%以上。从所测的VP2基因氨基酸序列推导序列变异位点,CPV-Guangxi23在VP2蛋白426位氨基酸为Glu,蛋白序列比对结果表明细小病毒为CPV-2c型,并存在267(F)→267(Y)、324(Y)→324(I)2个位点突变,如表4所示。
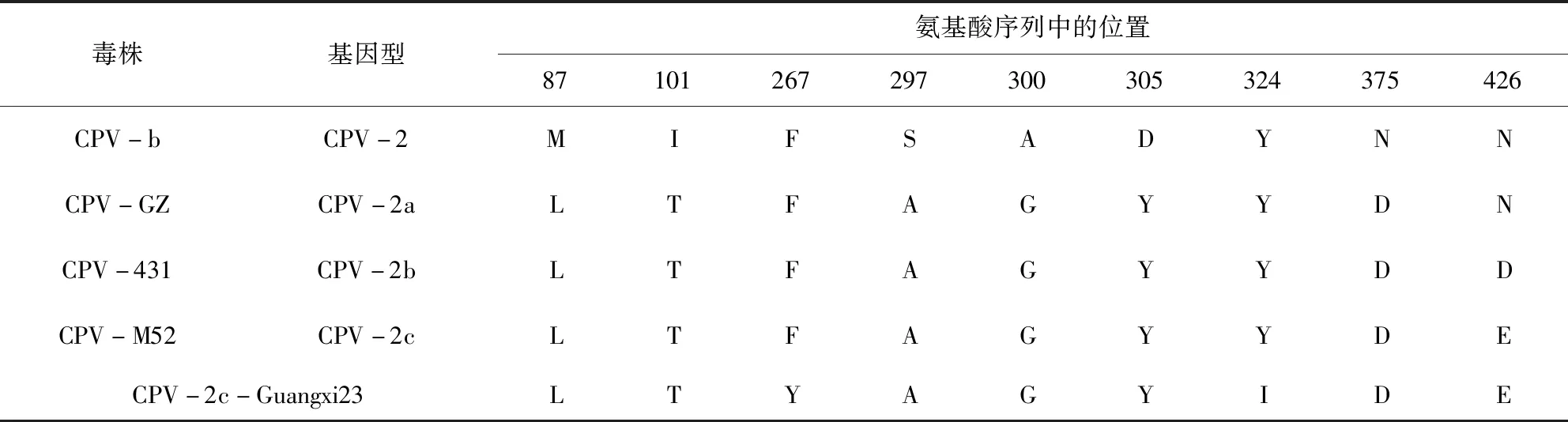
表4 CPV-Guangxi23 VP2 与参考株VP2 蛋白序列关键位点氨基酸比较Tab 4 The comparison of the amino acids at critical sites within VP2 protein of CPV-Guangxi23 and the reference strains.Accession number of reference
*strains:CPV-b (M38245),CPV-GZ(JX120178),CPV-431(AY742951),CPV-M52 (KC196087)
4 讨论与结论
本研究从疑似犬细小病毒感染的犬粪便中分离出一株病毒,后经细胞培养、病毒形态学鉴定、血凝试验、免疫过氧化物酶单层细胞染色法以及纳米PCR扩增试验和VP2基因分析等多种方法鉴定[14],确定分离的病毒为犬细小病毒,该毒株属CPV-2c型,并命名为CPV-2c-Guangxi23。
为了区别于1967年由Binn等人从健康犬粪便中分离到的犬极细小病毒(Minute virus of canine,MVC)(习惯上被叫做CPV-1)而将后来发现的病毒命名为犬细小病毒2型(CPV-2)[16]。迄今为止,CPV只有一个抗原型,即CPV-2,但不同毒株间抗原性有所差异,已出现了多个亚型,即CPV-2a、CPV-2b、CPV-2c (a)和CPV-2c (b)。CPV-2型出现后很快在世界广泛传播,该病毒可能由猫的白血病病毒变异而来,通过野生的犬科动物如貂和狐狸,适应了新的宿主犬,连续传播几年后,CPV已经发生抗原漂移,在抗原性、宿主范围和血凝性上都发生了变化,Mara B等研究证实CPV-2与RNA病毒相似,表现有高的遗传异质性。Parrish等报道,1978-1980年分离的毒株是CPV-2型,1980年后分离的毒株又是另一个型,Parrish等提出将新的毒株命名为CPV-2a,以表明是CPV-2的亚型,能感染犬和猫。很快,最初的CPV-2被CPV-2a完全替代。较CPV-2而言,CPV-2a 在VP2外膜蛋白上有5个氨基酸的改变,已证明这些氨基酸代表了抗原和宿主范围的病毒特性。1984年,出现了另一种新的抗原变异株,命名为CPV-2b,一般和CPV-2a混合感染,两者不同之处在CPV-2b衣壳的主要抗原位点有1个氨基酸(Asn426Asp)替换。随后应用单克隆抗体发现,Asn/Asp426 Glu 替代引起抗原的改变。因此,有的研究者将Glu-426变异株作为一个新的型,命名为CPV-2c[15]。
研究表明 VP2基因是CPV的特异性基因,为其最主要的毒力基因,也是 CPV最易变异的集中区段,尤其是CPV 基因型分型依据就是位于VP2 蛋白的第426aa。为进一步验证该分离株,本实验又对该病毒株的VP2基因进行了克隆和分析。结果显示从病料样品和细胞培养物中均能够扩增出大小约为 l755bp的基因片段,测序后进行同源性比较显示该基因与CPV VP2的同源性可达 99%以上,从分子水平上证明了该分离株为CPV。进一步对 VP2基因对应的氨基酸序列分析表明,该病毒株 426aa为Glu,符合CPV-2c型的特征[17],而且该病毒株在一些其他位点也发生了变异,在267(F)→267(Y)、324(Y)→324(I)2个位点发生突变,从而可能会影响该分离株的感染谱或毒力。
犬细小病毒随时在变异,可能再经过几年,又会有新的病毒株型出现。我国主要以CPV-2a株流行[18],在2010年之前,国内没有CPV-2c出现,最近几年开始陆续报道我国有CPV-2c的出现,这说明犬细小病毒的传播速度很快,具有跨区域传播的能力。本研究从犬的粪便中,成功分离到一株CPV-2c型病毒,在VP2蛋白426位氨基酸为Glu,血凝价为214,病毒的增殖能力较强,病毒液中所含病毒的量较高,氨基酸推导序列分析发现存在267(F)→267(Y)、324(Y)→324(I)2个位点突变,说明细小病毒在不断进化,应随时监测犬细小病毒变异情况,如若出现新的株型,就可以快速更新疫苗,从而对犬起到保护作用。

