PK15细胞的无血清全悬浮驯化研究
刘天伦,郎洪彬,孔 飒
(1.北京民海生物科技有限公司,北京102609;2.北京大北农科技集团股份有限公司,北京102609)
猪圆环病毒病是由猪圆环病毒2型(PCV2)引起的病毒性传染病。研究结果表明,PCV2感染除了造成断奶仔猪多系统衰竭综合征(PMWS),同时还与猪呼吸道综合症(PRDC)、猪皮炎和肾病综合征(PNDS)、先天性震颤、繁殖障碍、胎儿心肌炎和扩张性坏死性肺炎等猪圆环病毒病(PCDAD)密切相关[1],给养猪业造成巨大损失。王贵华等[2]已经用PK15细胞成功分离了猪圆环病毒2型。PK15为猪肾上皮细胞,对猪圆环病毒(PCV)、猪细小病毒(PPV)和猪瘟病毒(CSFV)等多种病毒比较敏感[3]。PK15细胞现已用于PCV2的生产,但由于PCV2体外增殖能力较差,致使PCV2效价不高。因此,PCV2的滴度问题一直是PCV2培养过程中的关键[4]。生物反应器大规模培养技术是提升细胞密度的核心技术,其中微载体技术是目前较为成熟的技术之一。何锡忠等[5]利用微载体技术培养PK15细胞生产猪圆环病毒2型,任丽[6]用生物反应器对PCV2的微载体悬浮培养进行了系统研究。但由于微载体培养系统不适合于对剪切力较敏感的细胞,且存在微载体价格昂贵,重复利用效果不好,细胞制备需求量过大等缺点,驯化一株可适应大规模生物反应器培养的全悬浮PK15细胞可推进工艺的进一步升级。全悬浮细胞培养具有细胞密度大、放大倍数大、传代方便等优势,但是对搅拌和气体的剪切力非常敏感,对反应器的结构有较高的要求。无血清培养是通过用已知的人源或者动物源的蛋白或生长因子、激素来代替动物血清的一种培养方式,可减少后期纯化工作的难度,提高产品质量[7]。本研究对一株贴壁的PK15进行了无血清的全悬浮驯化,以期为大规模培养猪圆环2型病毒提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞和毒株 PK15细胞(猪圆环病毒1型阴性、猪肺炎支原体阴性)由大北农动物医学研究中心保存。
1.1.2 主要试剂和耗材 DMEM-F12(12500-096)、0.25%胰蛋白酶(27250-018)、optiPROTM-sfm(12309019)购自Gibco公司,无血清悬浮培养基PK15-H(M20317)购自上海源培生物有限公司,新生牛血清(04-102-1A)购自BI公司,台盼蓝(T8154)购自美国Sigma公司,细胞方瓶、摇瓶、96孔板购自美国康宁公司。
1.1.3 主要仪器和设备 CO2培养箱购自Thermo公司,轨道式振荡器购自杭州奥盛仪器有限公司,倒置显微镜购自Olympus公司,Countstar细胞计数仪购自上海睿钰生物科技有限公司,SBA生物传感器购自山东省科学院生物研究所,低速冷冻离心机购自美国Beckman公司。
1.2 方法
1.2.1 PK15细胞无血清全悬浮驯化
1.2.1.1 PK15贴壁细胞降血清 复苏一支PK15细胞,用含8%新生牛血清(NBS)的DMEM-F12按照常规传代方法传代,在75 cm2方瓶中传3代至细胞密度稳定后,按初始密度0.25×106/mL分别接种至2个75 cm2方瓶中,其中一瓶用含有1/4体积的optiPROTM-sfm和3/4体积的加入8% NBS的DMEM-F12的混合培养基培养,用于降血清;另外一瓶用全体积的加入8% NBS的DMEM-F12培养基培养,作对照细胞,培养体积均为30 mL。

表1 降血清方法和代次Tab 1 Method and Generation of reduced serum
1.2.1.2 PK15贴壁细胞低血清的悬浮驯化 细胞适应低血清贴壁培养至密度稳定3代后,消化后将细胞悬液离心去除胰酶,移至125 mL摇瓶中。培养体积根据初始密度一般在20~40 mL之间,初始密度1.0×106/mL,培养基比例由1/2optiPROTM-sfm和1/2 PK15-H过渡到1/3optiPROTM-sfm和2/3PK15-H再过渡到全PK15-H,血清含量为2%。传代时间根据细胞密度决定,一般保证传代前细胞密度大于2.0×106/mL,继续消化连续传代,至细胞密度稳定。
1.2.1.3 PK15悬浮无血清的驯化 含2%NBS的全悬浮PK15细胞传代时,成团现象较为严重,需去除大团并连续消化传代。降血清由2%降到1%,再由1%降至0.5%,再降至无血清,降血清过程中细胞密度稳定2~3代后方可进行下一步传代。传代时间根据细胞密度而定,传代前密度一般大于2.0×106/mL,传代后初始密度一般在1.0×106/mL左右。
1.2.2 PK15-S增值的稳定性 取驯化后细胞进行初始密度为0.5×106/mL的连续传代,每24 h取样观察计数,72 h开始传代。细胞悬液离心后取上清液,按照SBA生物传感器操作规程,10倍稀释上清液后,测定糖和乳酸含量,并记录。
1.2.3 细胞密度测定方法 采用台盼蓝(TB)染色法计算细胞密度,具体操作如下:先用无菌PBS稀释台盼蓝,稀释比例1∶1,再用稀释过的台盼蓝稀释细胞悬液,稀释比例1∶1,最终稀释后,吹打均匀,取40 μL加入细胞计数板中,放入Countstar细胞计数器中计数,一个样品取3个视野,取平均值,即为细胞密度。
1.2.4 PK15-S倍增时间的测定 取驯化传代稳定的细胞,每天取样计数,绘制细胞生长曲线,计算细胞倍增时间。取驯化传代稳定细胞峰值前一天的细胞计数(Y)、接种细胞数(X)及生长时间(T)计算细胞倍增时间Δt,计算公式如下:
Δt=T/AA=log2Y/X
2 结果与分析
2.1 无血清悬浮PK15细胞生长情况分析
2.1.1 PK15贴壁细胞降血清 逐步降血清与高血清对照最高密度的对比结果见表2。在含有9/10体积的optiPROTM-sfm和1/10体积的加入8% NBS的DMEM-F12的混合培养基时细胞密度也高于高血清密度,即0.8%血清量。当全用optiPROTM-sfm养时,细胞密度低于高血清的密度,由此可初步将驯化前期血清量控制在1%~2%。
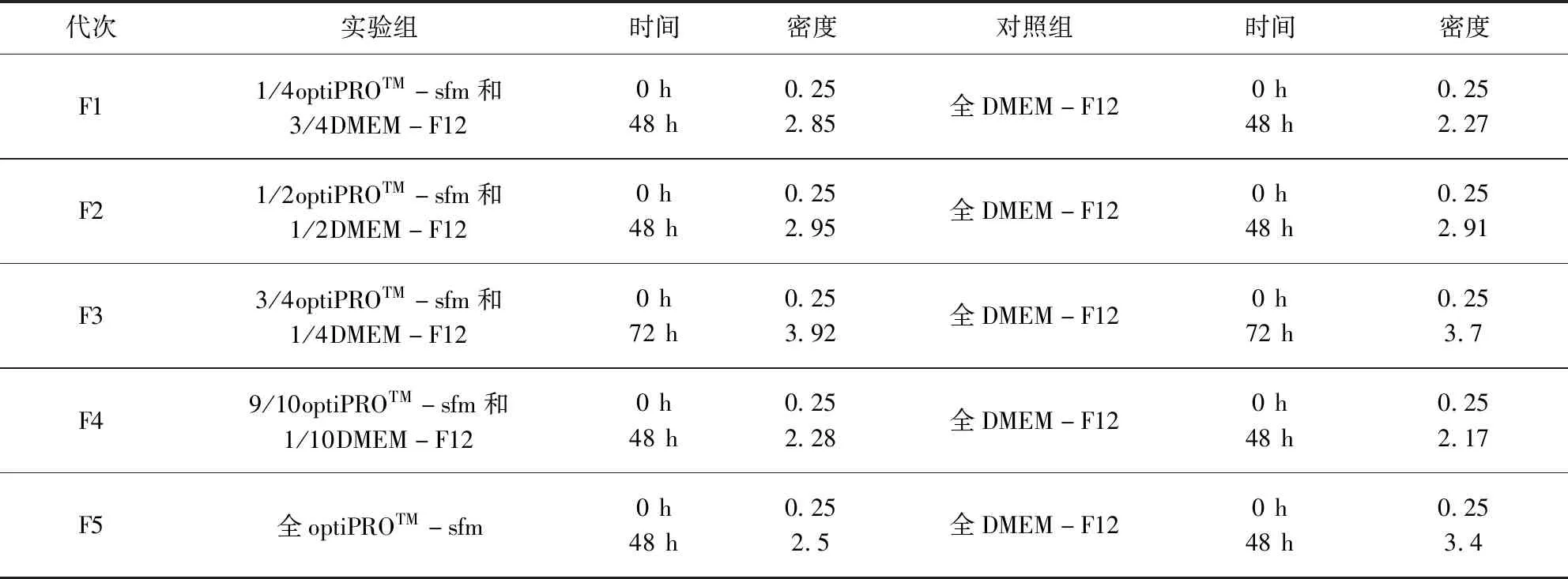
表2 PK15贴壁细胞降血清密度情况Tab 2 Reduction of serum density by PK15 adherent cells
48 h或72 h取样为消化后体积,细胞悬液为10 mL;表格中DMEM-F12均加入8% NBS
2.1.2 PK15贴壁低血清的悬浮驯化 由于细胞直接由贴壁状态转至全悬浮状态,细胞成团现象较为严重,以致于每次传代必须经过消化才能传代,传代需经过离心去上清、胰酶震荡消化、离心去胰酶、培养基吹打均匀继续培养4个步骤,密度情况见表3。团块较大时,可配制高浓度胰酶进行消化,期间操作时间较长且步骤多,对细胞造成损伤较为严重并且易污染,前期细胞活率不是很高但可以接受,后期转为正常。

表3 PK15贴壁低血清的悬浮驯化密度情况Tab 3 Suspension acclimation density of PK15 adherent low serum
细胞经过9个代次,3种组合培养基的过渡传代,细胞涨势较好,但存在较大团块,消化后分散均匀(图1),且活率保持在95%以上,需进一步降血清驯化。

图1 PK15贴壁低血清的悬浮驯化细胞状态Fig 1 Suspension domesticated cell state of PK15 adherent low serum
2.1.3 PK15悬浮无血清的驯化 血清的存在也是细胞成团的主要因素之一,血清浓度由2%降到1%,再由1%降至0.5%,再降至无血清,细胞密度波动较为明显,消化后计数,活率都能有95%以上,若细胞团块过大还仍用合适浓度的胰酶进行消化后再计数,否则计数误差会很大。
PK15悬浮细胞经过9个代次的降血清实验(表4),细胞在无血清条件下轮廓清晰,分散均匀,大小均一性良好(图2),密度稳定。该株贴壁PK15细胞,从复苏到最终驯化成全悬浮PK15-S细胞,经过3种培养方法的过渡(表5),共23次传代(图3、图4),细胞状态良好,活率较高,可冻存保种。
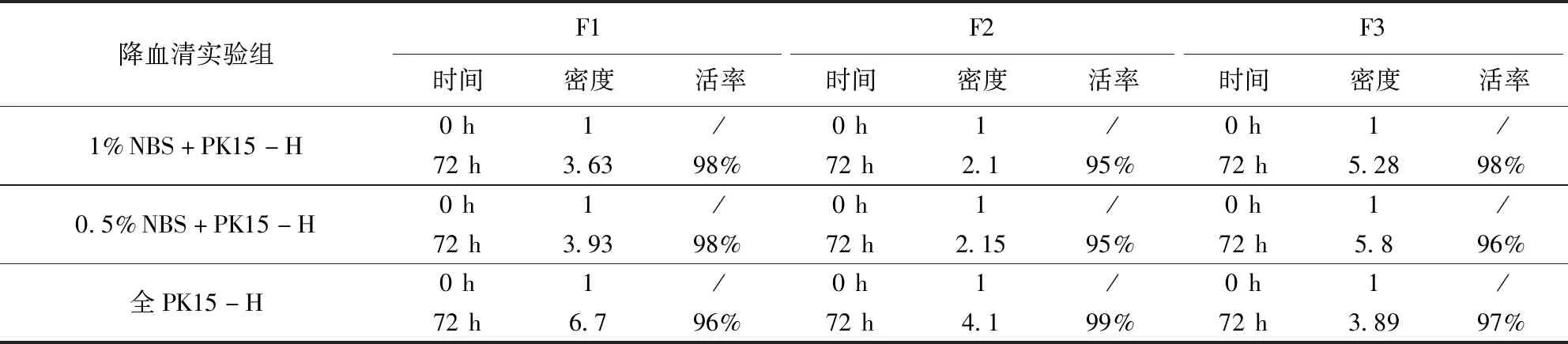
表4 PK15悬浮无血清的驯化密度情况Tab 4 Domestication density of PK15 suspension without serum
图2 PK15悬浮无血清的驯化细胞状态Fig 2 State of domesticated cells in PK15 suspension without serum

培养方法血清含量传代次数培养容器接种密度/mL培养时间细胞数量/mL细胞活率结团情况低血清贴壁8%~2%5T750.25×10648h0.97×106/少量低血清悬浮2%9摇瓶1×10648h3.79×10696%多且大无血清悬浮2%~0%9摇瓶1×10648h3.89×10697%无

图3 贴壁培养阶段PK15细胞密度情况Fig 3 The density of PK15 cells in the adherent culture stage
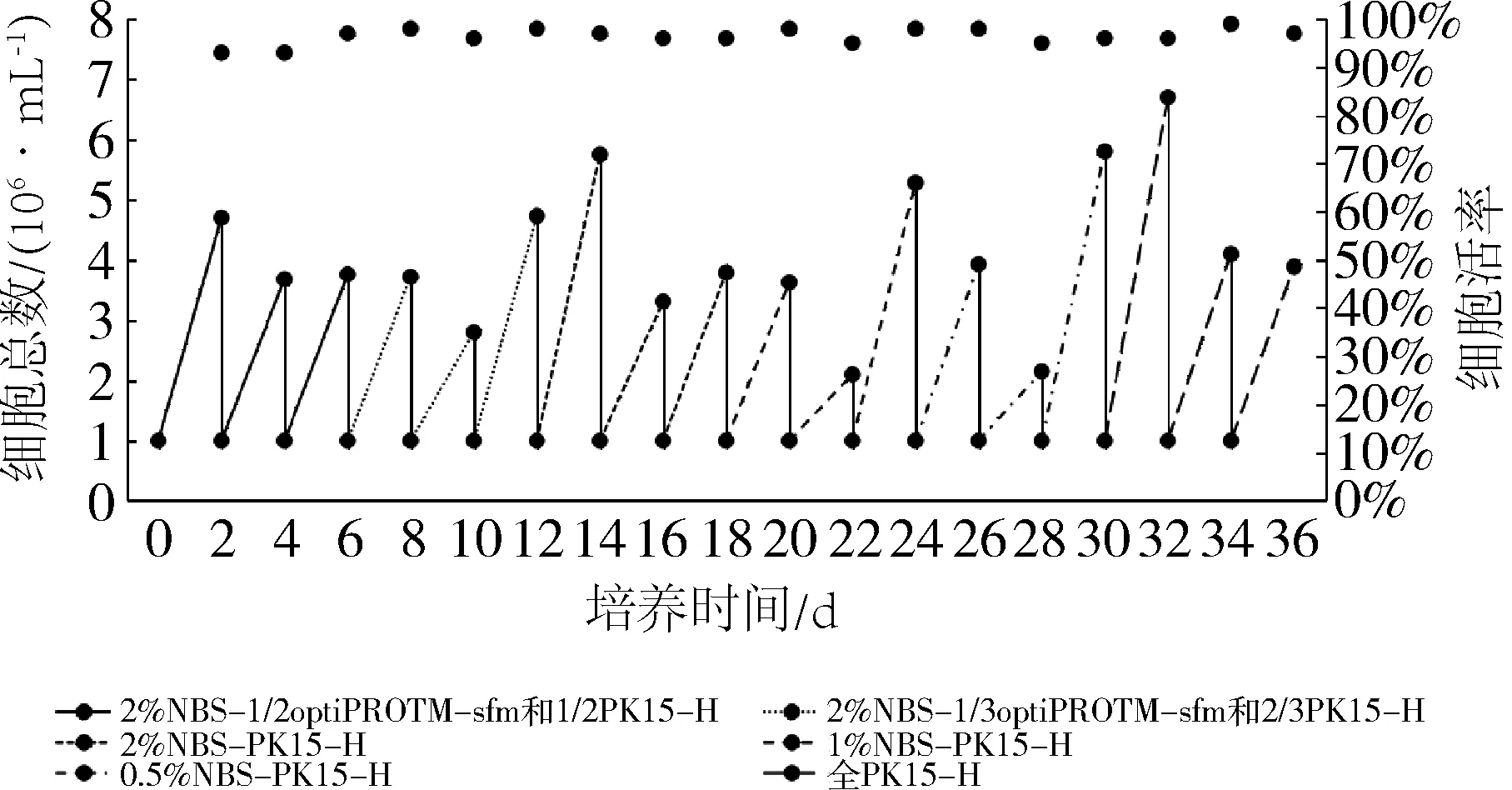
图4 悬浮培养阶段PK15细胞密度及活率情况Fig 4 Density and survival rate of PK15 cells in suspension culture stage
2.2 PK15-S增值的稳定性 为了验证该驯化细胞的稳定性,本实验又将驯化后冻存细胞再次复苏,并按初始密度0.5×106/mL连续传11代,同时对糖和乳酸含量进行检测,结果见表6。
2.3 PK15-S倍增时间的测定 取驯化稳定细胞,培养至144 h,每24 h取样计数,绘制细胞生长曲线(图5);根据该曲线计算细胞倍增时间为22.7 h。
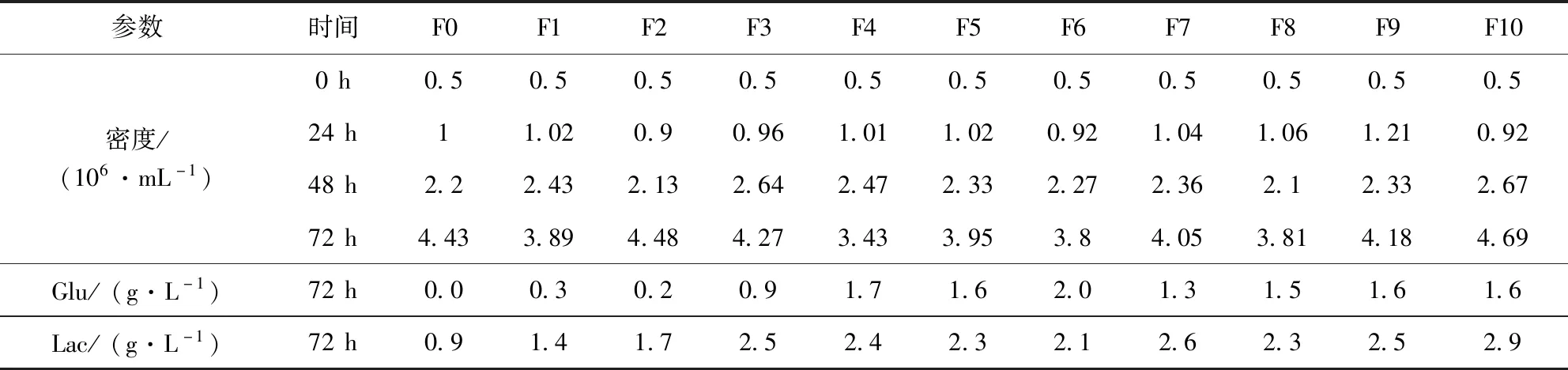
表6 PK15-S细胞生长情况Tab 6 PK15-S Cells growth situation

图5 PK15-S细胞生长趋势图Fig 5 PK15-S cell growth trend graph
3 讨论与结论
PK15细胞主要用于生产PCV2型和猪细小病毒,近年来,培养方式也逐渐由滚瓶系统提升为微载体系统,但目前仍有少部分生产厂家沿用滚瓶系统进行培养,滚瓶培养的主要缺点是劳动强度大,比表面积小,占用空间大,培养条件难以检测和控制[7]。通过生物反应器运用微载体系统进行大规模培养改进了滚瓶培养模式的不足。张立等[8]运用球转球的方法成功将Vero细胞由5 L生物反应器放大培养至50 L生物反应器。但是,大部分微载体放大培养需要用胰酶进行消化,消化后的细胞存在贴壁时间不同的现象,消化后的微载体与新加入的微载体表面存在差异,两种因素均会造成细胞再次贴壁的不均匀,从而影响产毒结果;并且微载体存在价格昂贵,重复利用效果不好,贴壁条件苛刻,暴露环节多等劣势。两种培养方式均需要有牛血清的添加,增加成本的同时也给下游纯化工作带来一定的麻烦,所以驯化一株无血清全悬浮PK15细胞可以提升培养工艺,也使培养方法更简单,操作性更高。
该株PK15细胞,从复苏到最终驯化成全悬浮PK15-S细胞,经过3种培养方法的驯化,共23个代次的传代,细胞状态良好,驯化过程中偶有接团现象,细胞活率较高,最高密度可达4.0×106/mL左右,倍增时间在24 h左右。
驯化过程中,由于细胞生长方式的改变,细胞会以相互聚集即成团的现象生长,消化传代可以改善成团问题,也可以添加一些除团的组分来除团。同一种病毒对同一细胞的不同克隆株的敏感性不同,同一细胞所处外环境不同,同一病毒的敏感性也会有所差异[9],为了避免做无用功,定期的检测细胞对毒的敏感性是很关键的。另外,在细胞驯化过程中及时的冻存细胞也是很重要的,因为驯化过程中操作步骤多,污染风险大,及时保种可以避免重复工作。
无血清全悬浮的培养工艺优势在于细胞密度大,操作方便,对于非CPE病毒可采用半连续培养连续收获病毒,提高了产量降低了成本,血清的去除减轻了下游工艺的工作压力,但全悬浮细胞对培养基的成分和搅拌式生物反应器的结构要求较高,对剪切力也非常敏感,常添加PF-68等表面活性剂来保护细胞达到所需密度,在今后的大规模生产中仍需对培养条件进行更深入的研究。

