中兽药散剂中非法添加酰胺醇类药物的检测方法研究
高 婷,李应超,王亚芳,张连彦,张小飞,钟昆芮
(北京市兽药监察所,北京 102629)
酰胺醇类药物,主要有氯霉素、甲砜霉素及氟苯尼考,其作为一种抑菌性广谱抗生素,作用是抗感染,可作用于细菌核糖核蛋白体的 50S 亚基,而阻挠蛋白质的合成[1]。由于其价格低廉,可大量生产,因此有些不法商家将酰胺醇类药物加入绿色、安全的中兽药散剂中,以提高药物抗菌作用。添加的化学药物与中药的相互作用既有可能减弱疗效,又有可能对动物产生新毒副作用[2-3]。非法添加酰胺醇类药物导致畜禽产品中药物残留,对人的造血系统、消化系统具有严重的毒性反应,有可能引发人的再生障碍性贫血[4-5],因此急须建立一种稳定的、可靠的方法监测中兽药散剂中酰胺醇类药物的非法添加现象。
目前,中兽药制剂中非法添加化学药物分析检测的技术手段主要有显微鉴别[6]、薄层色谱分析[7]、高效液相色谱[8-9]、液质联用技术[10]等。显微鉴别方法能够实现快速检测,但该方法只能进行初步定性;薄层色谱分析也是起到初筛的作用,存在假阳性的风险;液质联用技术—般不作为主要分析手段用于常量分析。高效液相色谱以分离性能高、分析速度快,通过保留时间及紫外图谱双重定性,减小了假阳性的可能性,因此,高效液相色谱不仅是兽药检验的常用分析方法,也是检查中兽药制剂中非法添加化学药物的最主要的分析手段。
实验在上述文献的基础上,结合国家标准,对中兽药散剂中非法添加酰胺醇类药物进行研究,以满足检测需要。试样经40%甲醇溶解、离心、定容,最后经高效液相色谱二极管阵列检测器检测。本方法快速、高效,能够准确测定中兽药散剂中非法添加的酰胺醇类药物。
1 材料与方法
1.1 仪器与试剂 高效液相色谱仪(Agilent 1100,美国,配有二极管阵列检测器)、电子天平(Mettler Toledo,瑞士)。甲醇、乙腈(色谱级,美国Fisher公司),实验用水由MilliQ-Gradient 超纯水系统(美国Millipore公司)制备。
1.2 对照品 甲砜霉素对照品(来源:中国兽医药品监察所,批号K0241406,含量99.7%)、氟苯尼考对照品(来源:中国兽医药品监察所,批号K0301305,含量99.3%)、氯霉素对照品(来源:中国药品生物制品检定研究院,批号130555-201203,含量99.8%)。
1.3 供试品 健胃散、止痢散、球虫散、胃肠活等中兽药散剂均来自企业审批检验的合格产品。
1.4 色谱条件 色谱柱为Waters Atiantis©T3 5 μm,4.6 mm×250 mm。流动相A为甲醇;流动相B为乙腈;流动相C为水,梯度洗脱。流速1.0 mL/min;检测波长为224和278 nm;进样体积为10 μL。流动相梯度洗脱方法如表1所示。

表1 梯度洗脱方法Tab 1 The method of gradient elution
1.5 标准溶液的制备
1.5.1 对照品储备溶液 分别精密称取甲砜霉素、氟苯尼考、氯霉素对照品50、50、125 mg置100 mL量瓶中,加40%甲醇溶液超声使溶解,用40%甲醇溶液稀释至刻度,浓度分别为0.5、0.5、1.25 mg/mL,用时根据需要稀释至相应浓度。
1.5.2 系统适用性溶液 精密称取甲砜霉素、氟苯尼考和氯霉素对照品各25 mg,置50 mL量瓶中,加40%甲醇溶液适量,超声使溶解,放置至室温,加40%甲醇溶液稀释至刻度,摇匀;精密量取5 mL,置50 mL量瓶中,加40%甲醇溶液稀释至刻度,摇匀,浓度为50 μg/mL。
1.6 样品溶液的制备
1.6.1 阴性样品储备溶液 分别称取供试品0.50 g,精密加入50 mL 40%甲醇溶液超声,6000 r/min离心5 min,取上清液备用。
1.6.2 阴性样品溶液 精密量取阴性样品储备液1 mL,精密加入9 mL 40%甲醇溶液,混匀,上机前使用0.45 μm滤膜过滤。
1.6.3 阳性样品溶液 精密量取阴性样品储备液1 mL,精密加入对照品储备液1 mL和8 mL 40%甲醇溶液,混匀。上机前使用0.45 μm滤膜过滤。
1.6.4 阳性添加样品 按照甲砜霉素、氟苯尼考及氯霉素制剂常用规格,即5%,5%,12.5%的比例在供试品中添加3种酰胺醇类药物。
2 结果与分析
2.1 系统适用性试验 取40%甲醇溶液、系统适用性溶液、阴性样品溶液、阳性添加样品溶液,在本试验确定色谱条件下测定,记录色谱峰,如图1,图2,图3,图4所示。在此测定条件下,40%甲醇溶液及各阴性样品溶液对待测组分没有干扰,各药物之间的分离度良好,甲砜霉素、氟苯尼考和氯霉素的出峰时间分别为9.1、18.7、24.2 min,各目标峰纯度角小于纯度阈值,表明峰的纯度较好。

图1 40%甲醇溶液色谱图Fig 1 The chromatogram of 40% Methanol solution

图2 酰胺醇类药物对照品溶液(50 μg/mL)色谱图Fig 2 The chromatogram of Amide alcohol reference solution (50 μg/mL)

图3 健胃散-空白色谱图Fig 3 The blank chromatogram of Jianweisan

图4 健胃散-添加(50 μg/mL)色谱图Fig 4 The chromatogram of Jianweisan-addition (50 μg/mL)
2.2 精密度试验 取浓度为50 μg/mL的甲砜霉素、氟苯尼考和氯霉素的混合标准溶液,在本试验确定色谱条件下,连续进样6次,其峰面积的RSD分别为0.11%、0.11%、0.13%,表明在该色谱条件下检测,标准溶液精密度良好。
2.3 重现性试验 按阳性添加样品的制备方法制备6份健胃散添加溶液,在本试验确定色谱条件下进样,测定甲砜霉素、氟苯尼考和氯霉素的峰面积,RSD分别为2.13%、2.56%、2.29%,表明此方法的重现性良好。
2.4 检测限 精密量取各样品的阴性样品储备液1 mL,置15 mL离心管中,精密加入系统适用性溶液适量(0.5 mL、0.6 mL和0.8 mL),用40%甲醇溶液稀释至10 mL,摇匀,在本试验确定色谱条件下进样,以光谱未失真的最低添加量作为检测限。经对比光谱图及纯度峰,所检测药物中甲砜霉素的检测限为3 g/kg、氟苯尼考及氯霉素的检测限均为4 g/kg,如图5至16所示。

图5 甲砜霉素-对照品(50 μg/mL)光谱图Fig 5 The spectrum of Thiopentomycin-reference (50 μg/mL)

图6 甲砜霉素-对照品(50 μg/mL)纯度峰Fig 6 The purity peak of Thiamphenicol- reference (50 μg/mL)

图7 氟苯尼考-对照品(50 μg/mL)光谱图Fig 7 The spectrum of Fluoroquinol -reference (50 μg/mL)

图9 氯霉素-对照品(50 μg/mL)光谱图Fig 9 The spectrum of Chloramphenicol-reference (50 μg/mL)
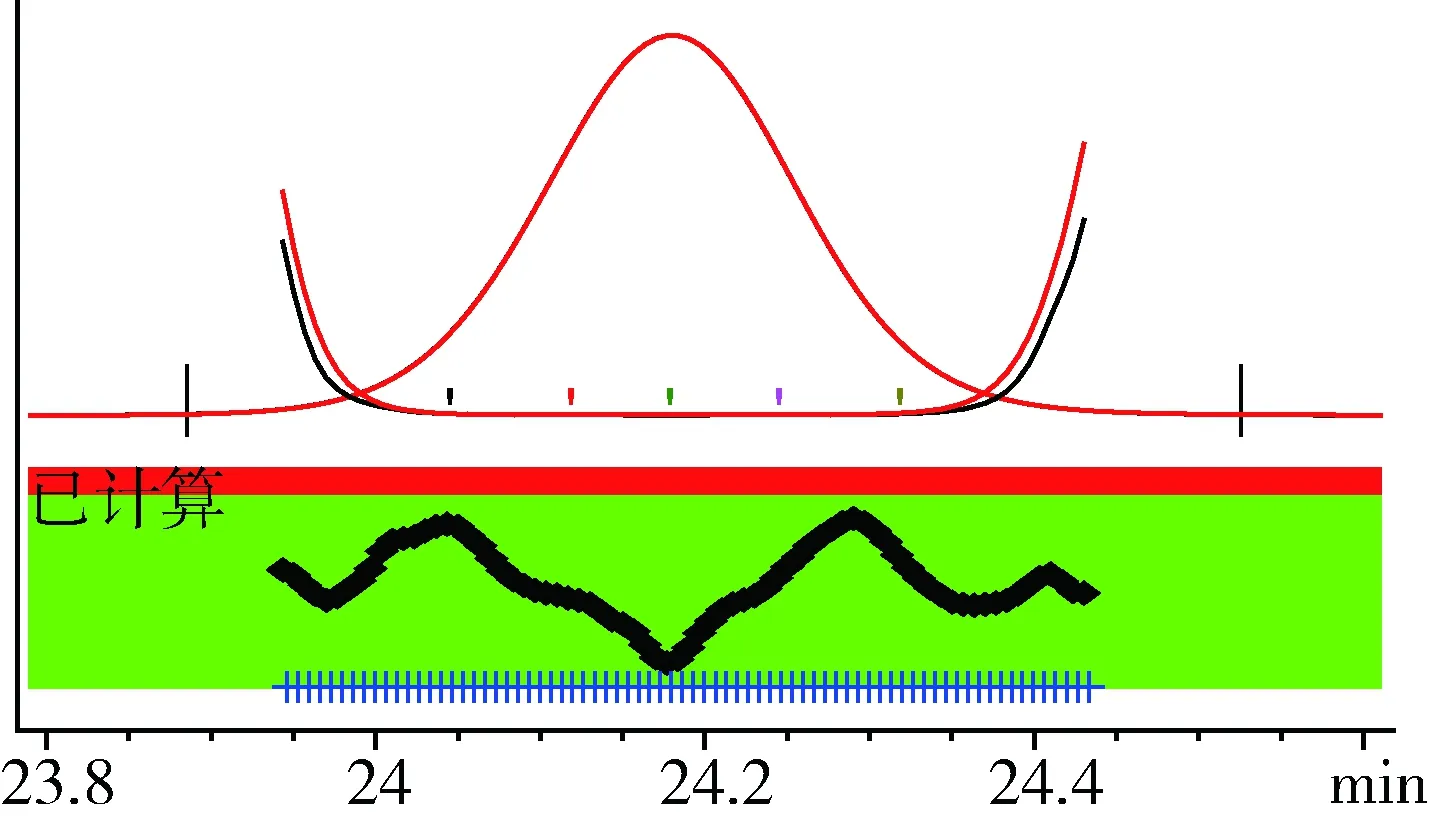
图10 氯霉素-对照品(50 μg/mL)纯度峰Fig 10 The purity peak of Chloramphenicol-reference (50 μg/mL)

图11 止痢散(甲砜霉素3 g/kg)光谱图Fig 11 The spectrum of Zhili San (Memboxin 3 g/kg)

图12 止痢散(甲砜霉素3 g/kg)纯度峰Fig 12 The purity peak of Zhili San (Memboxin 3 g/kg)

图13 止痢散(氟苯尼考4 g/kg)光谱图Fig 13 The spectrum of Zhili San (Flufenicol 4 g/kg)

图14 止痢散(氟苯尼考4 g/kg)纯度峰Fig 14 The purity peak of Zhili San (Flufenicol 4 g/kg)

图15 止痢散(氯霉素4 g/kg)光谱图Fig 15 The spectrum of Zhili San (Chloramphenicol 4 g/kg)

图16 止痢散(氯霉素4 g/kg)纯度峰Fig 16 The purity peak of Zhili San (Chloramphenicol 4 g/kg)
2.5 标准曲线的绘制 精密量取甲砜霉素、氟苯尼考和氯霉素的对照品储备液,用40%甲醇稀释至浓度分别为10、20、50、100、250、500 μg/mL,在本试验的色谱条件下进行测定,以系列标准溶液的浓度为横坐标,峰面积为纵坐标绘制标准曲线,三种药物的线性方程分别为y=21.46x-7.1245;y=21.009x-4.1586;y=15.876x-3.5812,相关系数R2均在0.999以上,如图17所示。结果表明,三种药物在10~500 μg/mL浓度范围内时,药物浓度与相应峰面积线性关系良好。
2.6 加样回收率试验 在阴性样品中按照80%,100%,120%添加甲砜霉素、氟苯尼考和氯霉素3种酰胺醇类药物,按外标法计算其回收率,三种药物的回收率在均在98.0%~103.0%,变异系数均在0.6%~1.6%,其试验结果如表2所示。

图17酰胺醇类药物标准曲线方程与相关系数Fig 17 Standard curve equation and correlation coefficient of amide alcohols

表2 中兽药散剂中添加酰胺醇类药物(甲砜霉素、氟苯尼考和氯霉素)的回收率和变异系数(n=9)Tab 2 Recovery and coefficient of variation of amide alcohols (Methamphetamine,Florfenicol and Chloramphenicol)added to Chinese veterinary drug powder (n=9)
3 讨论与结论
3.1 中兽药散剂种类的选择 一直以来,中兽药具有绿色、安全、无残留的特点,备受广大养殖户的青睐,寄托了兽医兽药行业的厚望。本试验选择的四种中兽药散剂为养殖过程中的常用药,均有一定的预防和治疗肠道感染的作用。其中健胃散具有治疗呕吐反胃、消化不良的功效;止痢散具有治疗湿热泻痢、热毒血痢的功效;球虫散具有抗球虫病、凉血止血的功效;胃肠活具有治疗消化不良的功效。酰胺醇类药物,属抑菌性广谱抗生素,用于治疗敏感细菌所致的呼吸系统、肠道及尿路等感染,故在畜禽养殖中极有可能被非法添加到上述四种中兽药散剂中,用于加强预防及治疗细菌感染。
3.2 色谱柱及柱温的选择 通过改变柱温,未见色谱图有明显变化,考虑到本方法检测较多样品及采用梯度洗脱的方式,试验选择以35℃为检测温度,以提高色谱峰的重现性。本试验使用了不同品牌、不同型号的色谱柱:Waters Atiantis®T3 (5 μm,4.6 mm×250 mm)、Waters symmetry C18 (5 μm,4.6 mm×250 mm)、Waters Xterra C18(5 μm,4.6 mm×250 mm)、Agilent Eclipse XDB-C18(5 μm,4.6 mm×150 mm)等色谱柱,综合考虑待测组分与其他药物的分离度,以及保留时间和灵敏度,只有Waters Atiantis©T3(5 μm,4.6 mm×250 mm)对甲砜霉素保留时间较长,能使被测成分有效的分离,并且与其他成分峰不产生干扰。其他色谱柱不能使中兽药制剂与三种酰胺醇类药物有效的分离,或者不能将三种被测药物有效的分离。
3.3 流动相的选择 试验在优化流动相的过程中尽量避免引入酸或盐类物质,以免减少柱子寿命。本试验探究了甲醇-水、乙腈-水、甲醇-乙腈-水三种流动相组合,经比较甲醇-乙腈-水的分离效果比甲醇-水或乙腈-水的分离效果要好。由于中药的成分比较复杂,等度洗脱未能完全实现药物的基线分离,因此选择梯度洗脱,洗脱程序为表1,其中甲砜霉素的极性最强,最先出峰,保留时间为9.3 min,氟苯尼考居中,保留时间为19.1 min,氯霉素的极性最弱,最后出峰,保留时间为24.2 min,此时三种酰胺醇类药物能实现基线分离,并能与中兽药制剂中的成分有效的分离。
3.4 结论 试验采用高效液相色谱-二极管阵列检测器、梯度洗脱的方法,建立的中兽药散剂中非法添加酰胺醇类药物检查方法,能够实现添加的酰胺醇药物与固体制剂药物中其他成分的有效分离,经峰纯度检查确保酰胺醇类药物出峰处无干扰,同时该方法较稳定、准确、重现性好,可用于中兽药散剂中酰胺醇类药物的检测。此外,经试验验证,该方法对于β-内酰胺类、四环素类等固体药物制剂中酰胺醇类非法添加的检测也具有较好的效果。

