青蒿琥酯对大肠杆菌临床分离株抗生素敏感性的影响研究
魏思敏,汪培嘉,田启明,陶 娅,刘明江,李金贵*
(1.扬州大学兽医学院,江苏扬州 225009;2.江苏省动物重要疫病与人畜共患病防控协同中心,江苏扬州 225009)
抗生素的发现和大规模生产与使用是医学史上的巨大进步,挽救了数以亿计的病人。除临床使用外,抗生素还作为饲料添加剂广泛应用于动物养殖业,在预防和治疗动物传染性疾病,促进动物生长及提高饲料转化率等方面发挥了重要作用。但抗生素的不合理使用,甚至滥用,导致细菌耐药性不断发展,在各类致病菌及人与动物共生菌中都出现了抗生素耐药性,并由单一耐药发展为多重耐药[1]。多重耐药菌的增多与新型抗生素研发进展缓慢之间的矛盾日益凸显,并可能导致无药可用的“后抗生素时代”或“耐药时代”。因此,亟需寻找不同的途径来解决耐药问题[2]。在没有新抗生素的情况下,对耐药菌可根据药敏试验结果采用联合两种或两种以上抗生素进行治疗[3]。研究表明,青蒿素的衍生物青蒿琥酯(artesunate,ARS)除了具有抗疟作用外,对于临床常见的致病菌如大肠埃希菌(Escherichiacoli,E.coli)、金黄色葡萄球菌、痢疾杆菌等感染的治疗均有一定效果[4-5],且可增强大肠杆菌和铜绿假单胞菌对头孢类抗生素的敏感性[6-7]。但目前ARS与抗生素联合抑菌的研究还比较有限,本研究拟通过肉汤稀释法和平皿打孔法检测ARS单独或联合抗生素对畜禽源临床分离E.coli耐药株的体外抑菌效果,以期为ARS的临床使用提供参考。
1 材 料
1.1 主要试剂 ARS购自桂林南药股份有限公司,含量>97%;抗生素购自上海吉至生化科技有限公司,包括阿米卡星(amikacin,AMK)、链霉素(streptomycin,STR)、环丙沙星(ciprofloxacin,CIP)、头孢噻肟(cefotaxime,CTX)、粘菌素(colistin,COL)、土霉素(terramycin,TER)和多西环素(doxycycline,DOX);细菌培养基均购于青岛高科园海博科技有限公司(青岛海博生物技术有限公司)。
1.2 试验菌株及菌液制备 临床分离畜禽源E.coliMC02、AHM5C23、SHPP23-3、AHCH24-1T、SNJ23、SHPP41,由扬州大学动物医院王彦红博士提供。标准菌株E.coliATCC25922由本实验室保存。
将E.coli复壮并增菌培养2~3代,挑选单个菌落接种于LB培养基,置于37 ℃培养箱中培养至对数生长期。
1.3 ARS及抗生素的制备 将60 mg ARS溶于1 mL 5%碳酸氢钠水溶液中混匀备用。精确称取抗生素,用各自对应的缓冲液将抗生素配制成浓度为5120 μg/mL的母液备用。
2 方 法
2.1 最小抑菌浓度(Minimum inhibitory concentration,MIC)的测定 参照临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)发布的标准(M100,2017),采用微量肉汤稀释法测定大肠杆菌对ARS以及10种抗生素的敏感性。在96孔板中对受试药物进行连续二倍稀释,并使用钙离子调节的MH肉汤将培养至对数生长期的E.coli稀释为1.0×105CFU/mL,随后将其接种到含有药物的96孔板中[8]。在37 ℃下孵育16~20 h后读取结果。质控菌株选用E.coliATCC 25922标准菌株,所有抗生素和培养基均在质控范围内。
2.2 抗生素与ARS联合药敏试验 采用肉汤棋盘稀释法测定ARS分别与AMK、STR、CIP、CTX、COL、TER、DOX 7种抗生素联合时的分级抑菌浓度(fractional inhibitory concentration,FIC)。
根据所测得的每种药物对每种菌株的MIC值,将ARS与其他抗生素分别用钙离子调节的无菌MH肉汤在96孔板中倍比稀释为2 MIC、1 MIC、1/2 MIC、1/4 MIC、1/8 MIC、1/16 MIC,随后将培养至对数生长期的E.coli稀释为2.0×105CFU/mL并接种到含有药物的96孔板中使终体积为200 μL。以无菌MH肉汤作为阴性对照,不含药物的稀释菌液作为阳性对照,在37 ℃培养箱中孵育16~20 h后读取结果,以无细菌生长的最低药物浓度为联用MIC。通过公式计算FIC指数,进而判断ARS与其他抗生素联用的作用效果。
FIC指数= (甲药联用MIC/甲药单用MIC)+ (乙药联用MIC/乙药单用MIC),FIC指数判读结果如下:FIC指数≤0.5时,两药为协同作用;0.5
2.3 ARS对抗生素抑菌圈直径影响试验
2.3.1E.coli预处理 将生长至对数生长期的E.coli母液分别接种至含有512、256、128 μg/mL ARS的10 mL MH肉汤中,细菌终浓度为1×105CFU/mL,并设置不加ARS的空白对照组,于200 r/min,37 ℃摇床中培养大肠杆菌至对数增长期进行抗生素抑菌圈测定。
2.3.2 打孔法测定抑菌圈直径 将预处理的各组菌液分别稀释至5×105CFU/mL后,吸取200 μL滴加到MH 琼脂平皿中均匀涂布,用直径为4 mm的无菌打孔器于平皿表面打孔后加入抗生素,根据CLSI标准,抗生素含量如下:AMK 30 μg,STE 10 μg,CIP 5 μg,CTX 30 μg,COL 10 μg,TER 30 μg,DOX 30 μg。37 ℃ 培养16~18 h后,使用游标卡尺测定抑菌圈直径大小[10]。
2.4 统计分析 采用GraphPad Prism 6软件对数据进行单因素方差分析(one-way ANOVA),统计数据采用“平均数±标准差”表示,P<0.05作为组间差异显著性的判断标准。每组试验均重复三次以上。
3 结果与分析
3.1 抗生素与ARS的MIC ARS与7种抗生素对6株临床分离E.coli的MIC结果见表1。结果表明,每种受试菌株对本试验采用的7种抗生素至少两种耐药,其中E.coliMC02和E.coliAHM5C23对5种以上抗生素耐药。另外,ARS单独使用时5120 μg/mL仍没有抗菌作用。

表1 抗生素与ARS对6株临床分离E.coli的MICTab 1 MICs (μg/mL)of different antibiotics for 6 clinical E.coli isolates.
肩标“R”表示耐药。AMK:敏感,MIC ≤ 16 μg/mL 和耐药 MIC >64 μg/mL;CIP:敏感,MIC ≤1 μg/mL 和耐药 MIC >4 μg/mL;CTX:敏感,MIC ≤1 μg/ml 和耐药 MIC >4 μg/mL;COL:敏感,MIC ≤ 2 μg/mL 和耐药 MIC >4 μg/mL;TER:敏感,MIC ≤4 μg/mL 和耐药 MIC >16 μg/mL;DOX:敏感,MIC≤ 4 μg/mL 和耐药 MIC >16 μg/mL;STR尚无MIC解释标准 (CLSI,2017)。
“R” means resistance.AMK:Susceptible,MIC ≤ 16 μg/mL and resistant MIC >64 μg/mL;CIP:Susceptible,MIC ≤ 1 μg/mL and resistant MIC >4 μg/mL;CTX:Susceptible,MIC ≤ 1 μg/mL and resistant MIC >4 μg/mL;COL:Susceptible,MIC ≤ 2 μg/mL and resistant MIC >6 μg/mL;TER:Susceptible,MIC ≤ 4 μg/mL and resistant MIC >16 μg/mL;DOX:Susceptible,MIC ≤ 4 μg/mL and resistant MIC >16 μg/mL;breakpoints of STR is not defined (CLSI,2017).
3.2 抗生素与ARS的协同作用 在测试六株临床分离株中,E.coliMC02和E.coliAHM5C23耐药最为严重,因此,将ARS分别与抗生素联合使用,由表2和表3可见,抗生素与ARS联用后,MIC值随ARS浓度增加呈下降趋势,当ARS为512 μg/mL时,7种抗生素分别与ARS联用对E.coliMC02的FIC指数均小于0.5,表现为协同作用。对于E.coliAHM5C23,除STR与ARS联用的FIC指数为0.6,表现为相加作用外,其余6种受试抗生素与ARS联用均表现为协同效应。
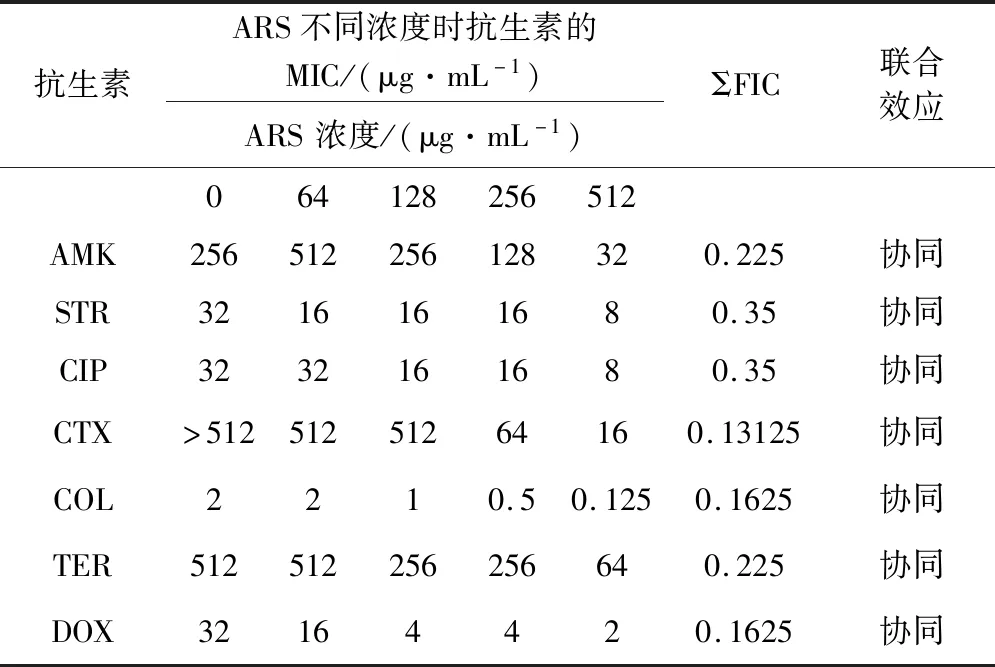
表2 抗生素联合ARS抗E.coli MC02的作用效果Tab 2 Results of antibiotics in combination with ARS for E.coli MC02.

表3 ARS联合抗生素抗E.coli AHM5C23的作用效果Tab 3 Results of antibiotics in combination with ARS for E.coli AHM5C23
3.3 ARS增加抗生素对临床耐药E.coli的抑菌圈直径 对于耐药E.coliMC02和E.coliAHM5C23,ARS对抗生素抑菌圈影响的结果如图1所示,浓度为1024 μg/mL的ARS能够增大STR与COL的抑菌圈直径;ARS浓度为512 μg/mL时,COL对E.coliAHM5C23和STR对E.coliMC02的抑菌圈增加,其余五种抗生素的抑菌圈未有显著改变。
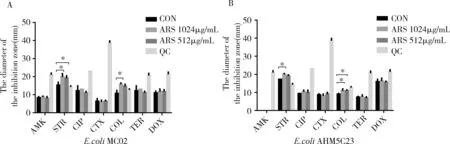
图1 ARS对抗生素抑菌圈直径的影响(A.抗生素对E.coli MC02抑菌圈直径;B.抗生素对E.coli AHM5C23抑菌圈直径;CON:空白对照组(Control);QC:质控(Quality control);*P<0.05 vs control)Fig 1 The Effect of ARS on the diameter of antibiotics inhibition zone(A.The diameter of inhibition zone for E.coli MC02.B.The diameter of inhibition zone for E.coli AHM5C23.CON:Control,QC:Quality control,*P<0.05 vs control)
4 讨论与结论
抗生素被誉为“20世纪医药领域最伟大成就之一”,但由于其广泛、持续甚至不当使用,细菌耐药问题越来越严重[11],已被列为将会对世界经济产生深远影响的五项潜在因素之一[12]。在耐药菌中,致病性E.coli作为对养殖业危害最大的细菌之一,其耐药问题一直是研究的热点。由耐药菌株引起的感染性疾病来势凶猛,常规抗生素很难抑制耐药菌株的生长,其发病率增高、治疗难度大、致死率高,严重影响人类的生存与健康和畜牧养殖业的发展[13]。但新型抗菌药物的研发困难重重,因此,越来越多的研究学者开始把重点投向耐药菌株本身,包括如何提高其对抗菌药物的敏感性、如何逆转其耐药性等方面。中药含有多种有效的抗菌成分,中药及其复方的抗菌作用过程是多环节、多目标、多靶点的复杂作用过程[14]。目前,鲜有中药耐药菌的报道,这让中药逆转耐药性的作用研究引起大家的注意,也成为研究的热点之一。在本试验中,发现ARS能增加多种抗生素对耐药大肠杆菌的敏感性,具有显著的协同效应,ARS是一种半合成的青蒿素衍生物,除了具有显著的抗疟作用外,还被发现其他药理活性,如抗寄生原虫、抗真菌、抗肿瘤等[15]。然而,关于ARS的抗菌活性以及联合用药方面的报道仍不多见。本试验着重于研究ARS单独及其与抗生素联用时的体外抑菌效果。结果发现,ARS对六株受试临床分离株的MIC均大于5120 μg/mL,提示ARS单独作用时不具有抗菌作用,因此,考虑将其与抗生素联合,对受试菌株中多药耐药的E.coliMC02和E.coliAHM5C23。进行体外联合抑菌实验。结果表明ARS与7种抗生素分别联用时,抗生素的MIC可以降低2~32倍以上,提示ARS与多种抗生素联用具有协同作用,能够明显降低抗生素的用量,或可作为抗菌增效剂使用,对提高抗生素安全性和延缓耐药具有重要意义。但目前ARS的增敏机制仍不明确,需结合体内实验,系统全面地揭示其作用,进一步明确ARS的增敏机制及其联合抗生素对耐药大肠杆菌病的作用效果。Feng等研究发现20 mg/kg ARS用于类风湿性关节炎大鼠模型能有效减轻炎症的发展,且没有肝脏毒性[16],由此可以看出,虽然ARS在体外试验中发挥增敏作用的浓度较抗生素正常用量仍处于较高水平,但在体内试验中ARS的使用量符合常规用量。
使用联合药敏试验中ARS的有效浓度512 μg/mL及其2倍用量1024 μg/mL预处理两种耐药E.coli,微量肉汤稀释法对其进行药敏试验,并未发现MIC值的改变,因此,采用平皿打孔法观察抗生素对ARS预处理后E.coli抑菌圈直径的细微变化,发现预处理后仅能增大STR和COL对E.coli的抑菌圈直径,其增敏作用远不及ARS与抗生素同时使用时的效果。因此,ARS与抗生素同时使用会有更好的应用价值,这为ARS或中药(包括中药有效成分)在细菌性疾病领域的研究和临床实践提供了参考。

