某院CRAB同源性及其生物膜形成能力分析
曾 婷,曾 凌,曹先伟,邓 琼,张 杰
(1. 南昌大学公共卫生学院,江西 南昌 330006; 2.江西省预防医学重点实验室,江西 南昌 330006; 3. 南昌大学第一附属医院医院感染管理科,江西 南昌 330006; 4. 南昌大学医学院,江西 南昌 330006)
鲍曼不动杆菌(Acinetobacterbaumannii,AB)是一种非发酵革兰阴性杆菌,能够引起广泛的医院感染。碳青霉烯类药物具有广泛的抗菌谱和较强的抗菌活性,是治疗AB首选药物。随着碳青霉烯类药物的普遍使用,以及AB固有的或获得性耐药特性,导致了耐碳青霉烯类鲍曼不动杆菌(carba-penem-resistantAcinetobacterbaumannii,CRAB)的克隆广泛流行[1]。CHINET监测网监测结果显示,AB对美罗培南和亚胺培南的耐药率从2014年的66.7%和62.4%,分别上升至2018年的78.1%和77.1%[2]。AB的耐药与其具有生物膜形成能力有关,研究[3]显示,42%的临床分离菌具有生物膜形成能力,且大部分产膜菌为多重耐药菌,生物膜形成能力在不同克隆菌株之间也存在差异[4],给临床防控CRAB带来了更大的挑战。对某院32株CRAB进行研究,旨在了解CRAB主要流行克隆型和生物膜形成能力,以及生物膜形成能力与克隆型、耐药率之间的关系,以期完善CRAB的防控措施,现将研究结果报告如下。
1 材料与方法
1.1 材料
1.1.1 菌株来源 收集2017年2—10月某三甲综合医院各临床科室送检分离的32株非重复CRAB菌株,所有菌株均经VITEK 2 Compact全自动微生物分析系统鉴定。

1.1.3 主要仪器与试剂 VITEK 2 Compact全自动微生物分析仪及配套的药敏纸片、恒温培养箱、比浊仪、摇床、PFGE电泳仪、酶标仪、凝胶成像系统、96孔聚苯乙烯灭菌板、磷酸盐缓冲液(PBS)、无水乙醇、1%结晶紫、限制性内切酶XbaI和ApaI、PFGE专用琼脂糖凝胶。
1.2 方法
1.2.1 药敏试验 试验菌株纯化后采用VITEK 2 Compact全自动微生物分析系统进行药物敏感性检测,参照美国临床实验室标准化协会[5](CLSI)2018年版制定的标准对检测结果进行判读。大肠埃希菌ATCC 25922为质控菌株。
1.2.2 PFGE同源性分析 将37℃培养过夜的CRAB菌落刮置CSB缓冲液中,用比浊仪调整菌悬液的浓度,菌悬液经1% Seakem Gold琼脂糖凝胶包被、蛋白酶K消化和限制性内切酶ApaI酶切后在CHEF-DR II电泳仪中进行脉冲场凝胶电泳。电泳条件:缓冲液温度14℃,电场强度6 V/cm,电场夹角120度,脉冲转换时间2.2~63.8 s,电泳时间16 h。电泳结束后用GelRed核酸染料染色,在凝胶成像系统下观察并拍照保存。参照美国疾病控制与预防中心(CDC)研究员Tenower[6]推荐的方法对PFGE结果进行判读:条带完全一致定义为同一型别,1~3条条带存在差异定义为同一型别的不同亚型,3条以上条带存在差异定义为不同型别。使用BioNumerics软件对PFGE图谱进行聚类分析,绘制树状图。
1.2.3 结晶紫染色法测定生物膜形成能力 参照相关文献[7-8],将处于对数生长期的32株CRAB菌落接种于96孔聚苯乙烯灭菌板中,200 μL/孔,3孔/株,空白培养基作为阴性对照。将96孔板置于37℃恒温箱中培养48 h后,小心地将菌液吸出,磷酸盐缓冲液(PBS)反复清洗,室温晾干后每孔加入200 μL的1%结晶紫染液染色20 min,灭菌蒸馏水将染液洗净,室温晾干后每孔加入200 μL无水乙醇溶解结晶紫10 min,用酶标仪测定每孔在570 nm处的吸光度(A)值,以3孔A值的平均值为每株菌的最终A值。生物膜形成能力结果判定[9]:测定空白培养基的最终A值,定义AC=A+3S,将待测菌株的最终A值与AC进行比较,阴性(-):A≤AC,无被膜形成;弱阳性(+):AC
1.3 统计方法 应用SPSS 22.0软件进行数据分析,计数资料采用构成比描述,χ2检验或秩和检验,P≤0.05为差异具有统计学意义。
2 结果
2.1 菌株来源 32株CRAB分离自32例患者,其中男性26例(81.3%),女性6例(18.7%),平均年龄(51.34±19.54)岁,45~60岁患者13例(40.6%)。CRAB标本主要分离自痰(46.9%),科室主要分布于新生儿重症监护病房(NICU,43.8%)。见表1。
2.2 PFGE电泳结果 PFGE图谱经聚类分析结果显示,32株CRAB可分为9个不同克隆型,分别为A~I型,A型为主要克隆型(9株),E型7株,B型和C型各4株,D型、F型和G型各2株,H型和I型各1株。见图1。
2.3 生物膜形成结果 阴性对照组AC=A+3S=0.080+3×0.007=0.101, 将32株CRAB的最终A值与AC值比较,结果显示有14株具有生物膜形成能力,占43.8%,且均为弱阳性。
2.4 生物膜形成能力与不同克隆型的分析 将不同克隆型内各菌株最终A值与AC值比较,各克隆型菌株的生物膜形成能力见表2。各克隆型间生物膜形成能力比较,差异无统计学意义(χ2=6.636,P=0.659)。
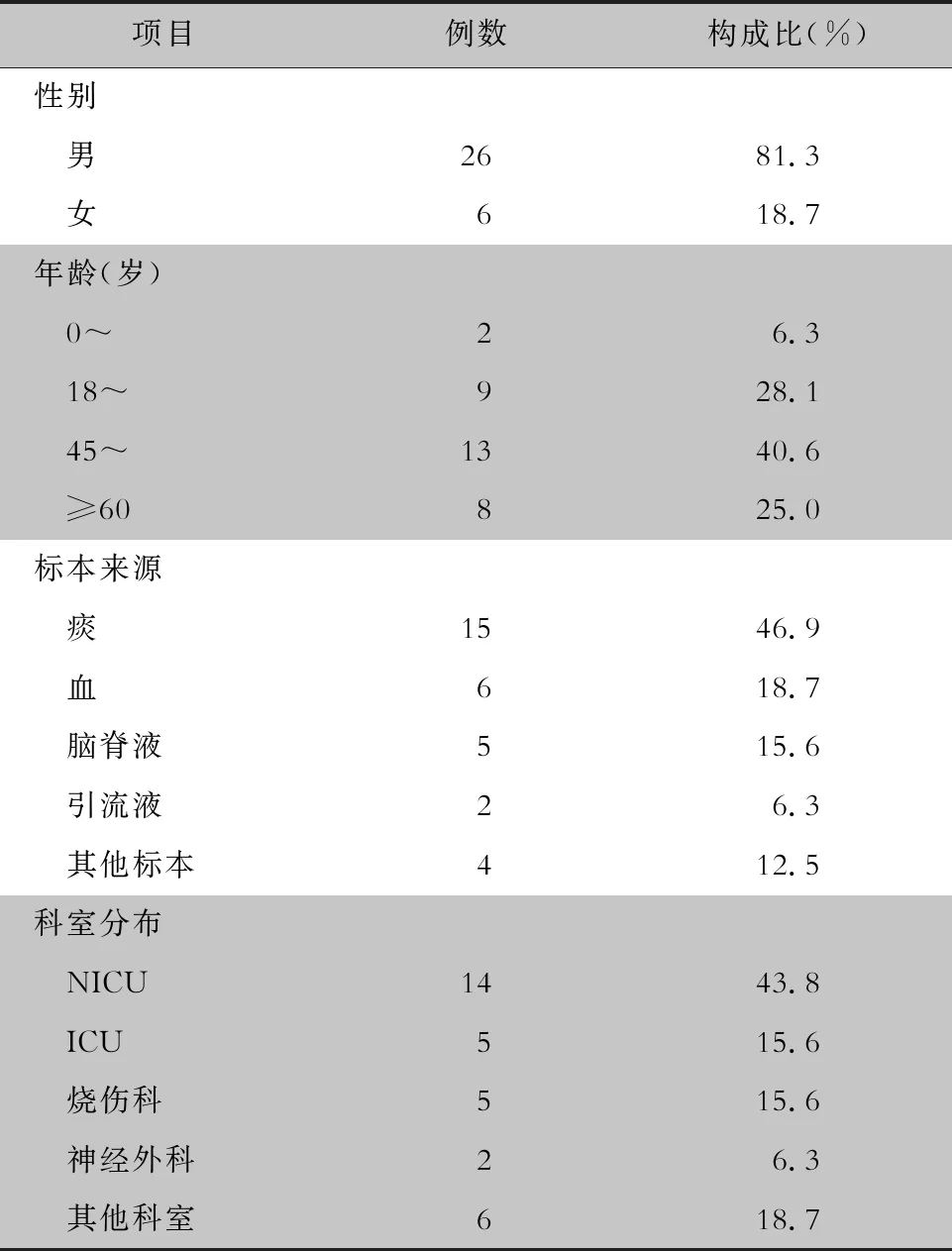
表1 32例CRAB感染患者基本特征

图1 32株CRAB的PFGE聚类分析结果
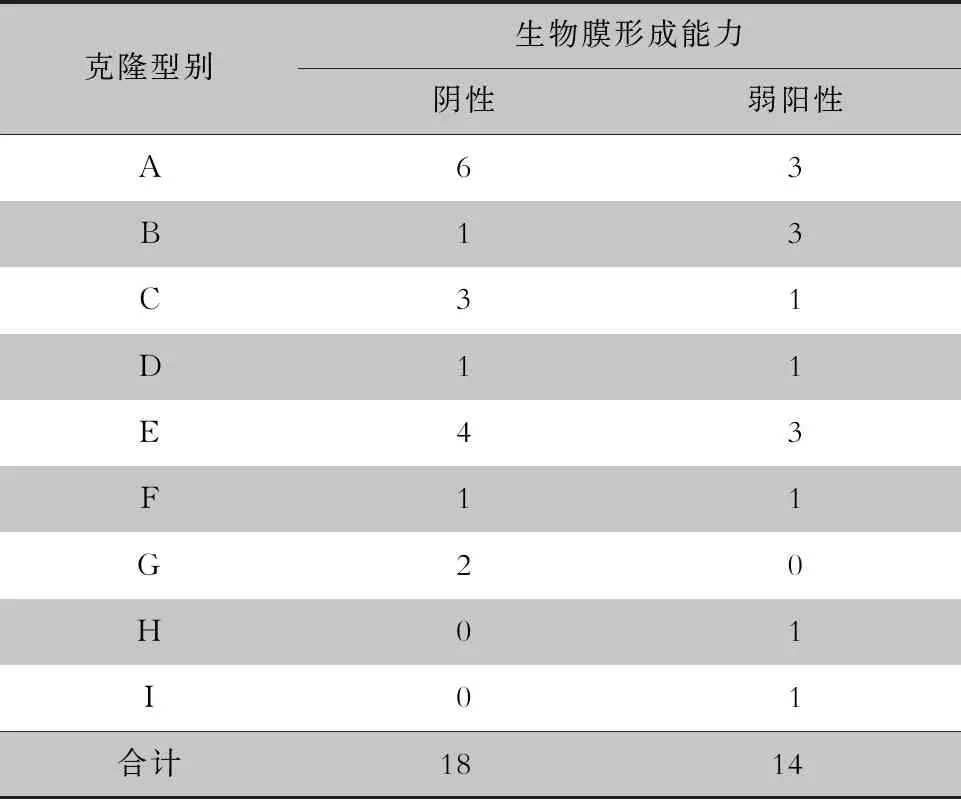
表2 不同CRAB克隆型生物膜形成能力分布

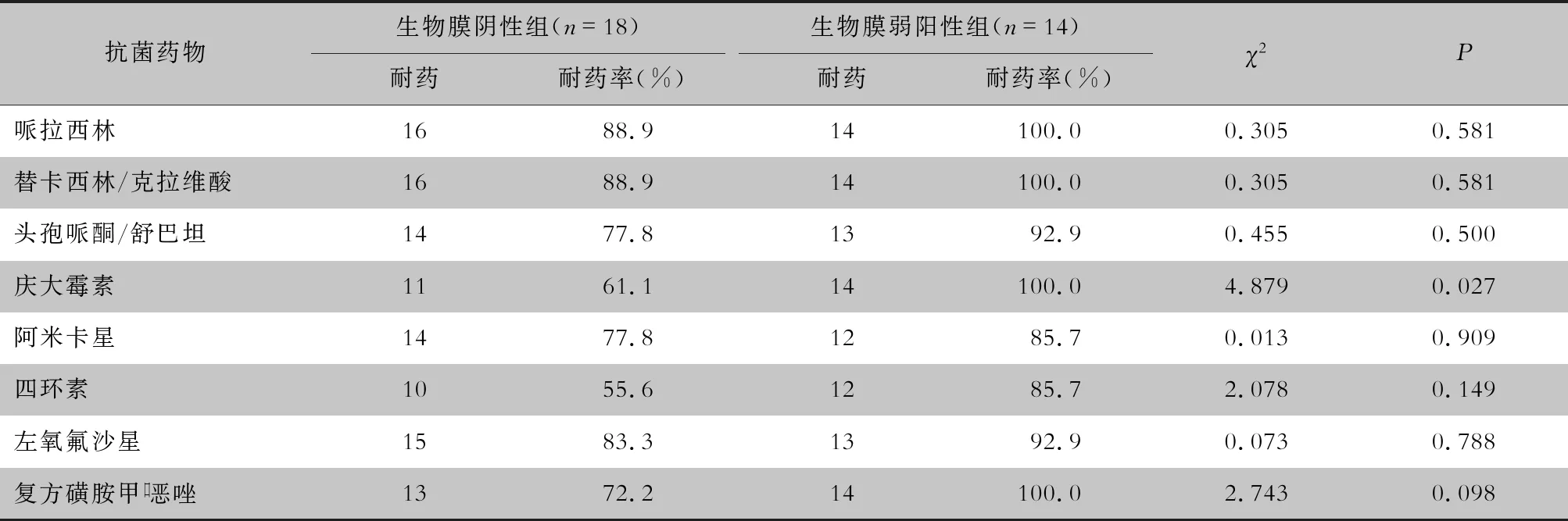
表3 32株CRAB生物膜形成能力与耐药性分析
3 讨论
AB对外界环境适应能力强,能够长期存在于空调、病床、导管、呼吸机等环境中,可引起血流感染、泌尿系统感染和医院获得性肺炎等[10]。目前,AB因多重耐药和高检出率被认为是威胁全球卫生保健系统的七大病原体之一[11],引起了人们的广泛关注。本研究32例CRAB患者平均年龄为(51.34±19.54)岁,标本主要分离于痰,提示呼吸系统是CRAB最容易感染的部位。32株CRAB均为多重耐药菌,对常用抗菌药物的耐药率均高于65%,限制了其感染临床治疗的药物选择。
PFGE具有结果稳定、重复性好、分辨率高、易于标准化等优点,是国际上公认的分子生物学分型技术的“金标准”,被广泛用于鉴定感染暴发或追踪流行[12]。PFGE研究结果显示,32株CRAB可分为9个不同克隆型,分别为A~I型,A型为主要克隆型(9株),E型7株,B型和C型各4株,D型、F型和G型各2株,H型和I型各1株。E型的A2菌株和A3菌株均为NICU患者,且住院时间有交叉,提示在NICU出现了同型别CRAB的感染,造成此现象可能与共用医疗器械相关。A型菌株传播的时间跨度最长,从2017年2月23日首次检出到2017年10月27日末次检出长达8个月,提示A型菌株长期存在于医院,并通过某些途径造成了交叉感染,但当时并未及时追踪溯源。为减少CRAB的交叉感染,应进一步加强医院环境的清洁与消毒,严格执行手卫生,完善接触隔离制度,医务人员应严格遵守无菌操作和感染控制规范[13]。
生物膜是指不可逆地黏附在物体表面,并被细菌自身基质包裹的细菌群落[14]。本研究使用结晶紫染色法对32株CRAB进行检测,发现其中14株具有生物膜形成能力且均为弱阳性。不同克隆型间生物膜的形成能力差异无统计学意义,与尹珍等[4]研究结果不一致,可能是不同地区间CRAB的传播差异所致。将生物膜阴性组和阳性组比较,发现阳性组的耐药率均有不同程度地升高,与相关研究[15-16]结果一致。具有生物膜形成能力的CRAB可通过以下两种机制提高细菌耐药性[17-18]:(1)生物膜的渗透限制,生物膜中高密度的细菌可以产生阻碍抗菌药物渗透的细胞外基质;(2)生物膜的营养限制,生物膜中的细菌维持在低代谢和缓慢生长的状态,使其对外界刺激如抗菌药物不敏感。掌握CRAB生物膜的产生与否,以及产膜菌的耐药模式,有助于完善抗菌药物使用政策。临床上应提高生物膜检测水平,更合理的选择抗菌药物,减少耐药发生[19]。
综上所述,该院CRAB耐药形势严峻,且存在以A型和E型为主的不同克隆型传播,生物膜形成能力的增强能提高菌株的耐药性,治疗时应优先选择具有清除生物膜作用的抗菌药物,减少CRAB医院感染的发生。

